miR-34a通过Wnt/β-catenin通路在氯胺酮致发育期大鼠海马神经元凋亡中的作用
2021-03-02赵晨璐赵以林
赵晨璐,赵以林,张 雪
1)驻马店市中心医院麻醉科 河南驻马店 463000 2)华中科技大学同济医学院附属同济医院麻醉科 武汉 430032
研究[1]表明,常用的麻醉药在人和动物中均会诱导海马神经元变性和凋亡,从而导致学习和记忆障碍。氯胺酮是一种广泛用于儿科麻醉的麻醉剂,主要通过阻断N-甲基-D-天冬氨酸型谷氨酸受体发挥作用[2]。研究[3]表明,氯胺酮会导致新生SD大鼠海马细胞凋亡,从而导致空间学习和记忆障碍。miRNA是一种小的非编码RNA,通过与靶mRNA的3’非翻译区(UTR)结合来调控基因的表达,在各种细胞进程中发挥着重要作用,如调节大脑发育(包括神经发生和成熟、皮质神经病变和神经退行性疾病)[4-6]。miR-34a在成年哺乳动物大脑中高度表达,并参与一系列神经发育和神经病理学进程[7]。研究[8]表明,miR-34a低表达可改善丙泊酚麻醉引起的神经毒性和认知功能障碍。已知miR-34a可能通过Wnt/β-catenin信号通路调节大鼠心肌梗死后的细胞凋亡[9]。本研究旨在观察miR-34a对氯胺酮致发育期大鼠海马神经元凋亡及Wnt/β-catenin通路的影响。
1 材料与方法
1.1材料7 d龄雄性SD大鼠购自河北医科大学实验动物中心。HEK-293细胞购自美国典型培养物保藏中心。 盐酸氯胺酮注射液购自江苏恒瑞医药股份有限公司;兔抗Bcl-2、Bax、Cyclin D1、β-catenin和GAPDH抗体购自Abcam公司,兔抗Wnt1抗体购自R&D Systems 公司,兔抗T细胞因子-4 (TCF-4)抗体购自Thermo Scientific公司;Neurobasal培养基购自南京森贝伽生物科技有限公司;miR-34a模拟物 (miR-34a)、miR-34a模拟物阴性对照 (miR-NC)、miR-34a抑制剂 (anti-miR-34a)、miR-34a 抑制剂阴性对照 (anti-miR-NC)、Wnt1 siRNA(si-Wnt1)、si-Wnt1阴性对照(si-NC)和anti-miR-NC、anti-miR-34a慢病毒均购自上海吉玛制药技术有限公司;反转录试剂盒和SYBR Premix Ex TaqTMⅡ购自TaKaRa公司;荧光素酶报告基因试剂盒购自北京全式金公司;TUNEL检测试剂盒购自上海罗氏制药有限公司;Lipofectamine2000购自Invitrogen公司。流式细胞仪购自美国BD公司;紫外分光光度计购自美国哈希公司。
1.2miR-34a和Wnt1靶向关系的预测和鉴定应用TargetScan靶基因预测软件预测miR-34a与Wnt1基因的结合位点。采用双荧光素酶报告实验鉴定两者的靶向关系:针对Wnt1 3’UTR端序列构建野生型(WT)和突变型(MUT)报告基因质粒。将Wnt1的WT和MUT载体分别与miR-NC、miR-34a共转染至HEK-293细胞,48 h后检测荧光素酶活性。
1.3氯胺酮对发育期海马神经元miR-34a表达、凋亡及Bax、Bcl-2蛋白表达的影响取7 d龄雄性SD大鼠海马组织,胰蛋白酶消化获得单个细胞。Neurobasal培养基将细胞重悬,按2×106个/mL接种至培养皿,37 ℃、体积分数5%CO2条件下培养,每3 d更换一半培养液。3 d后,将5 mg/L阿糖胞苷C添加至培养皿内孵育24 h,防止神经胶质细胞增殖。向海马神经元中加入氯胺酮(终浓度为0.2 mg/L)[10],37 ℃、体积分数5%CO2条件下孵育24 h,以未处理的海马神经元为空白对照。
收集2组细胞,Trizol法提取总RNA,反转录获得cDNA。miR-34a上游引物5’-GGTCACAAGAC CCTCACCTG-3’, 下游引物5’-TCACAGCAGAC CCTTGATGT-3’。内参U6上游引物5’-CTCGCT TCGGCAGCACATATACT-3’,下游引物5’-ACGCT TCACGAATTTGCGTGTC-3’。反应体系:SYBR Premix Ex TaqTMⅡ(2×) 12.5 μL,上、下游引物各1 μL,cDNA模板2 μL,dH2O 8.5 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法计算miR-34a的相对表达水平。实验重复3次。
收集2组细胞,预冷PBS洗涤后,加500 μL 结合缓冲液重悬,先后加入Annexin V-FITC和PI各10 μL,分别室温避光孵育10 min,随后上流式细胞仪检测细胞凋亡,计算凋亡率。实验重复3次。
收集2组细胞,提取总蛋白,BCA法检测蛋白浓度。取30 μg蛋白进行SDS-PAGE,湿转法将蛋白转至PVDF膜上。100 g/L脱脂奶粉室温封闭3 h,加入一抗(Bcl-2抗体按1∶1 000稀释,Bax抗体按1∶2 000稀释),4 ℃过夜孵育。以辣根过氧化物酶标记的二抗(1∶5 000稀释)室温孵育1 h后,ECL发光、曝光。Image J分析条带灰度值,以目的条带与GAPDH条带灰度值的比值表示目的蛋白的相对表达量。实验重复3次。
1.4上调或抑制miR-34a的表达对氯胺酮处理的发育期海马神经元中Wnt/β-catenin通路相关蛋白表达的影响7 d龄雄性SD大鼠海马神经元以4×105个/孔接种于6孔板,以终浓度为0.2 mg/L的氯胺酮处理24 h 后分为4组。miR-NC组、miR-34a组、anti-miR-NC组和anti-miR-34a组分别给予终浓度为50 nmol/L的miR-NC、miR-34a、anti-miR-NC和anti-miR-34a,并和Lipofectamine2000室温孵育20 min,随后37 ℃、体积分数5%CO2条件下培养48 h。提取4组细胞总蛋白,同上检测和分析Wnt/β-catenin通路相关蛋白的表达(Wnt1和β-catenin抗体按1∶1 000稀释,TCF-4和Cyclin D1抗体按1∶2 000稀释)。实验重复3次。
1.5抑制miR-34a及Wnt1的表达对氯胺酮诱导的SD大鼠空间学习能力、海马组织中miR-34a的表达及细胞凋亡的影响
1.5.1 大鼠分组与处理 7 d龄SD大鼠于安静、舒适条件下饲养,由母鼠喂养。1周后,将SD大鼠随机分为5组:空白对照组、氯胺酮组、anti-miR-NC+si-NC组、 anti-miR-34a+si-NC组 和anti-miR-34a+si-Wnt1组,每组6只。空白对照组大鼠腹腔和左侧大脑侧脑室海马注射生理盐水,其余4组大鼠除腹腔注射80 mg/kg氯胺酮[11]外,分别于大脑左侧侧脑室海马注射4 μL生理盐水、2 μL anti-miR-NC和2 μL si-NC慢病毒液、2 μL anti-miR-34a和2 μL si-NC慢病毒液、2 μL anti-miR-34a和2 μL si-Wnt1慢病毒液,1次/d,连续3 d。操作结束后,将大鼠放入暖箱并保持低流量氧气输送,直至苏醒。大鼠与母鼠的分离时间均为250 min[12]。
1.5.2 5组大鼠空间学习能力检测 末次给药24 h后,5组大鼠各取3只,养至2个月大时,进行Morris水迷宫实验。实验装置由圆形水池(直径200 cm,高60 cm)和平台组成,水温(25.0±1.0) °C。将大鼠面向池壁放入池中,让其自由寻觅平台,并在平台上休息30 s,如120 s内未找到平台则将其手动放至平台休息30 s。每天训练1次,连续训练5 d。训练结束后,测试大鼠从下水至第1次找到平台的时间,即逃避潜伏期。
1.5.3 5组大鼠海马组织中miR-34a表达水平及细胞凋亡检测 末次给药24 h后,每组取3只大鼠,腹腔注射戊巴比妥那(80 mg/kg)麻醉后处死,收集新鲜海马组织,-80 ℃条件下保存。采用qRT-PCR法测定海马组织中miR-34a的表达,方法同上。实验重复3次。
以40 g/L多聚甲醛固定大鼠海马组织,石蜡包埋后切片。二甲苯脱蜡,梯度乙醇水化。采用TUNEL试剂盒检测神经元凋亡。
1.6统计学处理采用SPSS 21.0处理数据。采用两独立样本t检验比较miR-NC、miR-34a组荧光素酶活性以及空白对照组与氯胺酮组海马神经元miR-34a表达、细胞凋亡率及凋亡相关蛋白表达的差异;采用单因素方差分析比较4组海马神经元Wnt/β-catenin信号通路相关蛋白表达的差异以及5组大鼠逃避潜伏期、海马组织miR-34a的表达和细胞凋亡率的差异,两两比较采用SNK-q检验;检验水准α=0.05。
2 结果
2.1miR-34a与Wnt1基因靶向关系的预测和验证预测的miR-34a与Wnt1 3’UTR结合位点见图1。双荧光素酶报告实验结果见表1。miR-34a与Wnt1-WT报告基因共转染的细胞荧光素酶活性降低,而与Wnt1-MUT共转染的细胞的荧光素酶活性无明显变化。
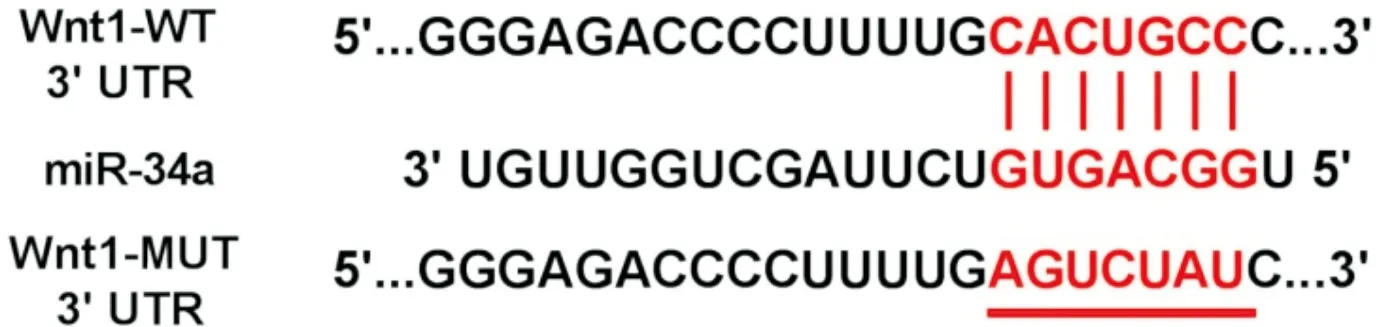
图1 miR-34a与Wnt1 3’UTR结合位点
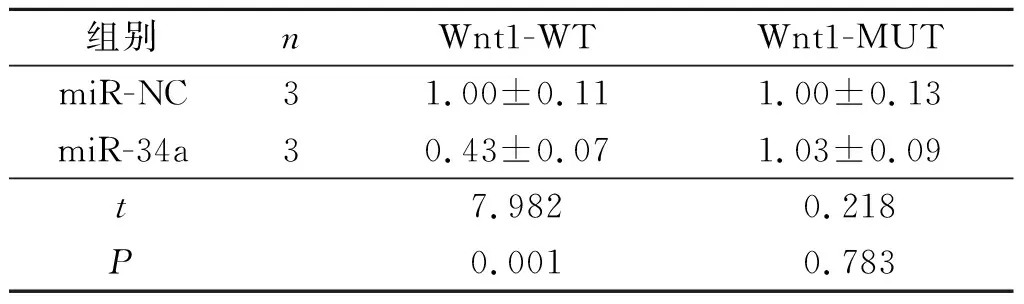
表1 双荧光素酶报告实验结果
2.2氯胺酮对海马神经元中miR-34a表达、凋亡及Bax、Bcl-2蛋白表达的影响结果见图2和表2。与空白对照组相比,海马神经元经氯胺酮处理后,miR-34a表达、细胞凋亡率和Bax蛋白表达均升高,Bcl-2蛋白表达降低。
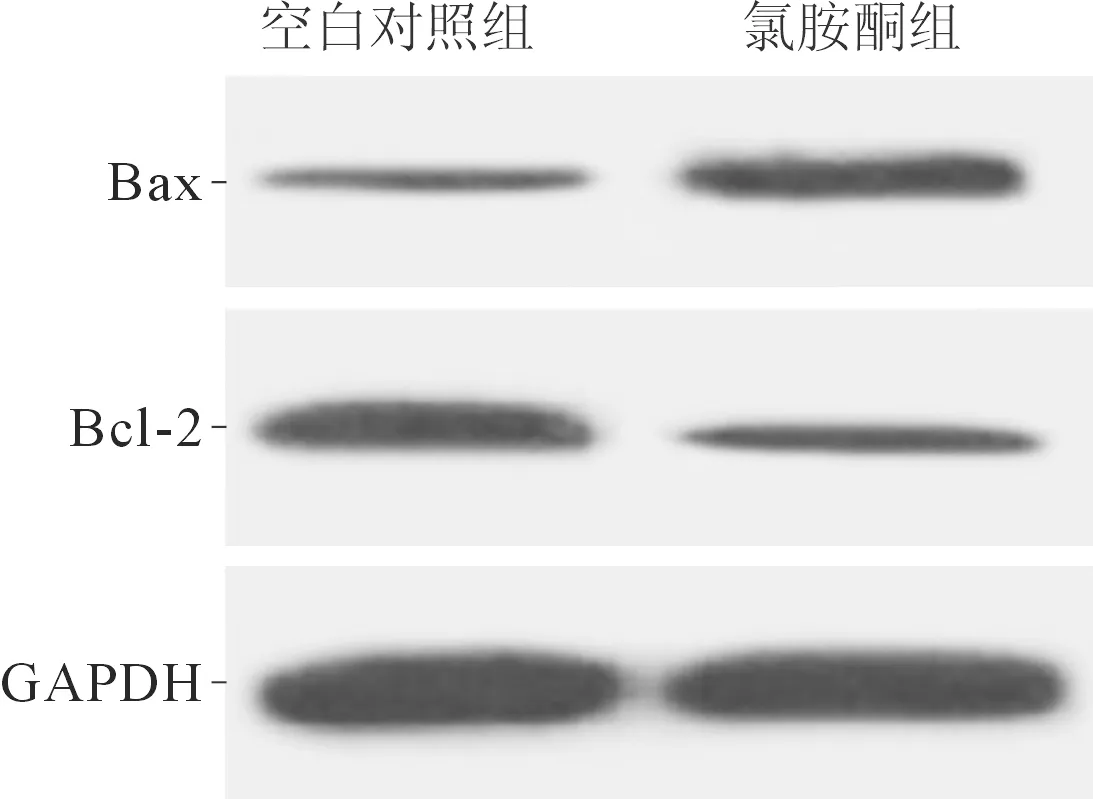
图2 2组海马神经元中Bax、Bcl-2蛋白的表达
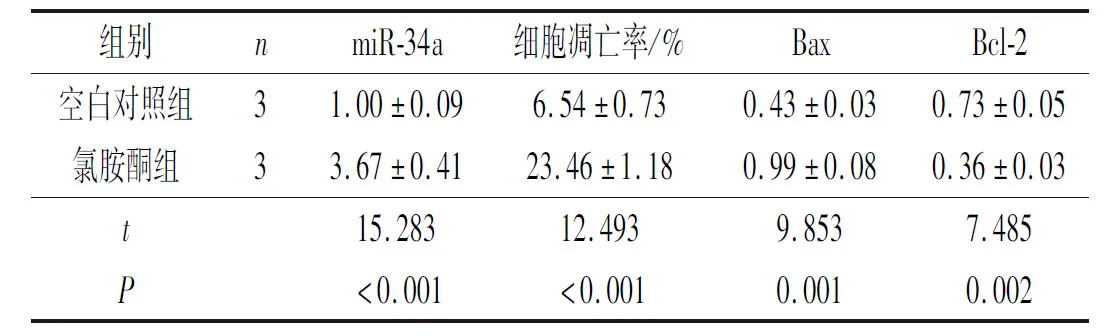
表2 2组海马神经元中miR-34a表达、细胞凋亡率及凋亡相关蛋白表达的比较
2.3上调或抑制miR-34a的表达对氯胺酮处理的海马神经元中Wnt/β-catenin通路相关蛋白表达的影响结果见图3和表3。与miR-NC组相比,miR-34a组Wnt1、TCF-4、Cyclin D1和β-catenin蛋白表达均降低;与anti-miR-NC组相比,anti-miR-34a组上述蛋白的表达均升高。
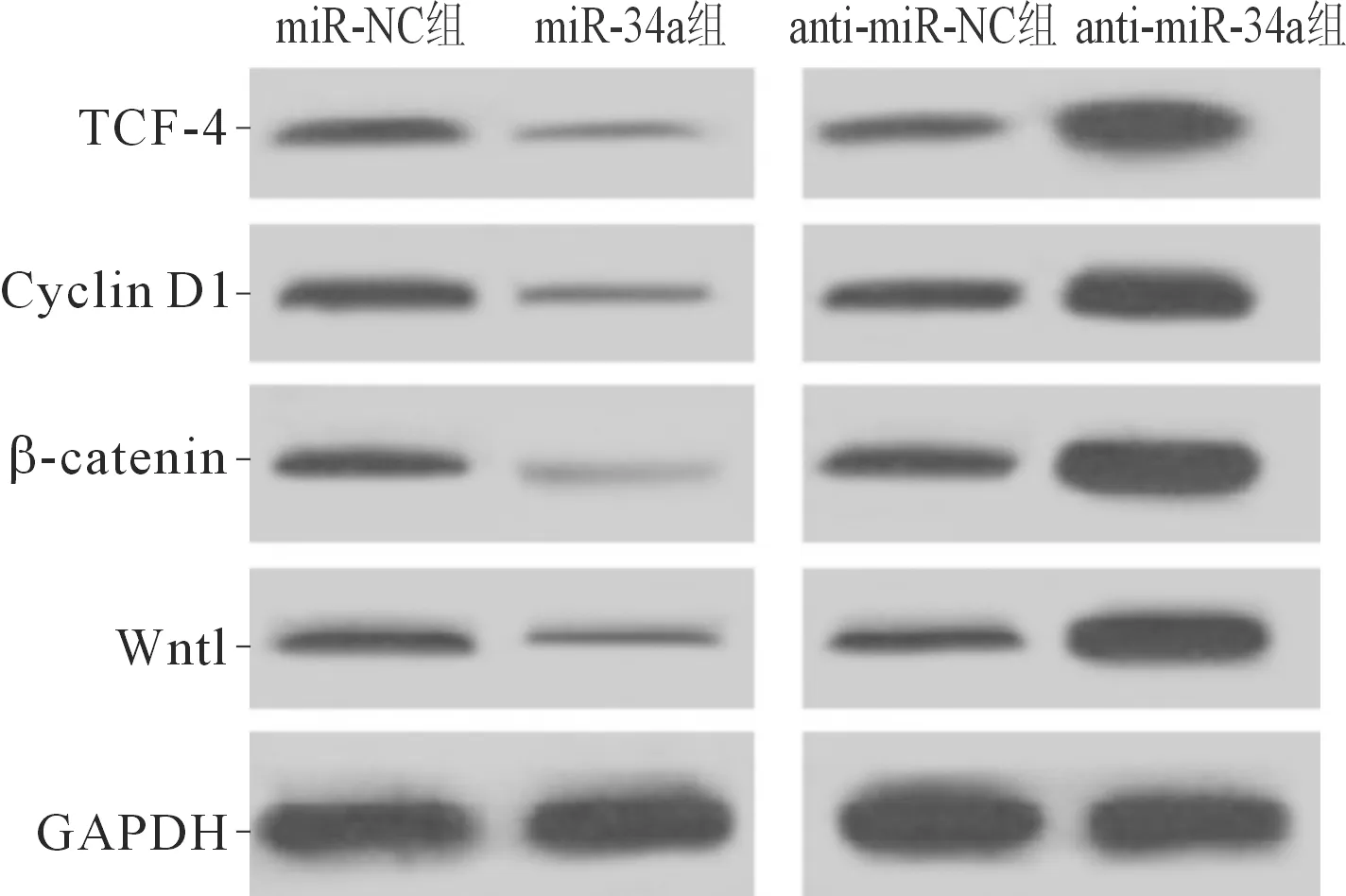
图3 4组海马神经元中Wnt/β-catenin信号通路相关蛋白的表达
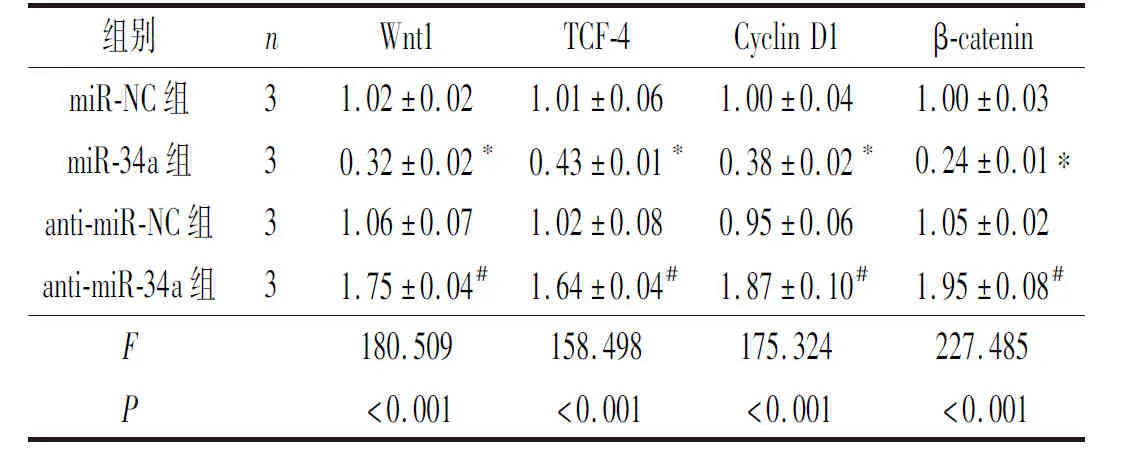
表3 4组海马神经元Wnt/β-catenin信号通路相关蛋白表达的比较
'2.4抑制miR-34a及Wnt1的表达对氯胺酮诱导的SD大鼠空间学习能力、海马组织中miR-34a的表达和细胞凋亡的影响结果见图4、表4。与空白对照组相比,氯胺酮组大鼠逃避潜伏期延长,海马组织中miR-34a表达和细胞凋亡率升高;与anti-miR-NC+si-NC组相比,anti-miR-34a+si-NC组大鼠逃避潜伏期缩短,海马组织中miR-34a表达和细胞凋亡率降低;与anti-miR-34a+si-NC组相比,anti-miR-34a+si-Wnt1组大鼠逃避潜伏期延长,海马组织中细胞凋亡率升高。

图4 5组大鼠海马组织TUNEL染色结果(×400)
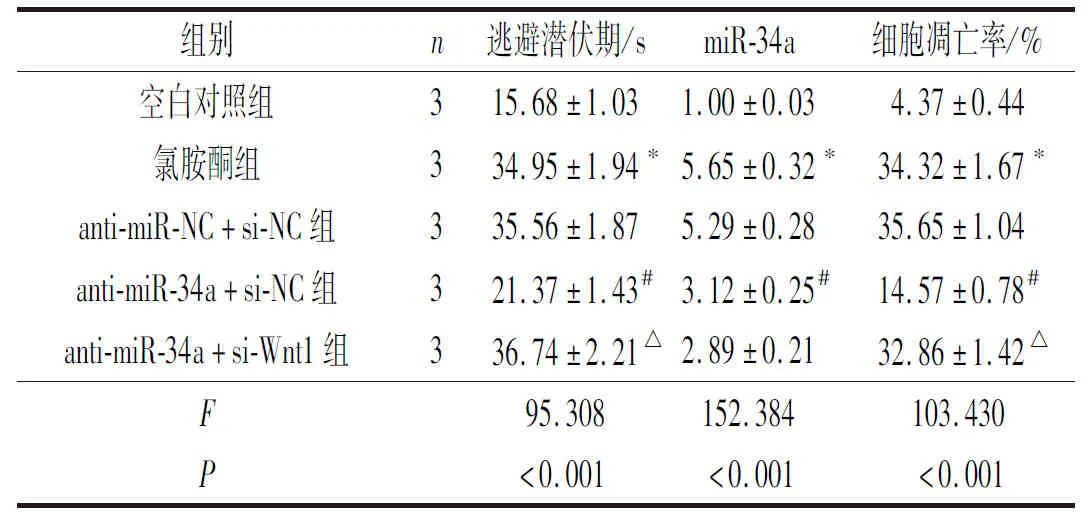
表4 5组SD大鼠逃避潜伏期、海马组织miR-34a的表达和细胞凋亡率的比较
3 讨论
氯胺酮是一种在临床实践中被广泛使用的麻醉剂。研究[12-13]表明,氯胺酮可以促进人和动物大脑发育中的神经元死亡;使用氯胺酮麻醉怀孕大鼠可能会促进胎儿海马的自噬和细胞凋亡。有研究[14]显示,包括miR-34a在内的40多种miRNA在麻醉剂(七氟醚、异氟烷、异丙酚和氯胺酮)诱导的神经毒性中具有调节作用。此外,miR-34a基因沉默可通过调节Notch信号通路抑制神经元凋亡,改善癫痫小鼠的空间认知能力并保护海马神经[15-16]。本研究结果表明,氯胺酮处理会诱导发育期SD大鼠海马神经元中miR-34a表达和细胞凋亡率升高,并导致大鼠空间学习能力障碍;下调miR-34a的表达则会抑制氯胺酮致发育期大鼠海马组织中的细胞凋亡并改善其空间学习能力。
Wnt/β-catenin信号通路在多细胞真核生物中高度保守,与细胞凋亡、中性干细胞模式化以及不同细胞类型中的细胞增殖和分化密切相关[17]。Wnt/β-catenin信号通路的激活与神经保护作用密切相关[18]。Wnt1是Wnt/β-Catenin信号通路的关键分子。有研究[9]表明,miR-34a靶向Wnt1通过Wnt/β-catenin信号通路调节大鼠心肌梗死后的细胞凋亡。本研究通过生物信息学分析预测软件和双荧光素酶报告实验证明Wnt1与miR-34a存在靶向关系。体内外实验证明,氯胺酮处理会升高发育期大鼠海马神经元中miR-34a的表达,促进细胞凋亡及凋亡相关因子Bax蛋白的表达,抑制Bcl-2蛋白的表达;上调miR-34a的表达可抑制经氯胺酮处理的海马神经元中Wnt/β-catenin信号通路相关蛋白的表达,下调miR-34a的表达则可上调该信号通路相关蛋白的表达;氯胺酮处理会升高发育期SD大鼠海马组织中miR-34a表达,促进细胞凋亡,导致其空间学习能力障碍,下调miR-34a的表达可抑制氯胺酮致大鼠海马组织中细胞凋亡并改善其空间学习能力,低表达Wnt1则可减弱上述改善作用,提示调低miR-34a可能通过Wnt1促进经氯胺酮处理的发育期SD大鼠海马神经元中Wnt/β-catenin信号通路激活,抑制海马神经元凋亡。
综上所述,miR-34a可促进氯胺酮致发育期大鼠海马神经元凋亡,其机制可能与靶向Wnt1调节Wnt/β-catenin通路有关。后续将进一步探讨miR-34a对氯胺酮导致的发育期大鼠其他生物学特性的影响。