miR-424-5p靶向PHD2对骨性关节炎软骨细胞凋亡及炎症因子分泌的影响
2021-03-02符传恭陆志夫宋世锋苟学健
符传恭, 陆志夫, 宋世锋,黄 健,苟学健
1)海口市中医医院骨科 海口 570000 2)海南医学院第二附属医院骨二科 海口 570000
骨性关节炎是由关节退化引起的一种以关节软骨发生破坏为主的慢性关节病,常发生于中老年人。该病严重者需要进行关节置换或截骨术,严重影响中老年患者的晚年生活质量[1-2]。微小RNA(microRNA,miRNA) 由18~22个核苷酸组成,其通过抑制靶mRNA的转录或蛋白翻译在多种疾病中发挥重要作用[3]。很多miRNA在骨性关节炎软骨细胞中异常表达,并参与骨性关节炎的发展,其中包括miR-424-5p[4],但是其在骨性关节炎中的作用尚不十分清楚。脯氨酸羟化酶2(proline hydroxylase 2,PHD2)属于PHDs家族,在骨修复、骨再生、炎症、造血中发挥着重要作用[5],推测PHD2、miR-424-5p可能参与骨性关节炎的调控。本研究拟以成人骨性关节炎软骨细胞HC-OA为研究对象,检测其中miR-424-5p、PHD2的表达,观察过表达miR-424-5p、过表达PHD2对HC-OA细胞凋亡、炎症因子分泌的影响,为骨性关节炎的治疗提供新的理论依据。
1 材料与方法
1.1材料成人软骨细胞HC购自美国Scien Cell公司,HC-OA购自Sigma公司。胎牛血清购自杭州四季青公司,411K-500培养基购自美国Cell Applications公司,RNA抽提试剂盒、qRT-PCR试剂盒均购自TaKaRa公司,IL-6、IL-1β、IL-17 ELISA检测试剂盒,蛋白裂解液,ECL发光剂均购自上海碧云天生物技术有限公司,双荧光素酶报告基因检测试剂盒购自Promega公司,Annexin V-FITC/PI 双染细胞凋亡检测试剂盒购自上海贝博生物科技公司,兔抗人PHD2多克隆抗体购自上海瑶韵生物公司,辣根过氧化物酶标记的羊抗兔IgG购自美国Abcam公司,miR-424-5p模拟物、miR-NC购自广州锐博生物公司,pcDNA、pcDNA-PHD2购自上海吉玛基因公司。
1.2细胞培养HC和HC-OA细胞用含体积分数15%胎牛血清的411K-500培养基在37 ℃、体积分数5%CO2的细胞培养箱中常规培养、传代。
1.3HC和HC-OA中miR-424-5p及PHD2mRNA和蛋白表达的检测采用qRT-PCR法检测细胞中miR-424-5p和PHD2 mRNA的表达。用RNA抽提试剂盒提取细胞中总RNA,反转录成cDNA。miR-424-5p上游引物5’-ATAAGATCTGGCTCCAC CTGCAGCTCCTGGAAATC-3’,下游引物5’-ATAAGATCTGCGCCCCAGCCTAGCCAGGAATAC-3’;PHD2上游引物5’-GCACGACACCGGGAAGTT-3’ ,下游引物5’-CCAGCTTCCCGTTACAGT-3’;U6 上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’;GAPDH上游引物5’-TCCCTCAAGATTGCTAGCAA-3’,下游引物5’-AGATCCACAACGGATACATT-3’。引物均由上海生工生物工程股份有限公司设计合成。PCR反应体系:SYBR Green Master Mix 10 μL,上、下游引物各0.8 μL,cDNA 1 μL,ddH2O补足至20 μL。反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s,共循环40次。以U6、GAPDH为内参,用2-ΔΔCt法计算miR-424-5p、PHD2 mRNA的表达。实验重复3次。
采用Western blot法检测细胞中PHD2蛋白的表达。分别收集HC细胞与HC-OA细胞,加入RIPA裂解液充分裂解,提取总蛋白,定量后沸水浴变性10 min,1 000 r/min离心1 min后取上清进行蛋白电泳、转膜、封闭和抗体孵育,一抗(兔抗人PHD2多克隆抗体)按1∶500稀释,二抗(辣根过氧化物酶标记的羊抗兔IgG)按1∶1 000稀释。用超敏ECL发光试剂盒进行显影曝光。以GAPDH为内参,Quantity One 4.62分析PHD2蛋白的相对表达量。实验重复3次。
1.4miR-424-5p与PHD2靶向关系的预测及验证根据生物信息学在线预测软件Starbase(http://starbase.sysu.edu.cn)预测miR-424-5p与PHD2之间的靶向结合位点。由上海吉玛公司设计合成含PHD2 3’UTR(WT)片段和含PHD2 3’UTR突变体(MUT)片段的质粒,再将其克隆至psiCHECK2,构建荧光素酶报告载体PHD2 3’UTR-WT和PHD2 3’UTR-MUT(WT-PHD2和MUT-PHD2),分别与miR-424-5p模拟物、miR-NC共转染至HC-OA,转染24 h后收集细胞,按双荧光素酶报告基因检测试剂盒技术手册操作,检测荧光素酶活性。
1.5过表达miR-424-5p对HC-OA细胞凋亡、炎症因子分泌及PHD2表达的影响HC-OA细胞按照每孔1×104个的密度接种于6孔板,使用不含胎牛血清的细胞培养液与miR-NC、miR-424-5p模拟物混合后室温孵育5 min(A液),Lipofectamine2000转染试剂与不含胎牛血清的细胞培养液充分混合(B液),A液与B液充分混匀后室温孵育20 min,并将其加入HC-OA细胞,转染6 h弃上清液后更换正常培养液,并继续培养48 h,分别记为miR-NC组、miR-424-5p组。收集2组HC-OA细胞接种于24孔板(1×104个/孔),加入500 μL Binding Buffer重悬,分别加入5 μL Annexin V-FITC与5 μL PI,室温孵育10 min后应用流式细胞仪检测细胞凋亡,计算细胞凋亡率。实验重复3次。
采用ELISA法检测miR-NC组、miR-424-5p组HC-OA细胞培养液上清中炎症因子IL-6、IL-1β、IL-17的含量,严格按照试剂盒说明书操作。实验重复3次。同时检测miR-424-5p及PHD2 mRNA和蛋白的表达,方法同前。
1.6过表达PHD2对HC-OA细胞中miR-424-5p表达、细胞凋亡及炎症因子分泌的影响HC-OA细胞按照每孔1×104个的密度接种于6孔板,分为miR-424-5p组、miR-424-5p+pcDNA组和miR-424-5p+pcDNA-PHD2组,同上方法转染处理。48 h后,同上检测miR-424-5p表达、细胞凋亡及细胞培养液上清中炎症因子IL-6、IL-1β、IL-17的含量。
1.7统计学处理采用GraphPad Prism 7.0处理数据。采用两独立样本t检验比较 HC和HC-OA中miR-424-5p及PHD2 mRNA和蛋白表达水平的差异,以及miR-NC组和miR-424-5p组miR-424-5p表达、细胞凋亡率、炎症因子分泌水平及PHD2表达的差异,用单因素方差分析比较miR-424-5p组、miR-424-5p+pcDNA组和miR-424-5p+pcDNA-PHD2组miR-424-5p表达、细胞凋亡率及炎症因子分泌水平的差异,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1HC和HC-OA中miR-424-5p及PHD2mRNA和蛋白表达水平的比较与HC组相比,HC-OA组细胞中miR-424-5p 表达降低,PHD2 mRNA和蛋白的表达水平升高(P<0.05),见图1、表1。
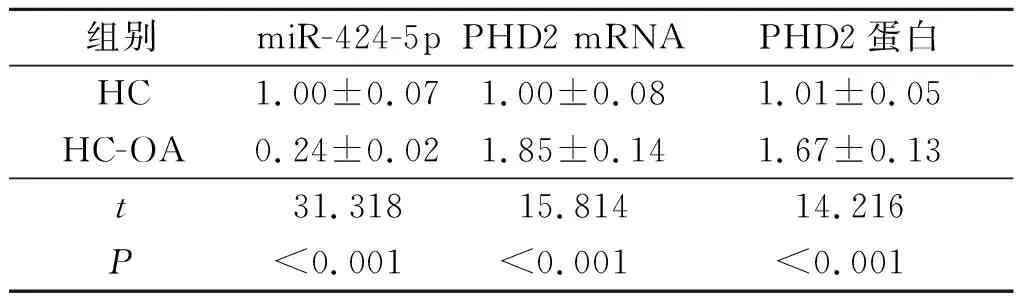
表1 HC和HC-OA中miR-424-5p及PHD2 mRNA和蛋白表达的比较(n=3)
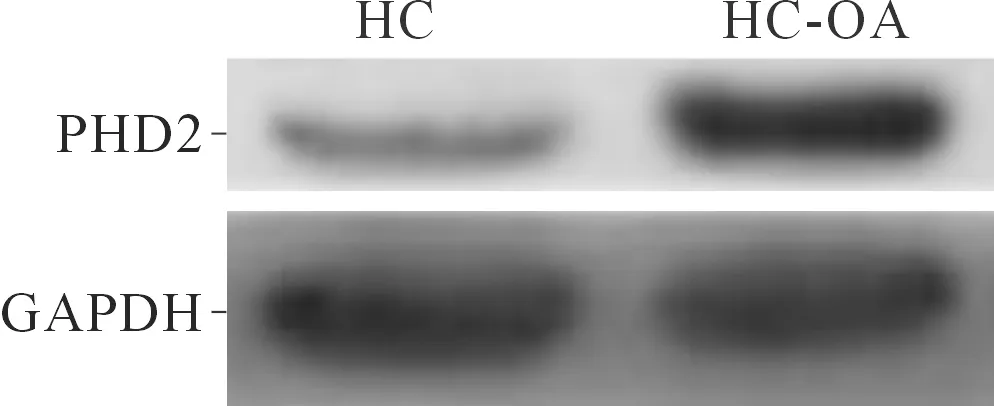
图1 HC和HC-OA细胞中PHD2蛋白的表达
2.2miR-424-5p与PHD2靶向关系验证生物信息学软件预测显示, miR-424-5p与PHD2的3’UTR存在9个互补的核苷酸序列,见图2。转染WT-PHD2和miR-424-5p模拟物的HC-OA细胞荧光素酶活性降低(P<0.05),而转染MUT-PHD2和miR-424-5p模拟物的HC-OA细胞荧光素酶活性无明显变化。见表2。

图2 miR-424-5p与PHD2的靶向结合位点
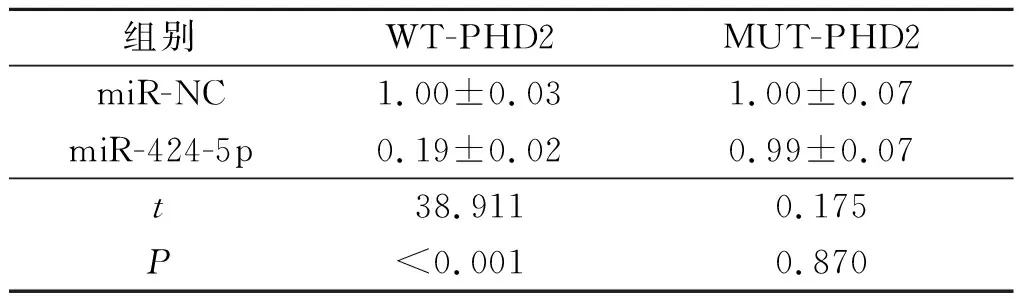
表2 miR-424-5p与PHD2靶向关系的验证结果(n=3)
2.3过表达miR-424-5p对HC-OA细胞中miR-424-5p的表达、细胞凋亡、炎症因子分泌水平及PHD2mRNA和蛋白表达的影响与miR-NC组相比,miR-424-5p组细胞中miR-424-5p表达升高,细胞凋亡率降低,IL-6、IL-1β、IL-17的分泌减少,PHD2 mRNA和蛋白的表达均降低(P<0.05)。见图3、表3。

图3 2组细胞中PHD2蛋白的表达
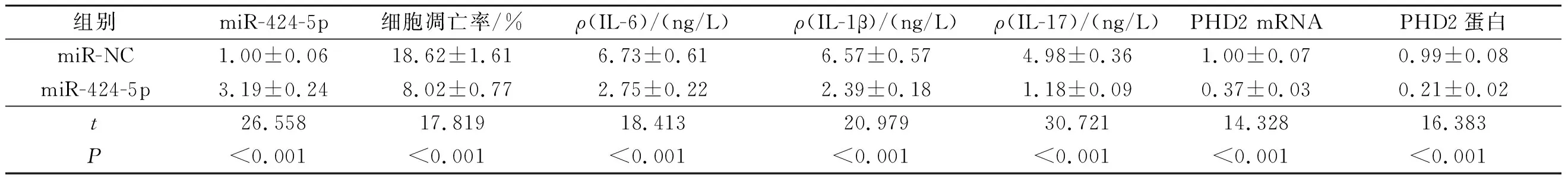
表3 过表达miR-424-5p对HC-OA细胞中miR-424-5p表达、细胞凋亡、炎症因子分泌水平及PHD2表达的影响(n=3)
2.4过表达PHD2对HC-OA细胞中miR-424-5p表达、细胞凋亡及炎症因子分泌的影响与miR-424-5p+pcDNA组相比,miR-424-5p+pcDNA-PHD2组细胞中miR-424-5p表达降低,细胞凋亡率升高,培养液上清中IL-6、IL-1β、IL-17的水平均升高(P<0.05),见表4。

表4 过表达PHD2对对HC-OA细胞中miR-424-5p的表达、骨性关节炎软骨细胞凋亡和炎症因子分泌的影响(n=3)
3 讨论
miRNA参与人类多种疾病的发生发展过程,其中包括骨性关节炎[6]。高杰等[7]报道,miR-424在骨髓间充质干细胞分化的骨细胞和软骨细胞中的表达均升高,提示miR-424在骨髓间充质干细胞的更新和分化中具有重要作用。Xia等[8]发现,miR-424-5p在退化的软骨间充质干细胞中的表达异常降低。Wang等[9]在膝关节骨性关节炎的研究中发现,miR-582-5p、miR-424-5p的表达均明显降低,提示二者参与软骨的硬化过程。基于以上研究,我们推测miR-424-5p在骨关节软骨的分化及正常功能维持中具有重要作用,其对骨性关节炎软骨细胞的存活可能具有一定的积极影响。本研究结果显示,miR-424-5p在骨性关节炎软骨细胞中的表达降低,与前文的研究结果一致。进一步研究发现,过表达miR-424-5p能够抑制骨性关节炎软骨细胞的凋亡和炎症因子的分泌,提示miR-424-5p可抑制骨性关节炎软骨细胞凋亡,并具有抗炎的作用。
本研究通过生物信息学分析、双荧光素酶报告实验验证miR-424-5p可靶向负调控PHD2。研究[10]显示HIF-1α信号通路在关节炎的发生、发展中发挥重要的促进作用,而PHDs是HIF-1α信号通路的关键调节因子之一。据报道[11]PHD2是调节HIF水平和关节炎细胞中血管生成基因表达的主要羟化酶,其通过HIF-α调节与关节炎相关的反应,且体外沉默PHD2能够诱导关节炎患者血管生长因子的增加,减轻患者的病情。Cheng等[12]的研究显示,PHD2是软骨细胞分化的负调节因子,其通过调节HIF-1α信号传导参与抑制关节软骨祖细胞的分化。Lindsey等[13]发现,PHD2可介导软骨细胞和成骨细胞基因中5-羟甲基胞嘧啶的增加,从而导致骨性关节炎和骨质疏松症等衰弱性疾病。本研究结果显示,PHD2在骨性关节炎软骨细胞中的表达升高,与前人的研究结果相吻合。此外,本研究证实在骨性关节炎细胞中miR-424-5p可靶向负调控PHD2,而过表达PHD2能够逆转miR-424-5p在骨性关节炎软骨细胞中的表达和抗凋亡、抗炎作用。这一结果揭示了miR-424-5p不仅可以靶向负调控PHD2,相反,PHD2也可以逆向反作用于miR-424-5p,从而发挥对关节炎软骨细胞的调控功能,为miR-424-5p、PHD2在骨性关节炎中的诊断、治疗提供了参考。当然,这一结果如果能在体内实验得到验证将更加充分和全面,这也将是本课题组下一步的研究计划。
综上所述,miR-424-5p可抑制骨性关节炎软骨细胞的凋亡和炎症反应,其机制可能与靶向PHD2有关,这一研究结果为骨性关节炎的治疗提供了新方向。