红花龙胆组培快繁体系研究
2021-03-02钟世浚张碧东赖世婷刘华敏
钟世浚 张碧东 赖世婷 刘华敏
(重庆文理学院园林与生命科学学院,永川 402160)
红花龙胆(Gentiana rhodantha)为龙胆科(Gentianaceae)龙胆属(Gentiana)植物,分布于滇、川、贵、陕、陇、豫、鄂、桂等地,生长在海拔570~1 750 m 的高山灌丛、草地及林下[1],是我国传统的中药材,其主要作用成分为环烯醚萜、裂环烯醚萜类及氧杂蒽酮类化合物[2]。全草入药,具有清热除湿、解毒、止咳的功效,能治湿热黄疸、肺热咳嗽、小便不利等症[3],市场需求量较大。此外,红花龙胆花量大,花型秀美,花色艳丽,观赏价值高,且其自然花期恰逢农历新年,具有作为年宵花的开发潜力。目前红花龙胆还以野外采挖为主,长期采挖导致本来并不丰富的野外蕴藏量日益减少,为了减缓野外红花龙胆减少的压力,人工繁育技术的开发显得越来越迫切。
目前关于红花龙胆的研究,主要集中于资源调查[4]、化学成分分析[5~6]、药理研究[7~9]及适宜生长区[10]等方面,而在组织培养方面的研究还未见报道。龙胆科植物自然繁殖受诸多因素限制,如条叶龙胆种子萌发最佳温度达25℃[11],滇龙胆种子干藏最多保持活力6个月[12],线叶龙胆自然状态下的结籽率低,存在严重的花粉限制[13]等。红花龙胆主要使用顶芽扦插的方法进行繁殖,但插穗选择不当容易造成生根迟缓及生长不良,有性繁殖栽培周期过长,受自然环境限制较大,分株栽培繁殖率低,且植株品质较差,不适合大规模生产[14]。而组织培养繁殖系数高,培养条件可控,能破除自然环境条件的限制,加速红花龙胆的繁殖,因此对红花龙胆的繁殖和推广具有重要意义。尽管红花龙胆的组织培养还未见报道,但是龙胆属的其他种已经有零星报道。目前对龙胆属其他种的组织培养的研究,其消毒方法主要采用酒精—升汞组合消毒法,消毒剂毒性高,对环境污染大。此外,已报道的龙胆属植物[15~17]及一些草本植物[18~19]培养基多探索6-BA 对不定芽诱导和增殖的影响,在激素上的使用存在一定的局限性。廉玉姬等人探索了玉米素对草本植物朝鲜白头翁不定芽增殖影响,并取得了较高的不定芽再生率[20];吴丽芳等人探索并对比了6-BA 与玉米素对草本植物万寿菊不定芽分化率的影响,发现在生长素种类相同的情况下,玉米素组的不定芽分化率普遍高于6-BA 组[21];闫海霞等人探索了玉米素对草本植物永福报春苣苔不定芽增殖的影响,取得了较高的不定芽增殖系数[22]。本实验以红花龙胆叶片及带节茎段为外植体,使用次氯酸钠作为消毒剂,降低了对环境的污染;以玉米素(ZT)作为细胞分裂素,以期获得较高的增殖系数,以此建立红花龙胆的快繁体系,为红花龙胆的快速繁殖奠定基础。人工繁育的推广可减少野外采挖,缓解野生红花龙胆资源匮乏现状,并为观赏红花龙胆的开发提供条件。
1 材料与方法
1.1 实验材料
供试红花龙胆植株于2019 年4 月采集于四川省泸州市古蔺县,移栽于重庆文理学院特色植物研究院的大棚中。实验于重庆文理学院特色植物研究院的实验室进行。
1.2 实验方法
1.2.1 外植体消毒处理筛选
采用生长健康的红花龙胆带节茎段和叶片为外植体,冲洗干净后放入烧杯中,盖上纱布用自来水冲洗45 min后置于超净台上。再经5%、8%次氯酸钠溶液振荡消毒5、8、10 min后,无菌水振荡清洗5~6次,每次不低于1 min,最后用无菌滤纸吸干表面水分,将其接入MS培养基上,每个处理接种3瓶,每瓶5片,3次重复,1周后统计外植体的污染率和褐化率。
1.2.2 外植体筛选
选用健康叶片与带节茎段接种在附加IBA 浓度为0.30 mg·L-1,ZT浓度分别为0.5、1.0、1.5 mg·L-1的MS 培养基(附加30 g·L-1蔗糖,6 g·L-1琼脂,pH调至6.8~7.0,下同)上进行最适外植体筛选,叶片和带节茎段每梯度均接种5瓶,每瓶4片(段),2周后统计外植体的污染率和褐化率。
1.2.3 诱导增殖培养基筛选
使用带节茎段为外植体材料,在MS 培养基中添加不同浓度ZT 和IBA,其中ZT 浓度为1.0、1.5、2.0、2.5、3.0 mg·L-1,IBA 浓度为0.1、0.3、0.5 mg·L-1,每梯度接种5 瓶,每瓶接种6 个外植体,3 次重复,培养1月后进行增殖出芽统计。
1.2.4 生根培养基筛选
将丛生芽分割为单独的植株,并接种入添加IBA 浓度分别为0.1、0.3、0.5 mg·L-1的1/2MS 培养基(附加30 g·L-1蔗糖,6 g·L-1琼脂,pH 调至6.8~7.0),每梯度接种5 瓶,每瓶接种3 个带顶芽苗,3次重复,1个月后统计生根数量。
1.2.5 炼苗移栽
待幼苗长至4~5 cm 高时,从培养基中取出幼苗,用流水将残留培养基清洗干净后,将其放入装有少量清水的瓶中。开盖于培养室放置3 d,再将瓶转移到室温条件下继续放置3 d 后,将其移栽到V草炭土∶V珍珠岩=2∶1的基质中。
1.2.6 培养条件
培养室温度控制在(25±1)℃内,光照强度1 500 lx,光培养时间16 h·d-1。
1.3 数据分析
采用SPSS 25.0进行数据处理。
2 结果与分析
2.1 不同浓度次氯酸钠对外植体消毒的影响
由表1 可得,次氯酸钠浓度、消毒时间均与外植体的褐化率呈正相关。表明次氯酸钠浓度越高、消毒时间越长对外植体毒害越大。8%次氯酸钠的污染率虽然比5%次氯酸钠更低,但褐化率却大幅上升,达到80%以上。使用5%次氯酸钠对外植体消毒时,随消毒时间延长,污染率明显降低,而褐化率升高不明显。综合各因素,带节茎段与叶片的最适消毒处理均为5%次氯酸钠处理10 min。

表1 消毒实验Table 1 Test for disinfection
2.2 外植体筛选实验
接种时叶片、带节茎段均为翠绿状;培养1 周后叶片明显硬化,无愈伤增殖,带节茎段有少量不定芽开始增殖;培养2 周后多数叶片完全褐化(见图1A),带节茎段的不定芽开始少量增殖(见图1B)。
由表2可知,比较不同培养基中叶和带节茎段各项数据,均表明叶的褐化数大于带节茎段,而增殖数小于带节茎段。经两种外植体褐化率的卡方测验得出,3种培养基中带节茎段的褐化率均极显著低于叶片(P=0.000<0.01),两种外植体增殖率的卡方测验得出,3种培养基中带节茎段的增殖率均显 著 高 于 叶 片(P处理1=0.002<0.05,P处理2=0.016<0.05,P处理3=0.024<0.05)。

表2 外植体筛选实验Table 2 Test for explants
2.3 不同浓度植物激素对不定芽诱导增殖的影响
将采集的红花龙胆枝条进行消毒后,剪取带有一对叶的带节茎段,接种于含有不同浓度的ZT和IBA 的培养基上。在外植体筛选实验中发现,IBA 浓度相同时,较高的ZT 浓度,带节茎段的不定芽增殖数更多,因此在后续不定芽增殖诱导浓度筛选实验中,适当舍弃低浓度ZT 组,向上扩大ZT浓度筛选范围。1周后,已有不定芽被诱导出并陆续增殖;经1 个月不定芽大量增殖(见图2)后对其增殖系数进行统计(见表3)。

表3 不同处理对不定芽诱导增殖的影响Table 3 Effects of medium composition on shoots proliferation
经统计学分析红花龙胆的不定芽增殖系数表明:处理4 的增殖系数比除处理1、5 外的所有处理组差异显著,并且处理4 的丛生芽长势最为健壮。比较各实验因子的影响后,可筛选出适合红花龙胆带节茎段诱导增殖培养基组分为:基础MS+0.1 mg·L-1IBA+2.5 mg·L-1ZT,此时外植体增殖系数最大达8.94。
2.4 不同浓度植物激素对红花龙胆生根的影响
根据表4 及图3 可得,3 种处理的生根率均达100%,随IBA 浓度的增加,生根数虽然呈增多趋势,但IBA 浓度过高会使根变短变细,比较各项因子影响后,可筛选出红花龙胆最佳生根培养基组分为:1/2MS+0.3 mg·L-1IBA,此时平均生根数为34条,平均根长达2.7 cm。
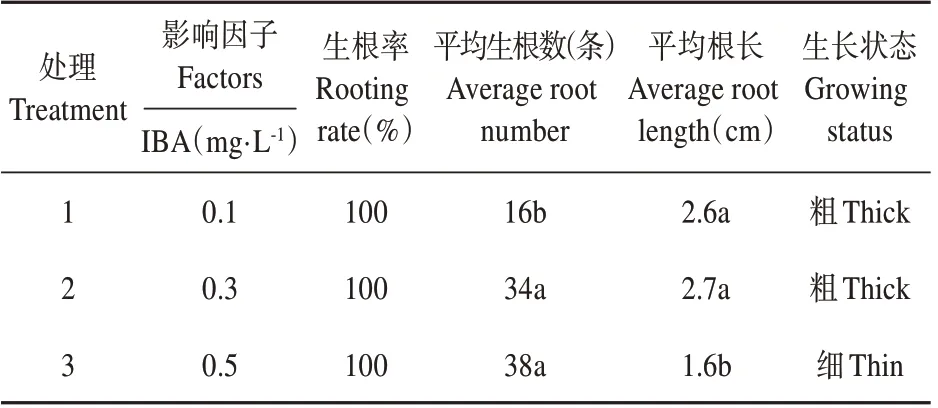
表4 不同IBA浓度对生根的影响Table 4 Effect of IBA concentration on rooting of seedlings
3 讨论
在现有报道中,多用酒精—升汞对龙胆属外植体进行消毒[23~25]。由于升汞具有较大的毒性,在现在的组织培养外植体消毒中已经较少使用。坚龙胆组培的研究中[17],张洁等人先用3%的次氯酸钠溶液浸泡6 min,在无菌水冲洗3~5次后,再用3%的次氯酸钠溶液消毒6 min 的方法进行消毒;在高山龙胆组培的研究中[27],顾地周等人用70%酒精涮洗30s 后,再用3%次氯酸钠溶液浸泡10 min 的方法进行消毒;在东北龙胆组培的研究中[28],孙天国等人发现用70%酒精杀菌60 s 后,再转入3%次氯酸钠溶液中消毒长达25 min 时仍有污染;本研究综合他们的方法并略做改进,利用5%次氯酸钠,消毒10 min,无菌水冲洗3~5 次,依然能对外植体进行有效消毒,且更为方便快捷,污染率为零。
根据细胞的全能性,理论上任何完整的植物细胞都有形成新完整植株的潜力,但是在实践中发现,不同器官的发育能力各不相同。在龙胆属植物的组织培养中,张洁利用坚龙胆腋芽和顶芽[17]、张彩霞等人利用线叶龙胆根[24]、郭美等利用头花龙胆茎段[25]都成功得到了再生苗。本研究分别利用红花龙胆叶片、幼茎和中部带节茎段为外植体进行了实验,结果发现红花龙胆的叶片和幼茎进行消毒处理后容易褐化死亡,不适合作为组织培养的外植体,中部带节茎段褐化率低,成活率高,适合作为外植体,这与郭美和张洁等人的结果相似。但在草龙胆[26]的研究中发现,幼茎可作为体胚诱导的外植体。在滇龙胆[29]的研究中虽然发现叶片可以分化出不定芽,但是分化率极低,这与本研究中叶片外植体高褐化率,低出愈率相吻合,且目前对龙胆属植物的组织培养中,鲜少见到利用叶片外植体获得再生植株的,可能与龙胆属植物叶片含黄酮类物质较多,容易褐化有关。
在张洁的研究中,坚龙胆培养1月的最大增殖系数为7.3[17],最佳培养基为MS+1.0 mg·L-16-BA+0.10 mg·L-1NAA;在郭美的研究中,头花龙胆的最大增殖系数达10.3[25],最佳培养基为MS+0.3 mg·L-16-BA+mg·L-1NAA。但是我们的最大增殖系数为8.94,相较头花龙胆增殖系数较小。这可能因为不同植物对不同类型植物激素,或对激素不同浓度的响应不同有关。
红花龙胆的生根能力较强,在所有的生根培养基中生根率均达到了100%,且在其他的增殖培养基中亦有部分丛生苗生长出根,但是在添加不同浓度IBA 后,红花龙胆生根数量略有差异,其中1/2MS+0.3 mg·L-1IBA最适合作为红花龙胆生根培养基。郭美等人在头花龙胆的组培实验中[25]发现MS+0.1 mg·L-1NAA+0.1 mg·L-16-BA 最适合生根,生根率达100%;席银凯等人在滇龙胆的组培实验中[29]发 现1/2MS+2.0 mg·L-1NAA+0.1 mg·L-16-BA最适合生根,生根率亦达100%;张洁等人在坚龙胆的组培实验中[17]发现1/2MS+0.1 mg·L-1IBA 最适合生根,生根率为93%。而我们的实验结果表明,最适合红花龙胆的生根培养基为1/2MS+0.3 mg·L-1IBA,生根率达100%。从以上报道中可见,不同品种龙胆属植物均能获得较高生根率,可能龙胆属植物具有较强的发根能力。
