外周凝血指标对初诊前列腺癌患者骨转移风险的预测价值
2021-03-02王志杰刘秉乾武玉东
王志杰,刘秉乾,武玉东
(郑州大学第一附属医院泌尿外科,河南郑州 450000)
前列腺癌是我国男性最常见的恶性肿瘤之一,近年来发病率快速上升[1]。前列腺癌最常见的转移部位是骨骼,骨转移患者的治疗手段有限,总体生存率明显降低[2]。早期预测前列腺癌患者骨转移,有益于患者的治疗和预后。凝血指标作为肿瘤微环境的重要组成部分,在恶性肿瘤的发生及进展中发挥着重要作用。国内外研究表明外周凝血指标能够预测多种恶性肿瘤的进展及预后[3]。本文将结合我国指南推荐的与前列腺癌骨转移相关的传统临床指标,回顾性分析外周凝血指标对前列腺癌骨转移风险的预测价值。
1 资料与方法
1.1 研究对象选取2016年1月至2019年10月于郑州大学第一附属医院泌尿外科初次确诊为前列腺癌的332例患者。纳入标准:①经直肠超声引导下前列腺穿刺活检病理明确诊断为前列腺癌;②均于我院行全身骨扫描(emission computed tomography,ECT)及计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查,随访资料完整;③术前1周内已行相关血液检查,并且无影响血液指标的炎症相关因素存在。排除标准:①术前接受放、化疗者;②肝肾功能不全、慢性肺部疾病、心力衰竭等影响相关外周凝血指标的疾病;③血液系统疾病、自身免疫病、骨损伤或患有其他恶性肿瘤者;④最近2周内服用抗凝药物等影响外周凝血指标者。
1.2 患者分组及诊断标准全部患者静脉注射99mTC-MDP,4 h后行全身骨扫描检查。骨转移诊断标准:排除有骨损伤或骨肿瘤病史的患者,骨扫描明确诊断为骨转移者;骨扫描结果不明确者,结合CT或MRI明确诊断。根据是否骨转移将患者分为骨转移组和未转移组。
1.3 观察指标分别收集患者一般资料和临床T分期、Gleason评分(Gleason score,GS)、肿瘤总前列腺特异性抗原(total prostate specific antigen,tPSA)、前列腺特异性抗原密度(prostate specific antigen density,PSAD)、碱性磷酸酶(alkaline phosphatase,ALP)、外周凝血指标(血小板、纤维蛋白原、D-二聚体)等检测结果。前列腺穿刺前1~7 d,清晨采集患者空腹静脉血,电化学发光免疫法测定血清tPSA临界值为4 ng/mL;ALP通过全自动生化分析仪进行测定,临界值为40~130 U/L;纤维蛋白原和D-二聚体采用自动凝血分析仪测定临界值分别为2~4 g/L、0~0.3 mg/L;血小板采用自动血细胞分析仪进行计数,临界值为125×109~350×109个/L(SYSMEX公司产)。临床T分期采用美国癌症联合会(American Joint Committee on Cance,AJCC)第8版前列腺癌TNM分期系统[4]。本研究经郑州大学第一附属医院伦理委员会批准。

2 结 果
2.1 患者的一般资料共332例前列腺癌患者符合条件并纳入研究,中位年龄68(63~74)岁、中位血小板188×109(158.00×109~230.75×109)个/L、中位纤维蛋白原3.06(2.58~3.54)g/L、中位D-二聚体0.14(0.085~0.331)mg/L、中位tPSA为73.19(25.86~145.53)ng/mL、中位GS为7.69(7.00~9.00)、中位PSAD 1.23(0.62~2.94)、中位ALP为72.00(60.25~92.75)U/L。临床T分期T1期52例(15.7%)、T2期104例(31.3%)、T3期100例(30.1%)、T4期76例(22.9%)。
2.2 骨转移组和无骨转移组各项临床指标的比较骨扫描结果显示:骨转移118例(35.5%),无骨转移214例(64.5%)。两组患者之间的临床T分期、GS、tPSA、PSAD、ALP、凝血指标(血小板、纤维蛋白原、D-二聚体)差异均具有统计学意义(P<0.05);年龄差异无统计学意义(P>0.05)。见表1。

表1 初诊前列腺癌患者骨转移组与未转移组的临床资料比较 [中位数(四分位数间距)]
2.3 骨转移相关预测因素分析单因素分析结果提示:临床T分期、GS、tPSA、PSAD、ALP、凝血指标(血小板、纤维蛋白原、D-二聚体)均和前列腺癌骨转移有关(P<0.05)。多因素相关分析结果提示:临床T分期、GS、tPSA、ALP、D-二聚体是前列腺癌骨转移的独立相关因素(P<0.05)。见表2。
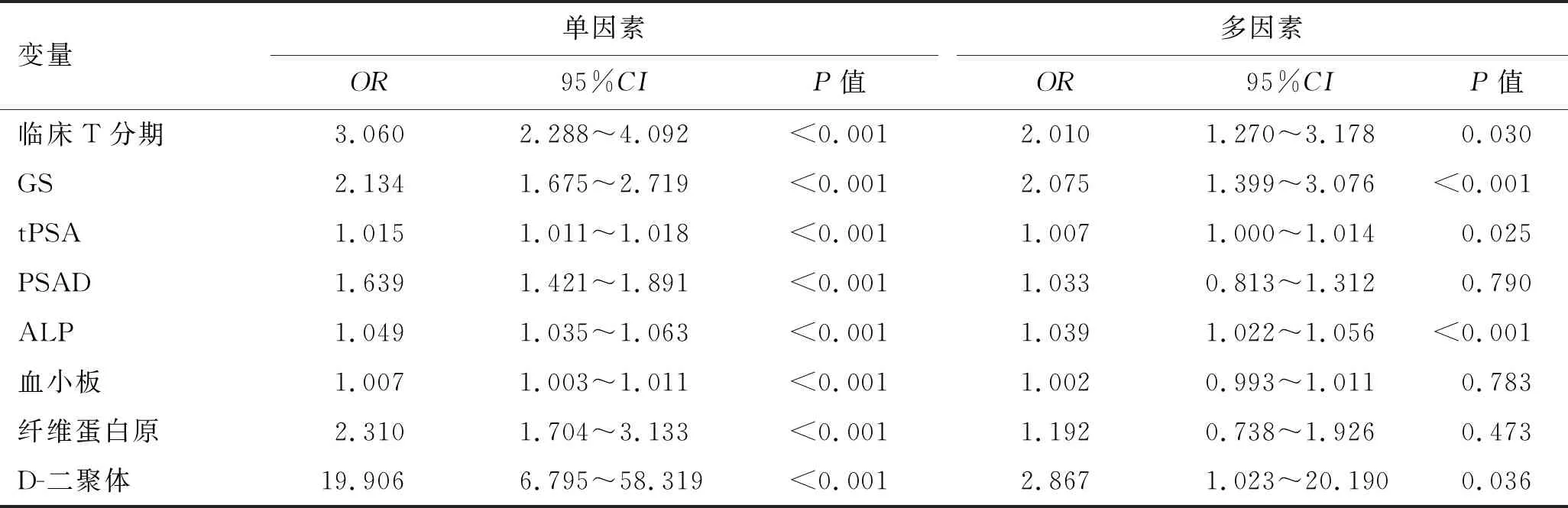
表2 初诊前列腺癌患者骨转移的单因素和多因素分析
2.4 独立预测因素及综合预测模型的ROC曲线联合独立预测因素共同构建综合预测模型,绘制独立预测因素以及综合预测模型的ROC曲线,计算曲线下面积(area under the curve,AUC)(表3、图1)。综合预测模型预测初诊前列腺癌患者骨转移的曲线下面积为0.937(AUC=0.937,95%CI:0.918~0.966),显著优于D-二聚体(0.800)、临床T分期(0.762)、GS(0.694)、tPSA(0.839)、ALP(0.830)的值。
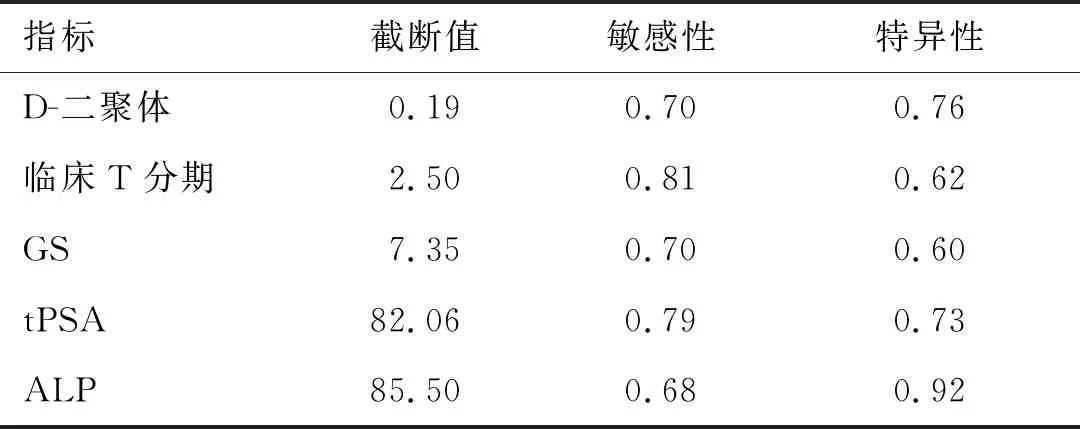
表3 独立预测因素诊断骨转移的ROC曲线分析结果
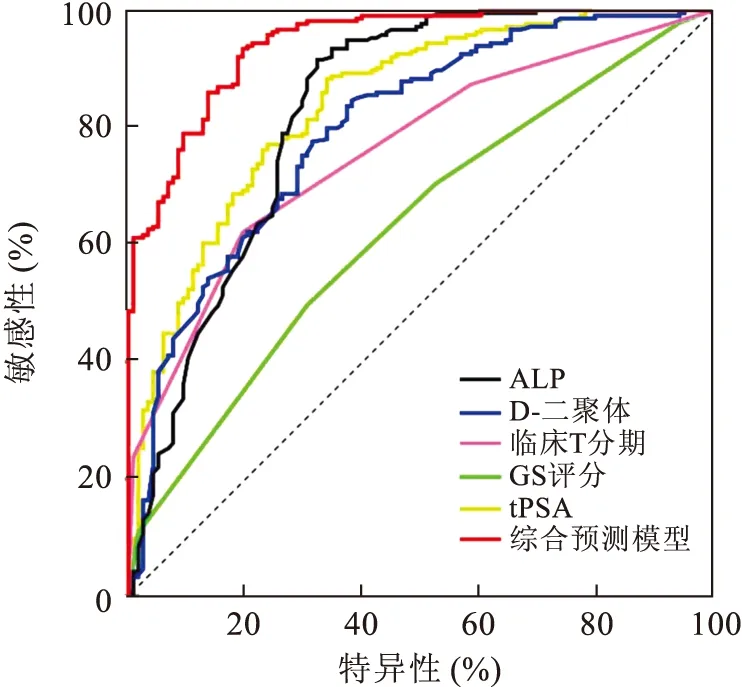
图1 D-二聚体、传统指标与骨转移的ROC曲线
3 讨 论
我国健康体检的观念尚未完全普及,前列腺癌的检出率低于欧美国家,初诊前列腺癌患者的骨转移发生率相对较高。本研究中骨转移率为35.5%,高于国内外的相关研究结果[5-7]。全身骨扫描已被常规用于诊断初诊前列腺癌患者是否发生骨转移,但其特异性较差,且并不是所有初诊前列腺癌患者都具有较高的骨转移风险,常规的骨扫描检查会增加患者不必要的辐射暴露及高额的医疗费用[8]。因此,如何筛查需要骨扫描的患者具有一定的临床价值。
大量研究表明肿瘤的发生往往伴随着凝血系统的激活,且凝血激活与肿瘤血管生成、细胞侵袭、转移扩散有关[9]。本研究中D-二聚体、纤维蛋白原、血小板均与初诊前列腺癌骨转移有关,但只有D-二聚体为其独立预测指标。D-二聚体作为一种常规测量,简单的、可重复性的分子标志物,是比纤维蛋白原更加稳定的交联纤维蛋白降解产物之一。AY等[10]研究发现远处转移的恶性肿瘤患者D-二聚体水平较高,并证实其与肿瘤的不良预后独立相关。本研究中骨转移组的D-二聚体中位值0.33 mg/L(0.140~0.779),显著高于未转移组0.11 mg/L(0.069~0.186),且多因素分析显示D-二聚体是骨转移的独立预测因素(OR=2.867,95%CI:1.023~20.190,P<0.05)。因此,可以认为外周凝血指标与初诊前列腺癌骨转移具有相关性。
本研究中多因素分析显示传统临床指标中只有PSA、ALP、临床T分期、GS是其独立预测因素(P<0.05)。D-二聚体作为初诊前列腺癌骨转移的独立预测指标,其OR(2.867)均大于其余指标。D-二聚体诊断初诊前列腺癌骨转移ROC曲线下面积为0.800,大于临床T分期和GS,且与ALP和tPSA相近。相关数据分析显示D-二聚体大于0.19 mg/L时,更易发生骨转移,其灵敏度和特异度分别为70%、76%。因此,D-二聚体对初诊前列腺癌骨转移具有较高的预测价值。其机制可能为:在肿瘤患者中,凝血系统作为肿瘤微环境的重要组成部分而发生系统性激活,导致纤维蛋白形成增多,纤维蛋白可以促进肿瘤血管生成、增强血小板对肿瘤细胞的粘附,从而促进肿瘤的增殖和侵袭;并在肿瘤细胞上形成保护性纤维蛋白屏障而使肿瘤免受内源性防御机制的影响。而D-二聚体作为纤维蛋白降解产物之一,具有更好的稳定性,对肿瘤有更好的预测作用[10-11]。
本研究存在以下不足,首先本研究属于回顾性研究,在病例的纳入中存在一定选择性偏倚的可能,其次本文并未深入研究D-二聚体对前列腺癌患者骨转移关系的分子作用机制,后续还需要动物实验和临床研究进行深入探究。
综上所述,本研究结果显示D-二聚体与初诊前列腺癌骨转移相关,可与临床T分期、GS、tPSA、ALP等协同评估初诊前列腺癌患者骨转移的可能性:当D-二聚体>0.19 mg/L、临床T分期≥3期、GS>7、tPSA>82.06 ng/mL、ALP>85.5 U/L时,应该高度怀疑骨转移的可能,进一步确诊和治疗。
