MDM2/MDMX-p53双靶点蛋白增效厄洛替尼抗胰腺癌活性的研究*
2021-03-02井佳瑜董丹凤樊杨威吴胤瑛李恩孝董旭媛
井佳瑜,董丹凤,樊杨威,吴胤瑛,李恩孝,董旭媛
710061西安,西安交通大学第一附属医院 肿瘤内科
胰腺癌是一种常见的消化道恶性肿瘤,患者预后极差,被称为“癌症之王”。大多数患者在确诊时已经发展为局部晚期或者已出现远处转移,无法手术治疗。晚期胰腺癌的治疗方案是以姑息性化疗为主的综合治疗,但以吉西他滨为主单药或者联合其他细胞毒性药物的化疗对胰腺癌的有效率很低,且副作用非常大,耐受性差[1-3]。近些年研究者们在胰腺癌靶向治疗领域的探索多以失败告终,仅EGFR抑制剂厄洛替尼取得了阳性的临床研究结果。但其对总生存期(overall survival,OS)的改善仅0.4个月,令厄洛替尼的临床应用备受争议[4-7]。因此,亟需探索增强厄洛替尼疗效的方法,提高患者生存及预后。
野生型p53在抑制肿瘤的形成中起着重要作用,MDM2/MDMX是p53蛋白的重要负调控因子,一些恶性肿瘤中高表达的MDM2/MDMX会降低p53蛋白的水平和功能,从而加速肿瘤的形成和进展。通过抑制MDM2和MDMX或可恢复p53的肿瘤抑制功能,从而发挥抗肿瘤作用。最近有研究报道MDM2抑制剂可通过激活p53诱导DYRK1A降解,降低EGFR的稳定性,从而间接抑制EGFR蛋白表达[8-10]。这些研究提示我们抑制MDM2/MDMX可激活p53,同时下调EGFR表达,有可能与EGFR抑制剂有协同抗肿瘤作用。
课题组在前期研究中已经成功合成了具有透膜性且能靶向阻断MDM2-p53和MDMX-p53相互作用的重组蛋白,即MDM2/MDMX-p53抑制蛋白,并已发现该重组蛋白在乳腺癌中具有很好的抗肿瘤活性[11]。本研究主要使用p53野生型胰腺癌细胞株ASPC-1和p53突变型胰腺癌细胞株PANC-1,分别给予厄洛替尼、MDM2-p53抑制剂、MDM2/MDMX-p53抑制蛋白联合厄洛替尼、MDM2抑制剂联合厄洛替尼等处理。通过MTT、细胞凋亡实验等体外探讨联合MDM2/MDMX-p53抑制蛋白是否可增效厄洛替尼的抗肿瘤活性。进一步构建裸鼠移植瘤模型,探讨MDM2/MDMX-p53抑制蛋白能否在体内促进厄洛替尼的抗胰腺癌活性。并应用Western-blotting等方法对相关机制进行初步探讨,从实验上探寻提高胰腺癌治疗疗效的可行性方法。
1 材料与方法
1.1 材料
两种人胰腺癌细胞株:PANC-1和ASPC-1,前者购于上海吉凯基因化学技术有限公司,后者由西安交通大学医学院转化医学中心提供。MDM2/MDMX-p53蛋白抑制剂的制备参考本课题组前期研究文献[11]。实验裸鼠(24只)为Balb/c、nu/nu雌性裸鼠,4~8周龄,体重18~22 g,SPF级。
1.2 方法
MTT实验:细胞贴壁生长后,分别加入不同浓度梯度的MDM2/MDMX-p53抑制蛋白、MDM2-p53抑制剂(Nutlin-3a)以及Erlotinib,培育48 h;加入MTT溶液20 μL孵育4 h,在酶联免疫仪上选择490 nm波长测定吸光度值,并计算5孔平均值;绘制细胞的生长曲线,了解药物对细胞活性的影响。
Matrigel transwell小室检测细胞的侵袭能力:实验分为6组,处理组1:阴性对照组;处理组2:单用IC50浓度(ASPC-1 细胞3.482 μg/mL;PANC-1细胞4.461 μg/mL)的厄洛替尼组;处理组3:单用IC10浓度(ASPC-1细胞10.08 μg/mL;PANC-1细胞14.072 μg/mL)的MDM2-p53抑制剂Nutlin-3a组;处理组4:单用IC10浓度(ASPC-1细胞5.268 μg/mL;PANC-1细胞6.679 μg/mL)的MDM2/MDMX-p53双靶点抑制蛋白组;处理组5:联合使用IC50浓度的厄洛替尼和IC10浓度的单靶点抑制剂组;处理组6:联合使用IC50浓度的厄洛替尼和IC10浓度的双靶点抑制蛋白组。各组加入相应药物后进行试验,具体操作参考说明书(BD公司)进行。
Annexin V/7-AAD检测细胞凋亡:细胞分组及空白对照同前,处理24 h后参照凋亡试剂盒说明书,流式细胞仪检测凋亡。Western-blotting检测蛋白的表达水平:细胞分组同前,分别给与不同抑制剂处理后48 h候收集蛋白,各单克隆抗体具体情况如下:p53抗体(Abcam),稀释比例1∶1 000;MDM2抗体(Abcam),稀释比例1∶1 000;MDMX抗体(Abcam),稀释比例1∶1 000;EGFR抗体(CST),稀释比例1∶1 000;HRP标记GAPDH(Proteintech),稀释比例1∶5 000。HRP标记兔二抗(CST),稀释比例1∶10 000。操作步骤同其他Western-blotting试验步骤。
体内实验:ASPC-1细胞悬液皮下接种于24只裸鼠的右后肢。实验裸鼠随机分为4组,每组6只,每组均接受不同药物干预,第一组:等体积PBS口服;第二组:MDM2/MDMX-p53抑制蛋白20mg/kg/d,瘤内注射;第三组:厄洛替尼50 mg/kg/d,灌胃;第四组:厄洛替尼50 mg/kg/d,灌胃+MDM2/MDMX-p53抑制蛋白20 mg/kg/d,瘤内注射。观察肿瘤的生长情况,每2 d测量肿瘤大小和裸鼠体重变化,以肿瘤体积为纵坐标、时间为横坐标绘制肿瘤生长曲线,计算抑瘤率:抑瘤率(%)=(阴性对照组瘤重-干预组瘤重)/阴性对照组瘤重×100%。
1.3 统计分析
所有实验结果用SPSS 18.0统计软件进行统计学分析,计量资料均采用均数±标准差表示。多组间差异的比较采用单因素方差分析。所有统计分析均为双侧概率检验,P<0.05为差异有统计学意义。
2 结 果
2.1 厄洛替尼联合双靶点抑制蛋白可更有效地抑制胰腺癌细胞的增殖活性
不同浓度梯度的MDM2/MDMX-p53抑制蛋白、MDM2-p53抑制剂(Nutlin-3a)和厄洛替尼作用于ASPC-1细胞或PANC1细胞48 h,绘制细胞生长抑制曲线,计算其IC50、IC10值。结果显示:MDM2/MDMX-p53双靶点抑制蛋白抑制ASPC1细胞和PANC1细胞增殖活性的能力强于MDM2-p53抑制剂(图1A、C)。其中双靶点抑制蛋白、Nutlin-3a分别处理ASPC-1细胞后的IC10为5.27 μg/mL和10.08 μg/mL;而在PANC-1细胞中,双靶点抑制蛋白、Nutlin-3a分别处理细胞后的IC10为6.68 μg/mL和14.07 μg/mL。为了说明双靶点抑制蛋白以及单靶点抑制剂可促进厄洛替尼的抗胰腺癌作用,而非其自身抗胰腺癌的活性,我们选取低浓度(IC10)作为联合用药的浓度。结果显示:厄洛替尼联合双靶点抑制蛋白比联合单靶点抑制剂能更显著地抑制ASPC1细胞和PANC1细胞的增殖活性(图1B、D)。
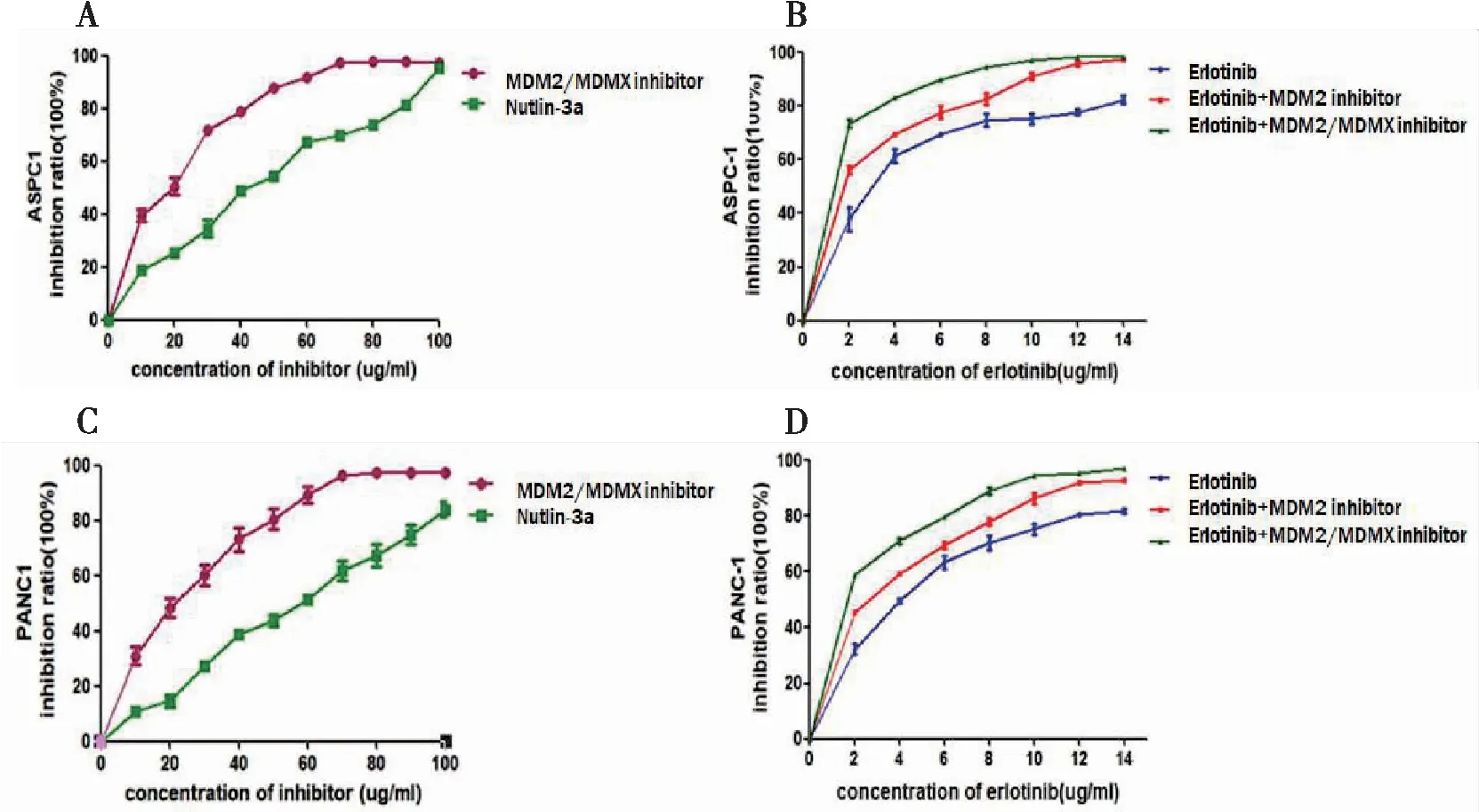
图1 厄洛替尼联合双靶点抑制蛋白可显著抑制胰腺癌细胞增殖活性
2.2 厄洛替尼联合双靶点抑制蛋白抑制胰腺癌细胞的侵袭能力
实验分组同试验方法中分组,分别加相应药物干预处于对数生长期的ASPC-1胰腺癌细胞株48 h。用Matrigel transwell小室实验检测细胞的侵袭能力。在ASPC-1细胞株中(图2A、B),不同干预措施能降低ASPC-1细胞的侵袭能力,各处理组平均穿膜细胞数依次为:(91.50±2.65)个、(43.75±1.71)个、(41.5±1.29)个、(39.75±1.71)个、(28.50±1.29)个、(19.25±0.96)个,厄洛替尼联合MDM2/MDMX-p53抑制蛋白干预后穿膜细胞数显著减少,差异具有统计学意义。(F=339.858,P<0.01)。在PANC-1细胞株中(图2C、D),结果显示:各处理组平均穿膜细胞数为:(71.25±2.63)个、(42.25±2.22)个、(43.25±1.71)个、(37.75±2.06)个、(32.00±1.83)个、(16.75±1.50)个,厄洛替尼联合MDM2/MDMX-p53抑制蛋白干预后穿膜细胞数减少,差异具有统计学意义(F=337.089,P<0.01)。
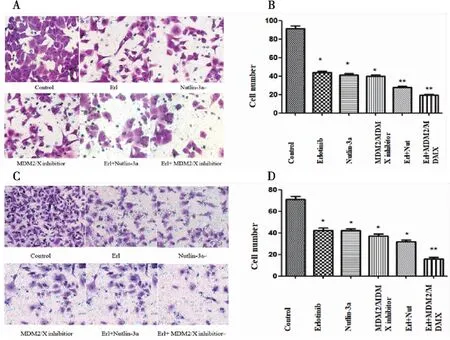
图2 厄洛替尼联合双靶点抑制蛋白抑制胰腺癌细胞的侵袭能力
2.3 厄洛替尼联合双靶点抑制蛋白促进胰腺癌细胞的凋亡
参照试验方法中的实验分组分别干预处于对数生长期的ASPC-1细胞株48 h,流式细胞仪分析细胞凋亡情况。结果显示(图3A):阴性对照组早期凋亡细胞比例为零,各处理组早期凋亡细胞比例依次为9.53%±1.54%、5.46%±1.64%、2.91%±2.05%、1.83%±0.48%、1.37%±0.53%;各处理组干预后ASPC-1细胞早期凋亡比例增加,与对照组相比,这种差异具有统计学意义(F=234.198,P<0.05)。对比其他组,厄洛替尼联合MDM2/MDMX-p53抑制蛋白诱导ASPC-1细胞凋亡的比例更高(P<0.05)。
PANC-1细胞处理48 h后流式细胞仪分析凋亡情况。结果显示(图3B):阴性对照组无早期凋亡细胞,各处理组早期凋亡细胞比例依次为7.67%±1.42%、4.98%±2.01%、2.62%±1.03%、1.65%±0.55%、1.27%±0.34%;各处理组干预后PANC-1细胞早期凋亡比例增加,与对照组相比,这种差异具有统计学意义(F=318.710,P<0.05)。对比其他组,厄洛替尼联合MDM2/MDMX-p53抑制蛋白诱导PANC-1细胞凋亡的比例更高(P<0.05)。
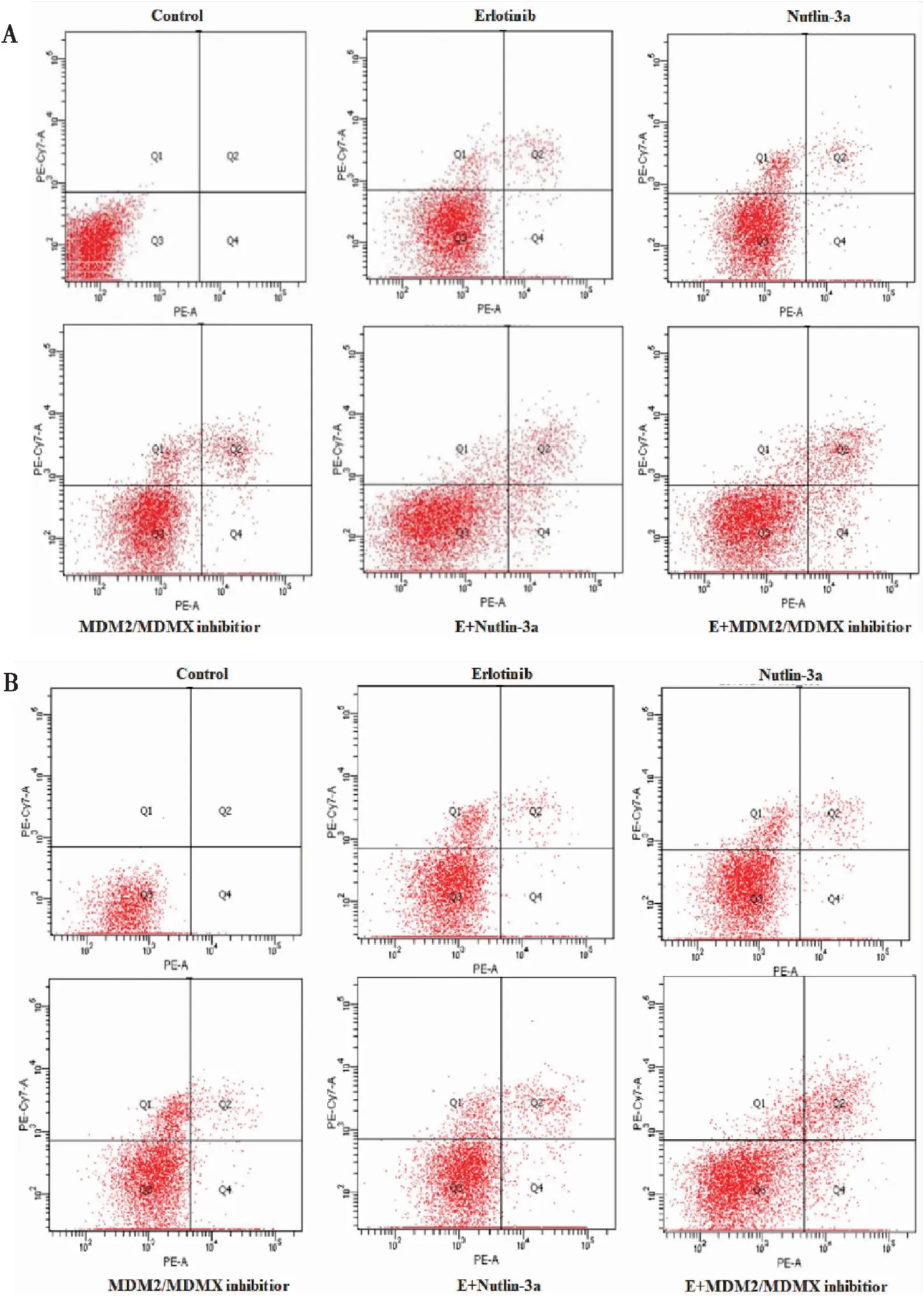
图3 厄洛替尼联合双靶点抑制蛋白促进胰腺癌细胞的凋亡
2.4 厄洛替尼联合MDM2/MDMX-p53双靶点抑制蛋白体外抗肿瘤作用机制研究
用Western-blotting方法检测经过处理后胰腺癌细胞中相关蛋白的表达情况。ASPC-1细胞分别加入DMSO(control)、Erl(厄洛替尼 3.48 μg/mL)、MDM2/MDMX inhibitor(5.27 μg/mL)、Com(厄洛替尼联合MDM2-p53抑制蛋白组),处理48 h后收集细胞蛋白,Western blotting方法检测p53蛋白、MDM2、MDMX、EGFR蛋白的表达水平。PANC-1细胞分别加入DMSO(control)、Erl(厄洛替尼 4.46 μg/mL)、MDM2/MDMX inhibitor(6.68 μg/mL)、Com(厄洛替尼联合MDM2-p53抑制蛋白组),处理48 h后收集细胞蛋白,Western blotting方法检测P53蛋白、MDM2、MDMX、EGFR蛋白的表达水平。结果显示厄洛替尼联合MDM2/MDMX-p53双靶点抑制蛋白在两种胰腺癌细胞中均可下调MDM2/MDMX表达,上调p53表达,下调EGFR表达,在ASPC1细胞中更为显著(图4)。
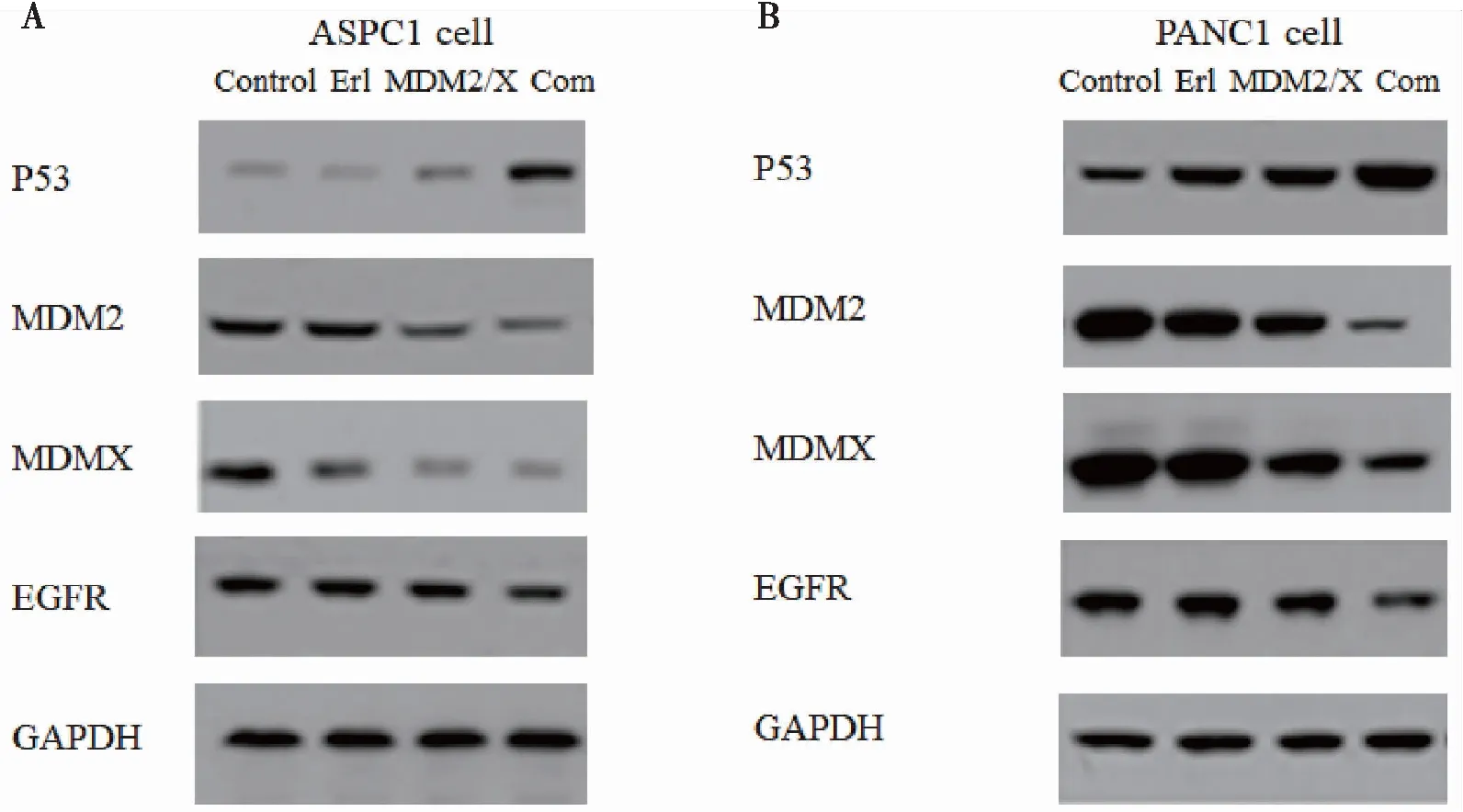
图4 厄洛替尼联合MDM2/MDMX-p53双靶点抑制蛋白体外抗肿瘤机制
2.5 厄洛替尼联合双靶点抑制剂抑制胰腺癌裸鼠移植瘤的生长
按照实验分组对成瘤裸鼠进行干预处理,21 d后各处理组荷瘤小鼠如图所示(图5A)。各组干预下裸鼠移植瘤的抑瘤率分别为22.47%、28.41%,55.39%。厄洛替尼联合MDM2/MDMX-p53抑制蛋白能显著抑制裸鼠移植瘤的生长,差异具有统计学意义(P<0.01)(图5B)。裸鼠移植瘤的生长曲线显示,厄洛替尼联合MDM2/MDMX-p53抑制蛋白组干预后肿瘤体积缩小;各干预组裸鼠体重无明显差异(图5C),说明厄洛替尼联合MDM2/MDMX抑制蛋白可安全、显著地抑制裸鼠移植瘤的生长。
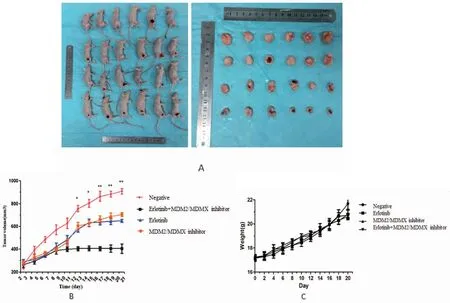
图5 双靶点抑制蛋白联合厄洛替尼的体内抗肿瘤活性
3 讨 论
恶性肿瘤的治疗已经逐渐从“细胞毒药物为主导的化疗”时代向“靶向药物精准治疗”时代转变。作为“癌症之王”的胰腺癌,其肿瘤细胞与其他恶性肿瘤有一些共同的增殖、侵袭和转移机制,也伴有抑癌基因p53、ATM的失活或原癌基因如CTNNB1、MDM2的异常激活和过表达[8-10],但又有其独特性和复杂性。多年来在胰腺癌内科治疗领域,尤其是靶向治疗领域,一直没有取得飞跃性的突破[9-10]。2013年一项III期临床试验证实,在49%的胰腺癌患者肿瘤组织中存在EGFR过表达[10]。随后更多研究表明,EGFR的过表达对胰腺癌的发生、发展十分重要,并且影响胰腺癌患者的预后[9-11]。厄洛替尼可选择性地抑制细胞内的EGFR,阻止其激活和下游信号转导。然而,胰腺癌患者对厄洛替尼的临床反应较差,仅小部分患者可能受益,使得其应用备受争议。
MDM2/MDMX是p53的负调控因子,能抑制p53的活性,使用MDM2/MDMX抑制剂能降低MDM2/MDMX的表达水平,减少p53的降解,恢复p53的转录活性。并且,MDM2抑制剂能间接负调控EGFR蛋白水平,降低EGFR蛋白的表达水平[5]。因此,MDM2/MDMX-p53抑制蛋白联合厄洛替尼可能起到协同抗胰腺癌的作用。
我们前期设计和构建了靶向抑制MDM2/MDMX-p53的原核表达载体,可表达高纯度、具有透膜性的MDM2/MDMX-p53抑制蛋白[11]。体外研究结果显示,厄洛替尼联合MDM2/MDMX-p53抑制蛋白有抗胰腺癌活性,能抑制p53野生型和p53突变型胰腺癌细胞的增殖、侵袭能力,并且能诱导胰腺癌细胞的凋亡,对比单用厄洛替尼、单用抑制剂、厄洛替尼联合MDM2-p53抑制剂,厄洛替尼联合MDM2/MDMX-p53抑制蛋白的抑制作用更强。Western-blotting方法检测p53、MDM2、MDMX、EGFR蛋白的表达情况时,p53野生型和p53突变型胰腺癌细胞中蛋白表达情况不一样,反映了作用机制可能并不相同。p53野生型胰腺癌细胞中p53蛋白表达水平上调,MDM2、MDMX、EGFR蛋白表达水平下调,对比单用厄洛替尼组,联合使用双靶点抑制蛋白组EGFR表达水平降低更多。这可能是由于MDM2/MDMX-p53抑制蛋白有效结合了MDM2、MDMX,降低其表达水平并且阻止其与p53结合,减少p53降解,而p53能负调控DYRK1A,促进EGFR降解,从而间接降低了EGFR的表达水平。DYRK1A在肿瘤中高度表达,与肿瘤的发生密切相关[12],它是一种双特异性的酪氨酸磷酸化调节激酶,通过磷酸化EGFR信号调节因子而阻止EGFR的降解[13];同时,EGFR蛋白表达水平下调会通过PI3K/AKT通路促进MDM2蛋白降解,并抑制MDM2蛋白的泛素促进功能,最终导致p53恢复抑癌活性,表达水平上调。在非小细胞肺癌、肝细胞肝癌中,阻断PI3K/AKT/MDM2通路可抑制肿瘤发生、发展[14-15]。结合既往报道,MDM2/MDMX-p53抑制蛋白与厄洛替尼协同抗肿瘤的具体机制还需要进一步研究来证实。此外,p53突变型胰腺癌细胞中,厄洛替尼联合MDM2/MDMX-p53抑制蛋白处理后,MDM2和MDMX表达水平减低,细胞增殖抑制、侵袭能力降低,但p53和EGFR蛋白的表达水平无明显变化,提示可能MDM2/MDMX具有不依赖于p53的独立致癌作用,具体机制有待进一步研究揭示。
本研究进一步探讨了双靶点抑制蛋白联合厄洛替尼的体内抗肿瘤活性,结果显示,对比单用厄洛替尼、双靶点抑制蛋白,厄洛替尼联合双靶点抑制蛋白对胰腺癌裸鼠皮下移植瘤的抑制作用更强。说明联合治疗在体内也能发挥协同抗肿瘤活性,且毒副作用可控。然而,尽管体内外研究充分肯定了厄洛替尼联合MDM2/MDMX-p53抑制蛋白在胰腺癌中抗肿瘤活性以及安全性,但将其应用于临床还需要大量的临床前研究和临床试验来证实。
综上所述,基于本研究的体外、体内实验结果,我们有理由相信在未来的胰腺癌治疗中,这种协同抗癌治疗效果会表现出明显的优势。而如何筛选出优势人群、如何选择合适的患者都将是未来可能面临的问题。进一步深入并在机制方面研究厄洛替尼联合MDM2/MDMX-p53抑制蛋白的抗胰腺癌作用,可为我们提供更多的实验依据。另外,胰腺癌的异质性较大,单一遗传背景的细胞系可能无法很好地代表胰腺癌本身的生物学活性,后续研究中通过构建PDX模型,有望更好地模拟胰腺癌的特点,并进一步探讨联合治疗的可行性和有效性。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
