淋巴瘤自体造血干细胞移植后合并植入综合征1例*
2021-03-02李旭绵郭智陈晓刘玄勇张弋慧智陈丽娜
李旭绵,郭智,陈晓,刘玄勇,张弋慧智,陈丽娜
518116广东 深圳,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院 血液肿瘤科
植入综合征(engraftment syndrome,ES) 又称毛细血管渗漏综合征,发生于造血干细胞移植后中性粒细胞恢复过程中,以发热、皮疹和非心源性肺水肿为主要表现的临床综合征[1]。ES一般多发生在异基因造血干细胞移植过程中,在淋巴瘤自体造血干细胞移植中极罕见发生,现报告我科1例ES病例。
1 临床资料
患者男,49岁,因确诊非霍奇金淋巴瘤6月余(弥漫大B细胞型 non-GCB亚型 IV期B组 IPI评分3分),经R-CHOP方案化疗6个疗程,4疗程PET-CT评估达到完全缓解,拟行自体造血干细胞移植于2019年9月入院。移植前患者一般情况好,查体无明显阳性体征,血常规、肝肾心功能、心电图、心脏彩超、EBV DNA、CMV DNA、G试验、GM试验、骨髓细胞形态学及免疫残留等检查均正常。移植预处理方案为:白消安3.2 mg/kg,d-9、-8、-7、-6,环磷酰胺1.8 g/m2d-5、-4、-3,移植0d回输冻存的自体外周血造血干细胞(单个核细胞15.75×109/kg,CD34+8.76×106/kg),回输后常规使用阿昔洛韦预防病毒感染、复方磺胺甲噁唑预防耶氏肺孢子菌感染,+1 d血常规:白细胞(white blood cell,WBC) 1.25×109/L,血红蛋白(hemoglobin,HGB) 78 g/L,血小板(platelet,PLT) 55×109/L,予粒细胞集落刺激因子、促血小板生成素升白升板,+3 d血常规:WBC 0.03×109/L,中性粒细胞(neutrophil,N) 0.01×109/L,HGB 76 g/L,PLT 15×109/L,患者出现发热伴畏寒、尿频、尿痛,体温39℃,予舒普深及依替米星抗感染,+4 d患者反复发热并出现感染性休克,血压下降至80/40 mmHg,予多巴胺持续泵入维持血压,尿培养为多耐大肠埃希菌,抗感染治疗方案调整为亚胺培南+替加环素+伏立康唑+米卡芬净,患者发热控制,尿频、尿痛好转,逐渐减停多巴胺后血压可维持稳定。患者+8d出现散在皮疹,以躯干为主,呈暗红色,略高于皮肤表面,无瘙痒,血常规:WBC 0.42×109/L,N 0.3×109/L,HGB 79g/L,PLT 27×109/L,+9 d血常规:WBC 4.83×109/L,N 3.53×109/L,HGB 90 g/L,PLT 39×109/L,粒系达到植入并停用粒细胞集落刺激因子,但患者皮疹加重扩散至全身,累及颜面部、躯干及四肢,部分融合成片,皮疹面积超过25%体表面积(图1A、B),并再次出现发热,体温最高38.8℃,伴腹泻黄色稀烂便,无胸闷、气促,双下肢凹陷性水肿(图1C),患者体重增加5 kg(原体重78 kg),行胸部CT示双侧胸腔新发少至中等量积液、心包极少量积液、双肺下叶受压膨胀不全、未见明确感染灶。复查谷丙转氨酶3.9U/L,谷草转氨酶33.5U/L,总胆红素10.9 μmol/L,肌酐71 μmol/L,考虑为ES,予地塞米松5 mg/d治疗5 d后患者发热、腹泻症状及逐渐缓解,皮疹消退,+13 d血常规:WBC 25.76×109/L,N 19.45×109/L,HGB 87 g/L,PLT 53×109/L,复查中性粒细胞水平逐渐下降,整个病程中患者神志清楚、对答切题,查体无神经系统阳性体征。移植后1月复查胸部CT示胸腔积液完全吸收,血常规:WBC 10.2×109/L,N 4.9×109/L,HGB 110 g/L,PLT 211×109/L,随访至今,肿瘤疗效评价完全缓解,患者未再出现发热、腹泻、皮疹、水肿等不适症状。
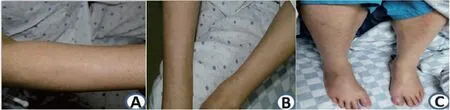
图1 患者双上肢皮疹及双下肢水肿情况
2 讨 论
本例患者在自体造血干细胞移植后粒系植入早期出现发热、腹泻、胸腔及心包积液、双下肢水肿、躯干散在红斑性皮疹,随着外周血中性粒细胞逐渐升高,皮疹逐渐加重并蔓延至全身,排除了肺部感染,短期应用地塞米松后皮疹、发热、腹泻等症状很快消失,同时伴随中性粒细胞逐渐下降,因此考虑为ES。ES主要诊断标准为:①体温≥38.3℃无感染证据;②非药物性红斑性皮疹超过25%体表面积;③非心源性肺水肿,表现为弥漫性肺浸润和低氧血症。次要诊断标准为:①肝功能异常:总胆红素或转氨酶水平≥正常值2倍;②肾功能不全:肌酐≥正常值2倍;③体重增加≥原体重2.5%;④不能用其他原因解释的一过性颅脑病变。确诊ES需要3条主要标准或2条主要标准加1条及以上次要标准。该患者符合主要诊断标准①和②,次要诊断标准③,ES诊断成立。ES是造血干细胞移植后伴随造血恢复出现的一组临床综合征,通常发生于中性粒细胞植入早期,尤其是中性粒细胞植入后96 h内,是一类造血干细胞移植后非感染性并发症,主要表现为发热、皮疹、水钠潴留、非心源性肺水肿,严重者可发生多器官功能衰竭[1]。发热是最早出现的症状,一般发热后1~2 d内出现皮疹,多为全身或局部红斑或斑丘疹、色暗红、略高出皮肤,严重者可出现水疱、表皮剥脱、松解等[2]。异基因造血干细胞移植后ES发生率约20%左右,但自体造血干细胞移植较少发生。
ES的发病机制尚未完全明确,目前普遍认为与高细胞因子血症和血管内皮细胞损伤有关,即“二次打击”学说:第一次打击为大剂量放化疗预处理后骨髓空巢期,肿瘤坏死因子-α、干扰素-γ、白介素-1等炎性细胞因子大量产生并释放、补体激活以及与单核细胞、T淋巴细胞相互作用,为最重要的环节。预处理强度越大,组织损伤越严重,引起的细胞因子释放越多;第二次打击为预处理后中性粒细胞恢复期,此时出现血管内皮损伤,大量中性粒细胞胞浆脱颗粒、释放氧化代谢产物,进一步产生和释放炎性细胞因子,与上述反应累积作用,最终导致局部或系统性组织和器官损伤,由此可见中性粒细胞是促成ES临床表现的主要效应细胞[3-4]。既往研究认为ES发病相关的危险因素包括原发病类型、移植方式、造血干细胞来源、预处理的药物种类及剂量、输入的MNC或CD34+细胞的数量、细胞因子的使用、中性粒细胞恢复速度等[5]。ES发生与造血干细胞移植的类型密切相关,异基因移植较自体移植、无关供体移植较亲缘供体移植、外周血移植较骨髓移植的ES发生率高[6-7],移植后常规使用粒细胞集落采集因子可促进中性粒细胞的分化与释放,从而促进ES发生。ES多数是自限性的,但少部分可危及生命。目前其治疗尚无统一标准,短暂低热及局限皮疹属轻度ES,在造血重建及停用细胞因子后可自行恢复,故无需处理;若病情进展,尤其累及肺需要积极处理,糖皮质激素疗效确切,早期使用可显著改善预后[8],还要注意限制血容量、降低毛细血管通透性、预防性抗感染等对症支持治疗。ES患者虽然有水肿表现,但由于毛细血管通透性增加,血管内的容积减少.使用利尿剂需要谨慎,尤其在异基因造血干细胞移植患者中,血管内容积进一步缩小可能会增加环孢素A和其他免疫抑制剂的神经毒性。关于ES对患者预后的影响,目前结论不一,有研究表明发生ES患者总体死亡率和早期无复发死亡率较高,提示预后不良,而另一部分研究结果则认为ES并不影响患者的总生存率、无病生存率和累积生存率,但可使复发率明显下降,也有研究发现ES与复发率并无相关性[9-10]。
本例患者在自体造血干细胞回输后+3 d出现发热,合并感染性休克,经过积极抗感染治疗后体温恢复正常,在持续抗感染治疗过程中,于粒细胞植入早期再次出现发热,体温38.8℃,伴皮疹、腹泻、胸腔及心包积液、双下肢浮肿,血培养未发现细菌和真菌生长,停用所有抗生素及可能致敏药物后上述症状仍持续,且随中性粒细胞计数的上升而皮疹进行性加重,予地塞米松5 mg/d治疗5 d后复查中性粒细胞计数逐渐下降,皮疹亦随着逐渐消退、腹泻停止、浮肿及发热好转,复查胸腔及心包积液已完全吸收。综合考虑,该患者临床表现符合ES,其病程中不具备典型ES的所有表现,肝肾功能始终正常、无一过性颅脑病变、无低氧血症,考虑与我们早期应用激素及时阻止疾病进一步进展至多器官功能衰竭有关。回顾本病例,该患者存在造血干细胞来源于外周血、移植前预处理使用白消安和烷化剂、预处理强度较大、输入单个核细胞和CD34+细胞数量较高、移植后使用G-CSF、中性粒细胞较快恢复等多个ES发生的高危因素,最终导致ES的发生。该患者由于及时采取治疗措施,最终疗效满意、预后良好。在实际临床工作中,ES临床表现多种多样,不具备特征性临床症状,临床医生应提高对本病的认识,早期诊断及时治疗,避免进展至呼吸衰竭等严重并发症,从而改善患者的预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
