炎性细胞因子在儿童肺炎支原体肺炎中的表达及其在免疫学发病机制中的作用
2021-03-02贺静鲁利群汪燕黄莉邓国清
贺静 鲁利群 汪燕 黄莉 邓国清
成都医学院第一附属医院儿科610000
肺炎支原体肺炎 (Mycoplasma pneumoniae pneumonia,MPP)是肺炎支原体 (Mycoplasma pneumoniae,MP)感染性疾病[1],患儿临床表现为剧烈的顽固性咳嗽,引起多种肺外并发症。近年来调查显示,MPP 的流行病学特点有了一定的变化,主要表现为发病年龄提前,5 岁以下儿童为MPP的高发人群。最初MP 感染患儿大多病情较轻,对患儿的危害不大,且病情呈自限性[2]。但近年来MPP患儿症状有加重趋势,难治性MPP、重症MPP 患儿的构成比例逐年增多[3]。重症MPP患儿病情较重,且常伴有心、肝、肾、中枢神经系统等多个脏器功能损害;难治性MPP患儿对药物治疗不敏感,治疗效果差,病情迁延不愈,甚至危及生命或治愈后遗留一些后遗症[4]。因此,了解MPP的发病机制,准确及时评价病情严重程度,给予正确的治疗对患儿的健康十分重要。但目前MPP的发病机制仍未阐明,其中免疫学机制与MPP的发生密切相关,多种炎性细胞因子在MPP的发生与进展中起着重要作用[4-5]。本研究检测了81例不同时期、不同严重程度MPP患儿炎性细胞因子水平,并与对照组进行比较,初步探讨其在免疫学发病机制中的作用,现报道如下。
1 对象与方法
1.1 研究对象 采用前瞻性研究方法,选取2016年1月至2019年3月在成都医学院第一附属医院住院并确诊为MPP 的患儿81 例作为研究对象,男35例,女46例,年龄范围为3~7岁,平均年龄(4.8±1.2)岁,均检测血清MP-Ig M,符合《实用儿科学(第7版)》MPP诊断标准。急性期根据病情严重程度分为2组:重症组37例,肺部有明显实变体征,胸部X 线大叶性肺炎改变超过2个肺叶,且患者伴有肺不张,或肺外并发症,或胸腔积液;轻症组44例,肺部体征轻。选取同期健康体检儿童30名作为对照组,男13名,女17名,年龄范围为3~7岁,平均年龄(4.6±0.9)岁。2组儿童年龄、性别构成差异无统计学意义 (P >0.05)。本研究经本院医学伦理委员会批准,所有患儿家属知情同意并签署知情同意书。
1.2 方法
1.2.1 检测试剂 IL-2、IL-8、IL-10试剂盒购自武汉伊莱瑞特生物科技有限公司,Ig A、IgG、Ig M 购自四川迈克生物科技股份有限公司。
1.2.2 标本采集 MPP患儿分别于急性期 (发病3~5 d,未经抗生素、免疫调节剂等治疗前)、恢复期(发病8~15 d,经治疗后症状、体征明显减轻)抽取空腹静脉血2 ml,健康体检儿童于体检当日抽取空腹静脉血2 ml送检。
1.2.3 检测方法 分离血清,采用酶联免疫吸附试验检测IL-2、IL-8、IL-10,采用免疫透射比浊法检测Ig A、IgG、Ig M。
1.3 观察指标 比较对照组与MPP 患儿不同时期炎性细胞因子IL-2、IL-8、IL-10 水平和Ig A、IgG、Ig M 水平。比较重症与轻症MPP 患儿急性期炎性细胞因子IL-2、IL-8、IL-10 水平和Ig A、IgG、Ig M 水平。根据是否使用糖皮质激素治疗分组,比较2组患儿免疫球蛋白Ig A、IgG、Ig M 水平变化。
1.4 统计学分析 采用SPSS 18.0软件进行统计学分析。计量资料以±s 表示,多组间比较采用单因素方差分析,两组间均数的比较采用t 检验。P <0.05为差异有统计学意义。
2 结果
2.1 MPP患儿不同时期炎性细胞因子及免疫球蛋白水平比较 MPP 患儿急性期、恢复期和对照组血清IL-2、IL-8、IL-10水平差异均有统计学意义(F 值分别为19.242、17.872、4.173,P 值均<0.05)。MPP患儿急性期、恢复期IL-2、IL-10水平明显低于对照组,IL-8 水平明显高于对照组;MPP患儿急性期IL-2、IL-10 水平明显低于恢复期,IL-8水平明显高于恢复期,差异均有统计学意义(P 值均<0.05)。MPP 患儿急性期、恢复期和对照组血清Ig A、IgG、Ig M 水平差异均有统计学意义 (F 值分别为10.472、13.870、9.702,P 值均<0.05)。MPP 患儿急性期、恢复期Ig A、IgG、Ig M 水平明显高于对照组,MPP 患儿急性期Ig A、IgG、Ig M 水平明显高于恢复期,差异均有统计学意义(P 值均<0.05)。见表1、2。
表1 对照组与MPP患儿急性期、恢复期炎性细胞因子水平比较 (pg/L,±s)

表1 对照组与MPP患儿急性期、恢复期炎性细胞因子水平比较 (pg/L,±s)
注:MPP为肺炎支原体肺炎;与对照组比较,a P <0.05;与恢复期比较,b P <0.05
组别标本量IL-2 IL-8 IL-10对照组30 159.24±20.82 25.03±5.29 25.83±4.38急性期MPP组81 82.05±14.73ab 113.76±13.92ab 14.76±2.28ab恢复期MPP组81 121.48±18.79a 74.85±9.72a 18.92±3.54a F 值19.242 17.872 4.173 P 值<0.001<0.001 0.022
表2 对照组与MPP患儿急性期、恢复期免疫球蛋白水平比较 (g/L,±s)

表2 对照组与MPP患儿急性期、恢复期免疫球蛋白水平比较 (g/L,±s)
注:MPP为肺炎支原体肺炎;与对照组比较,a P <0.05;与恢复期比较,b P <0.05
组别标本量Ig A IgG Ig M对照组30 1.09±0.18 5.17±1.18 1.01±0.08急性期MPP组81 1.77±0.24ab 9.82±1.76ab 1.92±0.23ab恢复期MPP组81 1.51±0.22a 7.03±1.67a 1.65±0.17a F 值10.472 13.870 9.702 P 值<0.001<0.001<0.001
2.2 不同严重程度MPP 患儿细胞因子及免疫球蛋白水平比较 重症组患儿IL-2、IL-10水平明显低于轻症组 (t 值分别为-22.86、-14.29,P 值均<0.05),IL-8 水平明显高于轻症组 (t =31.47,P <0.05)。重症组患儿Ig A、IgG、Ig M水平明显高于轻症组 (t 值分别为-15.27、13.82、9.76,P 值均<0.05)。见表3、4。
表3 重症和轻症肺炎支原体肺炎患儿炎性细胞因子水平比较 (pg/L,±s)

表3 重症和轻症肺炎支原体肺炎患儿炎性细胞因子水平比较 (pg/L,±s)
组别例数IL-2 IL-8 IL-10轻症组44 129.64±19.08 62.91±9.25 28.81±3.94重症组37 70.59±15.63 121.63±14.28 11.27±2.08 t值-22.86 31.47-14.29 P 值<0.001<0.001<0.001
表4 重症和轻症肺炎支原体肺炎患儿免疫球蛋白水平比较 (g/L,±s)
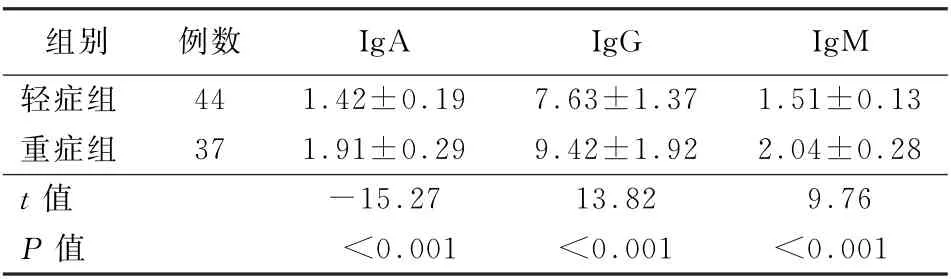
表4 重症和轻症肺炎支原体肺炎患儿免疫球蛋白水平比较 (g/L,±s)
组别例数Ig A IgG Ig M轻症组44 1.42±0.19 7.63±1.37 1.51±0.13重症组37 1.91±0.29 9.42±1.92 2.04±0.28 t值-15.27 13.82 9.76 P 值<0.001<0.001<0.001
2.3 是否使用糖皮质激素治疗患儿恢复期免疫球蛋白水平比较 激素治疗组、非激素治疗组患儿恢复期Ig A、IgG、Ig M 水平差异无统计学意义(表5)。
表5 是否使用糖皮质激素治疗患儿恢复期免疫球蛋白水平比较 (g/L,±s)

表5 是否使用糖皮质激素治疗患儿恢复期免疫球蛋白水平比较 (g/L,±s)
组别例数Ig A IgG Ig M激素治疗组40 1.49±0.25 6.98±1.48 1.61±0.15非激素治疗组41 1.53±0.18 7.07±1.96 1.69±0.20 t值0.283 0.341 0.367 P 值0.819 0.753 0.738
3 讨论
MP是目前已知的广泛存在于自然界中最小的病原微生物,直径为125~150 nm,能通过细胞滤器,介于病毒与细菌之间,病原体大小与黏液病毒相仿,无细胞壁,仅有分内、中、外三层细胞膜的超微结构,形态呈杆状、球状、丝状等。目前认为MP感染的机制主要为以下三方面:一是免疫学发病机制,二是呼吸道上皮的吸附作用,三是MP直接侵入。MP不仅是呼吸道致病菌,还可感染许多肺外组织[6-8]。儿童感染MP 后受自身免疫功能的影响,部分患者病情较轻,有自限性;而部分患儿会进展为重症MPP。分析原因可能有以下几个方面:首先,MP感染时,机体发生过度的体液免疫致机体免疫损伤,细胞免疫功能紊乱,自然杀伤细胞、巨噬细胞及中性粒细胞的吞噬功能受到抑制,对病原体的清除作用大大降低,致患者的临床症状逐渐加重而进展为重症MPP[9-10];其次,MP可通过抗原突变侵入细胞内,逃避机体免疫细胞的吞噬而使病情进展[11];第三,MPP可导致自身抗体产生、高细胞因子血症及特异性免疫球蛋白产生异常等,加重临床症状及肺损伤,并发生重症MPP[12]。由此可见,MP 感染不会直接导致重症MPP,而各种细胞因子导致的炎症免疫损伤才是重症MPP发生的重要原因。
目前国内外相继有文献报道了各种细胞因子在MPP的发病机制中的作用,但究竟何种细胞因子在免疫级联反应中起主导作用尚不明确,而炎性细胞因子在病情进展中所起的作用的研究较少。
IL-8是呼吸系统主要的白细胞趋化因子之一,对嗜碱粒细胞、T 淋巴细胞、中性粒细胞均有较强的趋化作用。Tumgor等[13]研究显示,社区获得性肺炎患儿IL-8水平明显升高,认为IL-8在肺部炎症反应中有重要作用。本研究结果显示,MPP患儿急性期、恢复期血清IL-8水平明显高于对照组,急性期患儿IL-8 水平明显高于恢复期,与Tumgor等[13]结果基本相符,说明IL-8 参与了MPP的病理生理过程。且重症组患儿IL-8水平明显高于轻症组,提示IL-8与MPP患儿肺及肺外损伤程度有关。
IL-2是T 细胞生长因子,作用是维持和促进T 细胞的长期存活。本研究结果显示,急性期、恢复期患儿的血清IL-2水平低于对照组,且急性期IL-2水平明显低于恢复期,重症组患儿IL-2水平明显低于轻症组。原因可能是患儿发生MP 感染时,急性期毒素封闭了Th细胞活性,IL-2的生成受到抑制;或IL-2受体过度表达,大量结合IL-2使急性期患儿血清中IL-2水平下降[14]。随着IL-2水平降低,患儿T 细胞功能明显下降,机体免疫保护功能减弱。说明IL-2与MPP严重程度及病程相关,且IL-2 可能参与了MPP 的整个病理生理过程。
IL-10是体内最主要的抑制性细胞因子之一,其主要免疫调节作用是抑制炎症反应,IL-10水平下降提示机体免疫调节失控。本研究结果显示,急性期、恢复期患儿血清IL-10 水平明显低于对照组,重症组患儿IL-10水平明显低于轻症组,说明儿童感染MP后机体免疫调节失控,病情越严重,IL-10的分泌抑制越严重。而恢复期患儿IL-10水平高于急性期,说明急性期抑制了IL-10的分泌,病情恢复时,IL-10 分泌抑制减轻,IL-10 水平逐渐上升。
MP是一种抗原,儿童发生MP感染后,会出现免疫应答,可刺激机体产生特异性抗体,导致自身免疫反应。血清Ig A、IgG、Ig M 水平越高,机体的免疫应答越强烈,症状、体征越严重。目前临床上最常用的诊断MPP 的方法是检测血清中的MP-Ig M,说明促使特异性免疫球蛋白增高的体液免疫反应参与了MPP的发病过程[15]。本研究结果显示,MPP 患儿急性期、恢复期和对照组血清Ig A、IgG、Ig M 水平存在显著差异,即急性期高于恢复期,恢复期高于对照组,重症MPP 患儿Ig A、IgG、Ig M 水平明显高于轻症组。原因可能是MP感染后会引起一系列炎症反应,B淋巴细胞活化,机体产生免疫反应致相关免疫球蛋白水平升高。但恢复期患儿激素治疗组与非激素治疗组间免疫球蛋白水平差异无统计学意义,可能是糖皮质激素治疗剂量较小,或免疫调节剂治疗对患儿体液免疫的影响较小。
综上所述,本研究结果显示,炎性细胞因子水平与MPP的病情相关,儿童在发生MP感染的同时存在包括炎性细胞因子在内的免疫功能紊乱。IL-2、IL-8、IL-10均参与了MPP感染的整个病理生理过程,由此可见,使用IL-2制剂提高患儿T细胞功能和机体免疫保护功能可能是新的治疗方向。同时也提示在治疗MPP时可适时应用免疫调节药物,以减轻患儿过度免疫应答反应,从而减轻症状,提高疗效。
利益冲突所有作者均声明不存在利益冲突
