PD-L1基因多态性对食管癌患者临床病理特征及临床预后质量的影响
2021-03-01吴晓婷费素娟
吴晓婷,费素娟,李 莉
(徐州医科大学附属医院消化内科,江苏 徐州 221000)
食管癌是临床上较为常见的肿瘤之一,食管鳞状细胞癌占食管癌病理组织类型的90%以上,我国每年因食管癌死亡人数在20万以上,多数患者因确诊时已为晚期,因此预后较差,5年生存率仅有30%左右[1,2]。随着医学技术的不断发展,人们对肿瘤免疫学认知进一步加深,免疫治疗成为了研究的热点。PD-L1是共刺激分子家族的一个成员,具有抑制T淋巴细胞活化的作用,在黑色素瘤、胃癌、结肠癌、肺癌等多种恶性肿瘤中异常表达,可作为免疫治疗的一个靶点[3-5]。有研究显示PD-L1基因多态性与肿瘤生物学特征有关,但关于PD-L1基因多态性与食管癌的研究较少[6,7]。基于此,本次选择PD-L1基因不同位点rs2890658、rs17718883、rs2297136以及rs4143185单核苷酸多态性对食管癌患者病理特征及预后的影响进行研究。
1 资料与方法
1.1 一般资料
选取2014年1月~2017年1月我院诊治的食管癌患者86例作为食管癌组,同期选取100例体检者作为对照组。纳入标准:(1)观察组患者均经过病理组织学确诊;(2)能够获得完整临床标本;(3)对照组无肿瘤及免疫系统疾病病史;(4)同意加入本次研究。排除标准:(1)临床资料缺失;(2)合并其他系统肿瘤;(3)入组前接受免疫治疗或者抗肿瘤治疗。本次研究已经在我院伦理委员会备案并获得批准,所有入组样本签署知情同意书。
1.2 方法
在GenBank数据库检索PD-L1基因,提取PD-L1不同位点rs2890658、rs17718883、rs2297136以及rs4143185的基因序列,采用Primer Premier 6.0软件设计基因引物序列,见表1。所有患者均在入院后收集外周静脉血标本,放于-80℃冰箱中储存,PD-L1不同位点rs2890658、rs17718883、rs2297136以及rs4143185的基因测序由北京博奥生物有限公司完成。

表1 PD-L1不同位点单核苷酸多态性引物序列
1.3 观察指标
(1)对比食管癌患者与对照组PD-L1基因不同位点单核苷酸多态性表达情况。(2)以不同基因位点基因型的不同类型分类,野生型(纯合野生型)及突变型(杂合突变型和纯合突变型),分析PD-L1基因不同位点单核苷酸多态性与食管癌病理类型、大小、部位、分化程度、淋巴结转移、浸润深度的关系。(3)分析PD-L1基因不同位点单核苷酸多态性对食管癌患者预后质量的影响。
1.4 随访
采用门诊、微信、电话等随访方式对患者进行随访,记录患者相关事件情况。随访时间为30~66个月,随访时间中位数为47个月,随访时间截止在2019年6月。
1.5 统计学处理

2 结果
2.1 两组基线资料比较
观察组1例患者因家属拒绝继续治疗,未取得完整资料,1例患者因在研究中确诊并发肝癌,最终完成研究84例。对照组中1例在体检后6个月内确诊胃癌,最终纳入研究99例。两组在性别、年龄、肿瘤家族史以及体重指数方面对比,差异无统计学意义(P<0.05)。见表2。
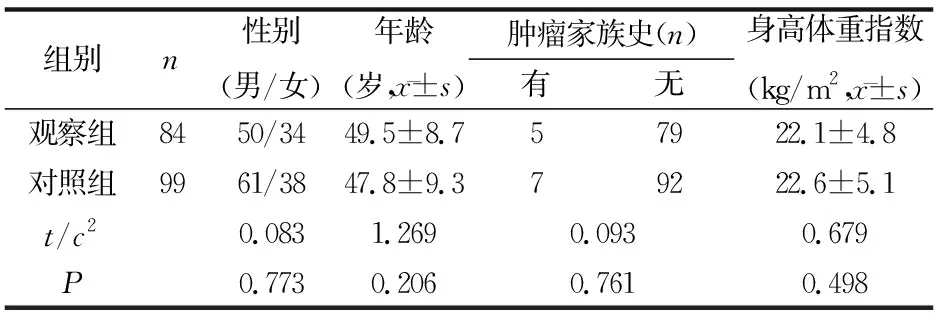
表2 两组基线资料对比
2.2 对照组PD-L1基因不同位点多态性Hardy-Weinberg平衡检验
对照组PD-L1基因不同位点多态性Hardy-Weinberg平衡检验结果显示,rs4143185不具有群体代表性(P<0.05),rs17718883、rs2890658、rs2297136结果具有群体代表性(P>0.05),见表3。
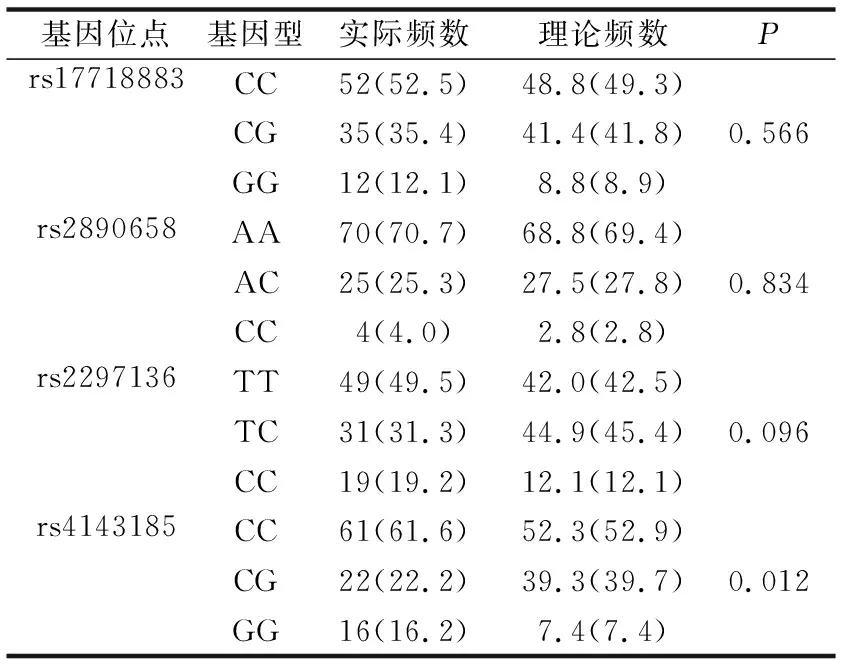
表3 对照组PD-L1基因不同位点多态性Hardy-Weinberg平衡检验[ n(%)]
2.3 两组PD-L1不同基因位点基因型对比
观察组与对照组在PD-L1不同基因位点基因型频率比较结果显示,rs17718883、rs2890658、rs2297136基因位点对比,差异均具有统计学意义(P<0.05),见表4。
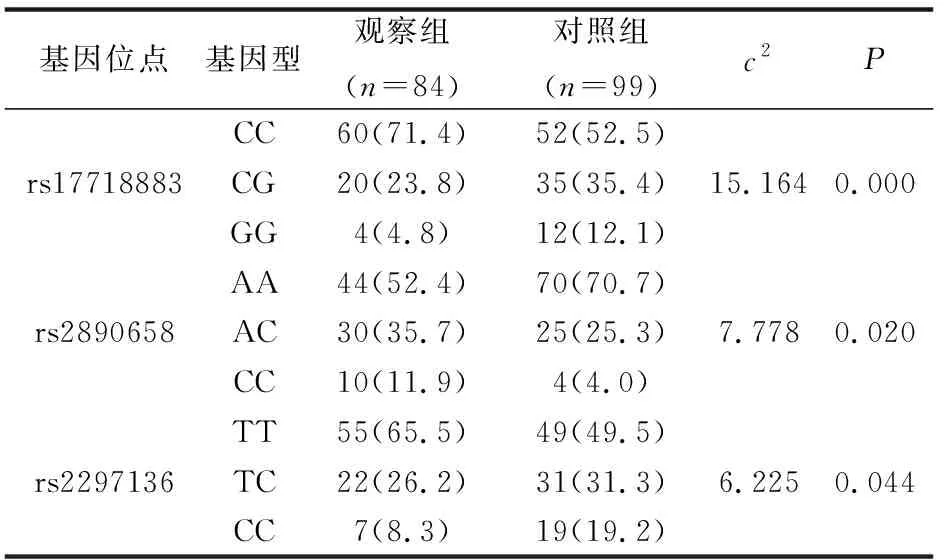
表4 两组PD-L1基因多态性基因型频率对比[ n(%)]
2.4 食管癌患者PD-L1基因多态性与食管癌患者临床病理特征关系
食管癌PD-L1不同基因位点按照野生型和突变型进行分组分析,结果显示,rs17718883与食管癌患者病理类型、分化程度有关,差异具有统计学意义(P<0.05),与其他临床病理特征无关(P>0.05);而rs2890658与食管癌患者分化程度有关,差异具有统计学意义(P<0.05),与其他临床病理特征无关(P>0.05);rs2297136与食管癌患者临床病理特征均无关,差异无统计学意义(P>0.05),见表5。
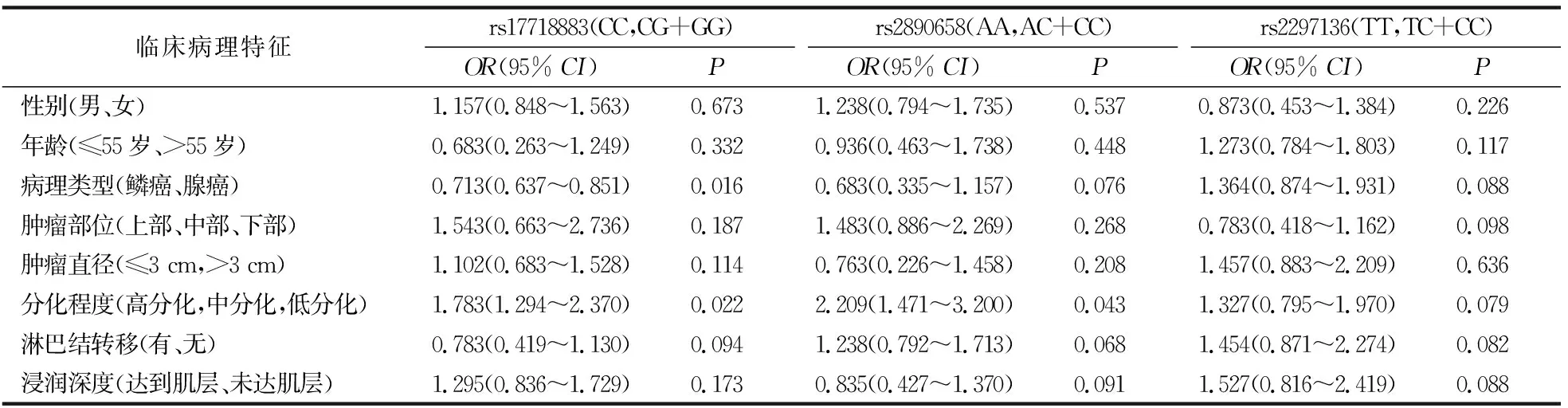
表5 PD-L1基因多态性与食管癌患者临床病理特征关系
2.5 PD-L1基因多态性对食管癌患者临床预后的影响V对食管癌患者不同基因位点按照野生型和突变型绘制kaplan-Meier生存曲线并进行log-rank检验,结果显示,rs17718883与食管癌患者预后生存有关,差异具有统计学意义(P<0.05);rs2890658及rs2297136对食管癌患者预后生存无影响,差异无统计学意义(P>0.05),见图1。

A:PD-L1基因位点rs17718883生存曲线; B: PD-L1基因位点rs2890658生存曲线; C:PD-L1基因位点rs2297136生存曲线图1 PD-L1不同基因位点生存曲线Fig 1 Survival curve of different gene loci of PD-L1
2.6 影响食管癌患者预后因素的Cox比例风险模型分析
对食管癌患者预后的因素进行Cox比例风险模型分析,结果显示,年龄、分化程度、淋巴结转移以及rs17718883基因型是食管癌患者预后的独立因素,差异具有统计学意义(P<0.05),见表6。

表6 食管癌预后因素的Cox回归分析结果
3 讨论
目前,对于食管癌的治疗效果仍然未能使人满意,随着医学研究的不断深入,免疫治疗应用在食管癌中具有极为广阔的前景[8]。PD-1以及PD-L1在多种肿瘤的发生、发展中发挥重要作用,PD-L1由290个氨基酸构成,属于Ⅰ型跨膜蛋白,其编码区域在第9号染色体Cd274上,PD-L1与PD-1结合后,使T淋巴细胞释放抑制性信号,进而导致T细胞丧失免疫活性,无法对肿瘤细胞产生免疫应答[9,10]。上皮细胞间质化是肿瘤转移浸润的主要途径,是在上皮组织细胞失去极性,各个细胞间的黏附连接丧失,从而转变为有间质细胞功能及形态的细胞,使肿瘤细胞浸润以及转移,而PD-L1的高表达会导致机体上皮细胞间质化发生,因此也有观点认为PD-L1通过肿瘤细胞的上皮细胞间质化发生免疫逃逸[11,12]。
PD-1/PD-L1是重要的免疫治疗靶点,目前针对该通路靶点的药物主要有Nivolumab以及Pembrolizumab[13]。单核苷酸多态性是指在一个群体中由于基因中某个位点发生突变而引起的基因序列多态性,有研究显示基因多态性对肿瘤特征、预后以及治疗效果具有重要影响[14,15]。本次选取的PD-L1基因不同位点rs17718883、rs2890658、rs2297136、rs4143185进行分析。
上述研究中,健康人群PD-L1基因位点rs17718883、rs2890658、rs2297136具有群体代表性。食管癌患者与健康人群PD-L1基因多态性对比,显示rs17718883、rs2890658、rs2297136具有差异,分析原因可能为PD-L1基因多态性与食管癌的发生、进展有关。Zhou等[16,17]研究显示PD-L1基因rs2890658位点单核苷酸多态性与食管鳞状细胞癌易感性有关,支持本研究结果。
在食管癌PD-L1基因多态性与临床病理特征关系研究中,rs17718883与食管癌患者病理类型、分化程度有关,rs2890658与食管癌患者分化程度有关。分析原因可能为在促进癌症细胞发生时,PD-L1就存在不同位点基因多态性的差异性表达,导致肿瘤表现出不同病理特征。Tsutsumi等[18]研究也显示,PD-L1不同位点的表达与上皮细胞间质化有关,帮助食管癌细胞免疫逃逸并增加其恶性程度,支持本研究结果。但Steiniche等[19]研究则提示食管癌患者不同的基因表达谱与病理特征及预后无关,与本研究结果不一致,考虑可能为样本选择性偏倚导致,因此在后续的研究中还需要不断探索。
kaplan-Meier生存曲线并进行log-rank检验结果显示,rs17718883位点的表达与食管癌患者预后有关,Cox比例风险模型分析也显示,rs17718883是食管癌预后的因素。分析原因可能为rs17718883 位于PD-L1基因的编码区,rs17718883 CC基因型存在增强PD-L1的作用,使PD-L1抑制细胞免疫的功能增强,同时也会增加食管癌细胞的免疫逃逸,导致预后较差。而程仕光等[20]在对肝癌的PD-L1多态性与预后关系的研究中,提示rs2890658以及rs4143185与肝癌预后有关,与本次结果有差异,分析原因可能为研究对象不同导致。
综上所述,在食管癌患者中,PD-L1基因不同位点与正常人存在差异,PD-L1基因rs17718883、rs2890658位点单核苷酸多态性对病理类型、分化程度有影响,而rs17718883位点单核苷酸多态性对食管癌患者预后有影响。
