基于PD-1/PD-L1表达影响探讨四君子汤对NK细胞及结肠癌作用的研究①
2021-03-01朱月伊宋运来石晓兰
朱月伊 宋运来 石晓兰
(上海中医药大学附属普陀医院,上海 200062)
结肠癌是世界常见的恶性肿瘤之一,2018年就已经有接近180万新患病例[1]。最近有研究表明,结肠癌的患病概率与吸烟相关[2]。尽管近年的存活率逐渐上升,但其难发现、易复发的特性使患者的治疗前景不容乐观[3]。
结肠癌由于发现不够及时,其治疗往往需要通过手术和放化疗联合应用,确诊后,大部分患者会选择手术治疗,手术治疗成为了结肠癌治疗的主要手段[4]。然而,手术等疗法存在复发及转移的可能,导致结肠癌的治疗更加棘手。
近年来,免疫疗法发展迅速,NK细胞得到了前所未有的重视。其不通过繁琐的信号通路调控就可直接快速地清除感染或被肿瘤侵占的细胞。而NK细胞自身拥有的多个膜表达活化受体及不同表型子集,也是发挥它强大免疫反应的关键[5-6]。正因为这种特殊性,一旦NK细胞表面受体被信号介导抑制,就会失去对病毒防御和对肿瘤监视的能力[7]。程序性死亡受体1(PD-1)是一种免疫学检查位点,常见于T淋巴细胞,该位点可与其对应的配体结合,激活相关信号通路,抑制T淋巴细胞的免疫反应,从而发生免疫逃逸。但与T淋巴细胞相关的NK细胞在PD-1方向还在深入探索中。大量研究数据显示,NK细胞对PD-1/PD-L1通路产生影响[8]。NK细胞表面存在PD-1,PD-1受体不仅抑制T细胞,还抑制NK细胞,且肿瘤活性的提升与PD-1表达上调密切相关,尤其在结肠癌、多发性骨髓瘤、卵巢癌中[9-11]。因此,抑制PD-1表达可能为NK细胞加强免疫反应提供帮助。STAT3是一种由770个氨基酸组成的蛋白质,其通过STAT结构区域与特定的磷酸酪氨酸序列结合在信号传导中起关键作用[12]。而作为转录因子,STAT3可直接结合启动子增加PD-1、PD-L1表达,也可以通过多种信号通路间接诱导这些因子的免疫检查点分子的表达[13-17]。尽管IFN-γ在临床多用于治疗恶性肿瘤,但最新研究显示其还可能促进肿瘤发展,并借由JAK/STAT3通路产生影响[18]。
四君子汤出自《太平惠民和剂局方》,是中医补益正气的经典代表方,由人参、白术、茯苓、炙甘草4药相伍而成,方中人参大补元气为君药,白术燥湿补气为臣药,茯苓渗湿泄热为佐药,甘草和中益土为使药,四药相合共行补脾益气之功效,临床上常用于治疗慢性胃炎、消化性溃疡、结肠癌等脾胃气虚病症。
1 材料与方法
1.1材料 人结肠癌细胞株HCT116购自中国科学院上海生命科学研究院细胞库;RPMI-Medium培养基购自美国HyClone公司;胰酶与血清购自美国Gibco公司;MTT、SDS购自中国Sangon公司;人外周血淋巴分离液TBD购自中国灏洋生物公司;人NK细胞富集试剂盒购自加拿大Stemcell Technology公司;RNA试剂盒及逆转录试剂盒购自日本TaKaRa公司;IFN-γ ELISA试剂盒购自中国LIANKE公司;PCR引物购自苏州泓迅生物科技股份有限公司;Napabucasin STAT3抑制剂购自美国MCE公司;血液标本购置自上海市长海医院血站,标本来自健康人,所有的指标都在范围内;四君子汤中药制备于上海中医药大学中药学院,药材购自上海市雷允上药业有限公司。常用离心机购自德国Eppendorf公司;梯度离心机、超低温冰箱及酶标仪等购自美国Thermo公司;实时荧光定量PCR仪购自美国Life Technologies公司;显微镜购自德国Leica公司;小型垂直电泳槽及小型Trans-Blot转印槽购自美国Bio-Rad公司。
1.2方法
1.2.1NK细胞的分离 将得到的标本以1∶1比例稀释于含有3%双抗的PBS(1X)溶液,待充分稀释后,与人外周血淋巴分离液以2∶1比例置于15 ml 小离心管,共12 ml,先放入4 ml分离液后缓慢加入8 ml稀释标本,配平至离心机,25℃、400 XG、20 min离心。离心后分为4层,用吸管缓慢少量多次吸取第2层液面(即淋巴细胞层),尽量吸尽,并再次加入含3%双抗的PBS(1X)溶液,25℃、200 XG下离心10 min,弃上清,加入含20%血清、1%双抗的1640培养液,电子计数至3×106个/ml,并将其以10 ml/皿均匀铺开,24 h后吸取上清液重复上述第二步离心,所得沉淀即为低浓度NK细胞。利用NK细胞富集试剂盒进行磁珠分选,排除非目的细胞,最后流式细胞术检测CD56+以评估NK细胞纯度,纯度 >90%即为实验所需。
1.2.2细胞的处理与分组 单一NK细胞铺板每孔3×106个/ml。在共培养模型中,NK细胞与HCT116比例为5∶1铺板,并尽量保持孔内体积较小,HCT116细胞以1×104个/10 μl加至5×104个/100 μl 的NK细胞中。设200 ng/ml IFN-γ处理的NK细胞为IFN-γ组,200 ng/ml IL-2处理的NK细胞为IL-2组(阳性对照组),5 mg/ml四君子汤处理的NK细胞为SJZ组,100 μmol/L奥沙利铂处理的NK细胞为OXA组(阳性对照组),正常处理的NK细胞为Con组,分别单独培养NK细胞,与HCT116细胞共培养24 h及48 h。同时以相同方式再加入STAT3信号抑制剂后,即为R-STAT3组、R-SJZ组、R-OXA组,共培养24 h及48 h 后进行后续实验。
1.2.3建立小鼠结肠癌皮下瘤模型 用生理盐水将CT-26细胞调整为5×106个/ml,以0.2 ml/只皮下注射至小鼠右侧腋下,接种2 d后检查小鼠皮下瘤生长情况,待瘤体达到100 mm3后,通过完全随机法将小鼠分为4组,每组6只,分别为空白组(CON)、生理盐水组(NACL)、四君子汤组(SJZ)和奥沙利铂组(OXA),空白组不作任何处理,NACL组、SJZ组以0.2 ml/(只·d)灌胃给药,OXA组每隔1 d进行1次腹腔注射给药,0.1 ml/(20 g·只),并持续2周。
1.2.4MTT法检测细胞毒性 细胞处理到24 h及48 h后,单一NK细胞每孔加入10 μl 5 mg/ml的MTT,3.5 h后,每孔加入100 μl 10%SDS溶液,24 h后,上样酶标仪检测,读取波长570 nm处OD值并进行统计计算。共培养模型中的HCT116细胞需要先用移液器轻吹,少量多次缓慢吸取上清液,加入新的含20%血清、1%双抗的培养液100 μl后,再进行上述常规的加入MTT操作。
1.2.5qRT-PCR检验mRNA表达 细胞共培养24 h 及48 h后,轻吹各孔得到上清液,由于HCT116肿瘤细胞与NK细胞体积密度不同,以差速离心法得到NK细胞沉淀。以相同方法得到肿瘤细胞沉淀,加入适量TRIzol溶液溶解,通过异丙醇,氯仿,无水乙醇获得RNA,并逆转录成cDNA,qRT-PCR检测mRNA表达,PCR反应条件为:95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环,最后得到数值后利用2-ΔΔCt法进行数值统计。小鼠皮下瘤的RNA提取需要先将肿块剪碎后放入磁珠,再加入适量TRIzol溶液并放到动物RNA提取仪器中60 Hz、2次/min振荡,再进行后续操作。
1.2.6ELISA检测IFN-γ水平 细胞共培养24 h及48 h后,获得各组上清液,根据IFN-γ试剂盒说明书建立标准曲线方程,最后得到的OD值代入方程中进行换算得到IFN-γ分泌量。小鼠眼球血液的上清液需以3 000 r/min 4℃离心5 min。
1.2.7活体成像技术 小鼠给药2周后,以每只小鼠200 μl/20 g、15 mg/ml的荧光素钾盐进行腹腔注射,根据体重利用戊巴比妥钠麻醉[50 μl/(20 g·只)],待小鼠失去行动能力后,置于活体成像仪进行检测。
1.2.8Western blot检测蛋白表达 摘取小鼠皮下瘤后,各组剪取相同统计大小的肿块进行RIPA裂解,并放入组织匀浆器中充分研磨,以12 000 r/min 4℃离心5 min,得到上清液。根据蛋白浓度试剂盒标准方程,按照步骤操作后在酶标仪波长 570 nm 处取得OD值,换算得到蛋白浓度。根据PD-L1蛋白大小配胶,10%的分离胶,5%的浓缩胶,蛋白在定量后根据体积加入5 X上样缓冲液,95℃金属浴10 min,随后以3 000 r/min、4℃离心1 min。上样完毕后,恒压70 V电泳30 min,然后根据标准线指示转为恒压90 V,视情况而定等待1~2 h,随后转膜并封闭,洗膜后加入PD-L1的稀释一抗4℃孵育过夜。回收一抗洗膜3次后,加入二抗,室温孵育2 h,再次洗膜3次,最后加化学发光试剂显影,得到数据后通过Image J软件换算灰度值并进行统计分析。
1.2.9免疫组化实验 将取得的皮下瘤进行石蜡切片,用二甲苯与无水乙醇常规脱蜡,灭活后进行封闭并加入抗体孵育,二抗孵育完成后PBS(1 X)冲洗4次,根据显色试剂盒说明书,加入显色试剂,最后用无水乙醇冲洗、封片并在显微镜下观察。利用Image-Pro Plus 6.0软件进行灰度值测定并进行统计分析。

2 结果
2.1IFN-γ可抑制NK细胞生长 IFN-γ在200 ng/ml 下可以抑制NK细胞生长(P<0.05),四君子汤在NK细胞存在的情况下,可以增强对HCT116细胞的杀伤作用(P<0.01),奥沙利铂在抑制NK细胞生长的同时,也抑制了HCT116细胞增殖(P<0.05)。见表1。
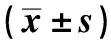
表1 IFN-γ和四君子汤对NK细胞活性及共培养模型中HCT116的增殖影响
2.2四君子汤可降低NK细胞分泌IFN-γ的水平 四君子汤可降低单一NK细胞IFN-γ的分泌(P<0.05),且在与STAT3抑制剂联合使用后抑制作用更加明显(P<0.05)。在共培养模型中,四君子汤联合STAT3抑制剂依旧可降低IFN-γ分泌(P<0.05)。见表2。
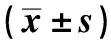
表2 四君子汤和STAT3抑制剂对NK细胞及共培养模型中IFN-γ分泌的影响
2.3四君子汤可降低NK细胞 mRNA表达 四君子汤可降低共培养模型中NK细胞IFN-γ(P<0.05)、PD-1(P<0.05)、STAT3(P<0.01)的表达(P<0.01),且在与STAT3抑制剂联合后,更为显著降低IFN-γ(P<0.05)、PD-1(P<0.05)、STAT3 24 h(P<0.05)。相同的是,四君子汤与STAT3抑制剂联合使用也可降低共培养模型中HCT116细胞PD-L1、STAT3 mRNA的表达(P<0.05)。见表3、4。
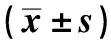
表3 四君子汤和STAT3抑制剂对共培养模型中NK细胞mRNA的影响
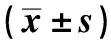
表4 四君子汤和STAT3抑制剂对共培养模型中HCT116细胞 mRNA的影响
2.4四君子汤可抑制小鼠结肠癌皮下瘤生长,并降低PD-L1蛋白及抗体表达 四君子汤可降低PD-L1蛋白及抗体表达(P<0.05,图1),还可抑制小鼠结肠癌皮下瘤的生长,其荧光强度低于NACL组和空白组(P<0.05,图2)。
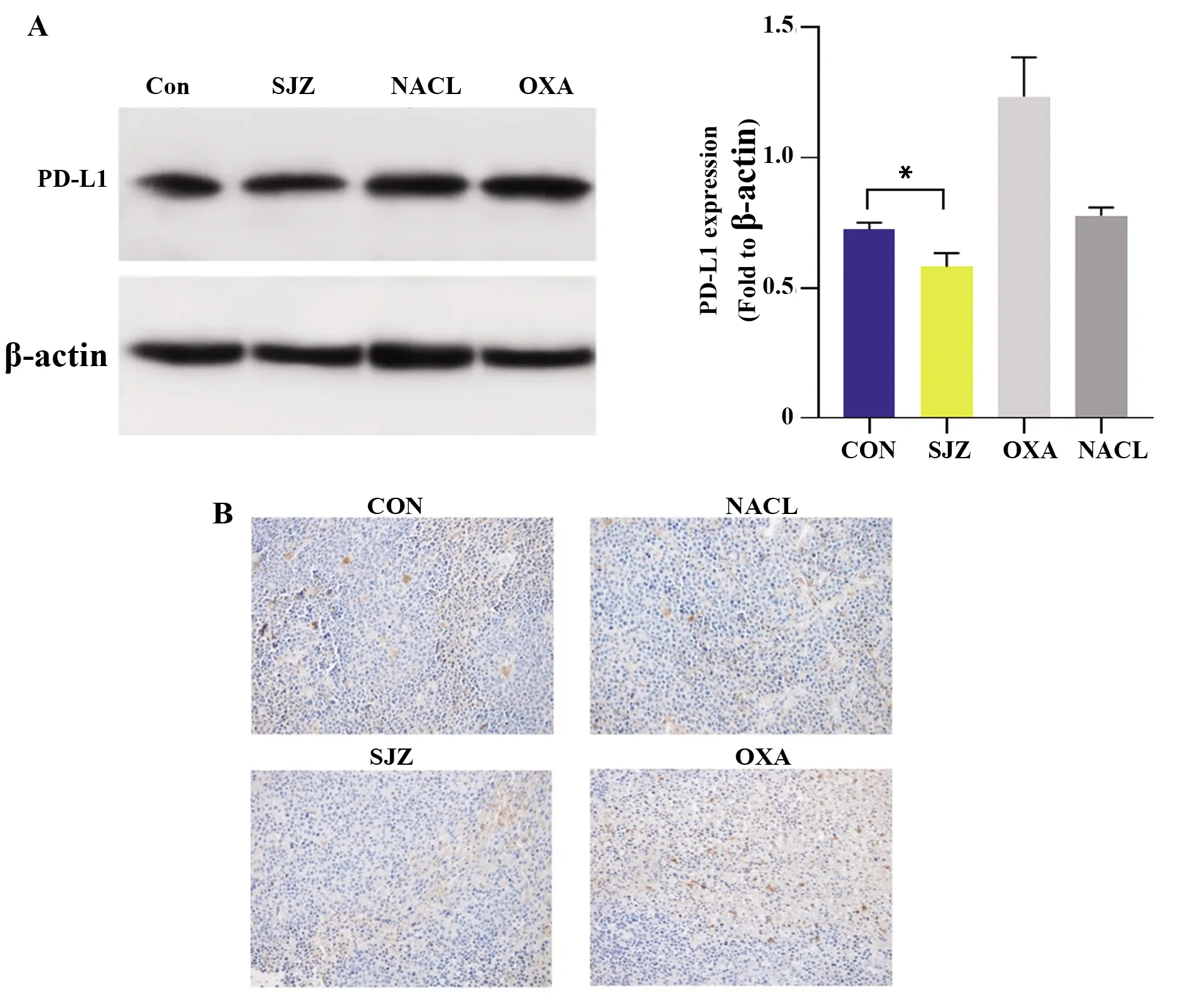
图1 PD-L1蛋白表达

图2 小鼠荧光强度
2.5四君子汤可降低小鼠结肠癌皮下瘤PD-L1 mRNA表达和血液中IFN-γ分泌 四君子汤可降低小鼠结肠癌皮下瘤PD-L1 mRNA表达(P<0.01),并可降低其血液中IFN-γ分泌(P<0.05)。见图3。
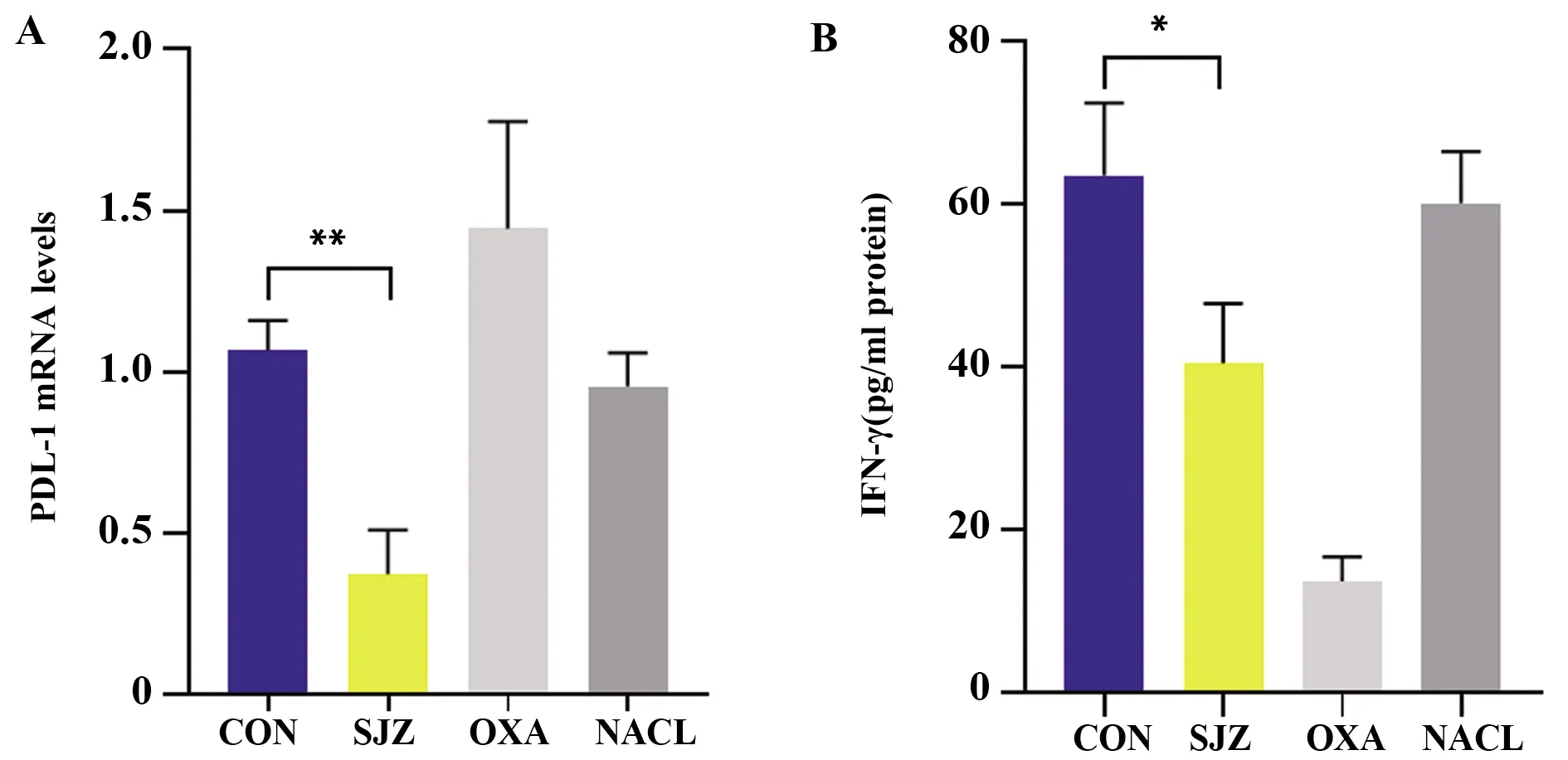
图3 PD-L1 mRNA及IFN-γ水平
3 讨论
NK细胞在肿瘤的杀伤中起关键作用,当NK细胞表面的PD-1与肿瘤的免疫检查位点PD-L1结合时,NK细胞表达的活化受体将无法激活,细胞活化、分裂、细胞毒性等能力减弱,导致肿瘤免疫逃脱,使免疫反应无法进行。因此,降低PD-1或PD-L1表达,抑制二者结合及信号通路形成可有效避免NK细胞衰弱,达到增强免疫反应的目的[10,19]。
既往研究发现,STAT3的异常激活可通过传播肿瘤细胞与肿瘤微环境之间串扰导致肿瘤免疫反应的抑制,在自身激活活化的同时,促进其他免疫抑制因子表达[20]。最近发现,CD4+T细胞PD-1表达可上调STAT3 mRNA[21],免疫检查位点抑制剂和STAT3抑制剂联合使用在临床上也达到了预期效果[22]。同时,也有研究发现,STAT3在肿瘤浸润免疫细胞中过度活化会影响先天免疫和适应性免疫应答,从而引起免疫抑制。例如在先天免疫细胞中存在大量的STAT3,可能会引发以降低IFN-γ为代表的炎性介质的一系列反应,从而减缓炎症信息的传递,导致免疫抑制,在适应性免疫中,STAT3活性的持续升高会导致T淋巴细胞活性降低,导致抗肿瘤作用降低[23-25]。四君子汤作为中药的经典方可以杀伤肿瘤细胞[26],最近发现其中蕴含的多糖可以对淋巴细胞、脾细胞以及巨噬细胞发挥不同的免疫作用[27],而加味四君子汤也具有很好的抗肿瘤活性,还可以改善荷瘤小鼠的肝肾功能,其作用可能归功于IL-2、TNF-α等[28]。最近有研究表明,LY294002 PI3K/AKT信号通路抑制剂可抑制IFN-γ分泌和经番茄素处理的肺癌细胞PD-L1的表达[29]。
综上所述,四君子汤可影响NK细胞活性及结肠癌增殖,其功能与STAT3抑制剂相近,可能通过调控STAT3信号干预IFN-γ分泌,降低PD-1/PD-L1的表达从而改善NK细胞活性并抑制结肠癌的细胞的生长,可为结肠癌的临床治疗及实验研究提供依据。
