顺式阿曲库铵对人乳腺癌MCF-7细胞株生物学特性影响的实验研究①
2021-03-01欧册华
张 君 欧册华 刘 莉 贾 飞 洋 超 赵 鹏
(西南医科大学附属医院疼痛科,泸州 646000)
乳腺癌已成为全球发病率和死亡率均居首位的恶性肿瘤,严重危害女性生命健康[1]。虽然我国乳腺癌发病率相对发达国家较低,但近年来我国乳腺癌患者逐年递增,且发病率趋于年轻化[2-3]。手术切除和化疗辅助治疗为目前主要的治疗方式,但手术切除和化疗辅助治疗均会给患者带来严重的生理和心理创伤,因此寻求药物辅助抑制乳腺癌肿瘤细胞的运动及活性尤为重要[4]。顺式阿曲库铵是阿曲库铵的一种同分异构体,是一种手术麻醉药物[5]。YABASIN等[6]研究表明,顺式阿曲库铵可通过线粒体诱导癌细胞凋亡。本文旨在研究顺式阿曲库铵对人乳腺癌MCF-7细胞株生物学特性影响,以期了解顺式阿曲库铵对人乳腺癌MCF-7细胞株的作用机制,从而为乳腺癌的辅助治疗提供一定的理论依据。
1 材料与方法
1.1材料
1.1.1细胞来源 乳腺癌MCF-7细胞株购自中国科学院细胞库。
1.1.2药物与试剂 顺式阿曲库铵购自江苏恒瑞医药股份有限公司(国药准字:H20060869);E-cadherin、Vimentin抗体购自上海沪尚生物科技有限公司;DMEM培养基、二甲基亚砜(dimethyl sulfoxide,DMSO)、青霉素和链霉素、胰蛋白酶购自上海生工生物股份有限公司;EDU(5-Ethynyl-2′-deoxyuridine)购自美国Sigma公司;N-cadherin抗体购自Santa Cruze Biotechnology 公司;Bax、Bcl-2抗体购自武汉华联科有限公司;细胞色素C(cytochrome C)、PARP和cleaved PARP抗体购自南京建成生物工程研究所;VEGF抗体购自武汉博欧特生物科技有限公司;Annexin V-FITC 凋亡检测试剂盒购自杭州四季青生物工程材料有限公司;Hoechst染色剂购自武汉默沙克生物科技有限公司;VEGF荧光试剂盒购自江莱生物有限公司;TRIzol 试剂购自Thermo Fisher公司。
1.1.3仪器 CO2培养箱购自日本SanYo公司;BS-124s 型电子天平购自北京赛多斯仪器系统有限公司;TDL-5 型台式离心机购自上海安亭科学仪器厂;光学显微镜购自东莞市同创仪器有限公司;低温离心机购自湖南恒诺离心机有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司;凝胶成像系统购自以色列DNR公司;Line gegn 9600 PCR仪购自石家庄奥龙科技有限公司。
1.2方法
1.2.1细胞培养与分组 将各组乳腺癌MCF-7细胞培养于37℃、5%CO2、含10%新生小牛血清的DMEM培养液中。每2 d更换1次培养液,细胞长满瓶底后消化传代,取对数生长期的细胞进行培养。将细胞用PBS缓冲液清洗3次,加入0.25%的胰蛋白酶溶液消化,当细胞变圆即将脱离瓶壁时,停止消化。计数后将细胞转移至新的培养瓶中继续培养。
1.2.2药物干预 调整对数生长期细胞浓度为1×105个/ml,以100 μl/孔接种于96孔板,37℃、5% CO2条件下过夜培养(约16 h),各组分别使用含0、5、10、20 μmol/L顺式阿曲库铵的完全培养基 200 μl 培养24 h。并根据处理浓度分为对照组、顺式阿曲库铵5 μmol/L组、顺式阿曲库铵10 μmol/L组、顺式阿曲库铵20 μmol/L组。
1.2.3细胞增殖检测 取上述药物干预后的各组细胞,根据EDU染色试剂盒说明书,用完全培养基将EDU稀释至10 μmol/L,每孔加入100 μl,孵育4 h 后弃培养基,PBS清洗2次,多聚甲醛固定,Apollo染色,立即检测或用抗荧光淬灭封片后检测细胞增殖情况。采用克隆形成实验检测细胞生长,取对数生长期细胞,制作1×105个/ml单细胞悬液并计数,并将细胞接种至6孔板中梯度培养,2周后显微镜下可见明显克隆形成,结晶紫染色后拍照,并计算克隆形成率。
1.2.4流式细胞术检测细胞凋亡 取上述药物干预后的各组细胞,使用胰酶消化,在4℃离心机中离心 5 min 收集细胞;收集细胞后加入100 μl Binding Buffer重悬,并加入5 μl Annexin V-FITC和5 μl PI轻轻混匀;室温避光孵育 15 min并加入400 μl Binding Buffer使用流式细胞仪检测。
1.2.5Hoechst染色法观察细胞凋亡 取上述药物干预后的各组细胞,待乳腺癌MCF-7细胞长至80%汇合度,胰蛋白酶消化,以1.5×106个/孔接种于6孔板,预先置于37℃、5%CO2、饱和湿度培养箱中培养24 h。加入DMEM基础培养基稀释的SiO2溶液,再次培养24 h,PBS洗涤2次后每孔加入1 ml Hoechst 33342染色液于37℃培养箱中孵育25 min,而后室温下避光孵育15 min,在荧光显微镜下以紫外光激发,观察并计数。每组随机选取视野,计算凋亡细胞数和细胞总数(每组不少于1 000个),并计算凋亡率。
1.2.6划痕实验检测细胞迁移能力 将划痕实验插件置于24孔板,取上述药物干预后的各组细胞,调整对数生长期的乳腺癌MCF-7细胞调至5×105个/孔,37℃、5% CO2条件下过夜培养,次日小心移去划痕实验插件,用完全培养基润洗3次,加入10 μmol/L 丝裂霉素,继续培养2 h,更换新鲜完全培养基,100倍显微镜下拍照记为0 h,继续培养24 h 后拍照,分析细胞的迁移情况,实验重复3次。
1.2.7Transwell法检测细胞侵袭能力 取上述药物干预后的各组细胞,Transwell小室中将5 μg 纤黏连蛋白用移液器均匀涂抹在小室内的PVDF聚碳酸滤膜外表面;膜内侧表面涂5 μg matrigel。调整细胞量2×105个/孔,设置3个复孔;加入不同浓度的阿曲库铵于37℃、5% CO2温箱培养4 h。PBS清洗3次并去除小室中膜内侧表面多余的细胞,以多聚甲醛固定;400倍显微视野下随机选取10个视野,倒置显微镜下采用双盲计数法统计膜下表面的细胞数目平均值。实验重复3次。
1.2.8Western blot 检测蛋白表达水平 取上述药物干预后的各组细胞,吸除培养皿中的培养基保存于灭菌离心管。1 200 r/min离心10 min后加入裂解液重悬细胞,冰中裂解30 min,再次以1 200 r/min离心10 min,加入200 μl Loading Buffer 缓冲液,100℃煮沸 10 min;以BCA法测定蛋白浓度后,SDS-PAGE电泳提取总蛋白,半干法将蛋白转移至PVDF膜后放入 TBST 溶液中缓慢摇动洗膜5 min,再将 PVDF 膜放入配制好的一抗(1∶500)中孵育,室温下摇动30 min后放入4℃恒温箱中过夜。取出后使用TBST洗涤3次后放入二抗反应液中室温孵育 2 h;封闭液:二抗为2 000∶1;曝光后以Actin为内参蛋白,目的蛋白条带灰度值/内参条带灰度值为相对蛋白表达水平。
1.2.9免疫荧光法检测VEGF阳性表达情况 取对数生长期乳腺癌MCF-7细胞,调整细胞浓度为2.5×105个/ml,取2 ml接种于6孔板,37℃、5% CO2条件下过夜培养(约16 h)。按照VEGF荧光试剂盒说明书加入固定液固定10 min,弃固定液,PBS清洗3次,加入免疫染色液,室温封闭1 h,加入DAPI染液,室温染色5 min,洗涤液洗涤2次,加入抗淬灭剂,荧光显微镜下观察。
1.2.10RT-PCR检测VEGF基因表达 TRIzol 试剂提取各组细胞总 RNA,测定 RNA 浓度和纯度,反转录试剂盒合成 cDNA后PCR扩增,按照试剂盒操作说明书检测RNA表达水平,以Actin为内参,采用2-ΔΔCt法计算RNA的相对表达量。
1.3统计学分析 本研究数据分析采用SPSS22.0软件,作图软件采用GraphPda Prism5,方差分析使用单因素方差分析,使用单因素方差分析时,以P<0.05为数据差异有统计学意义。
2 结果
2.1细胞增殖能力检测结果 相比于对照组,顺式阿曲库铵5 μmol/L组EDU阳性细胞数目无显著变化(P>0.05),顺式阿曲库铵10 μmol/L、20 μmol/L组EDU阳性细胞数目显著降低(P<0.05,图1A)。由图1B可知,相比于对照组,顺式阿曲库铵5 μmol/L 组细胞克隆形成率无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L 组细胞克隆形成率显著降低(P<0.05)。
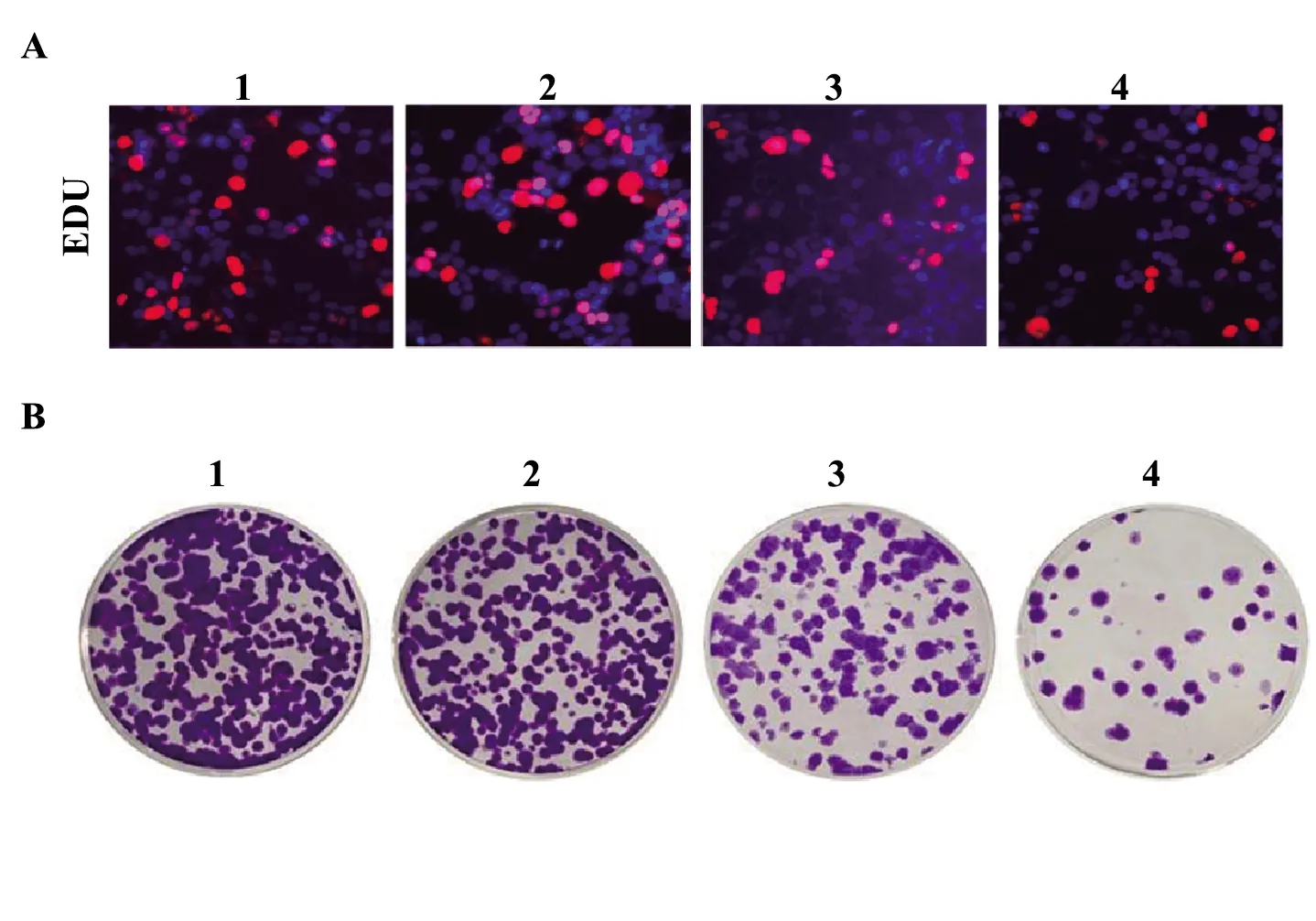
图1 细胞增殖能力检测结果
2.2细胞凋亡检测结果 由图2A可知,相比于对照组,顺式阿曲库铵5 μmol/L组细胞凋亡率无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组细胞凋亡率显著升高(P<0.05)。由图2B可知,相比对照组,顺式阿曲库铵5 μmol/L组细胞凋亡率无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组细胞凋亡率显著升高(P<0.05)。
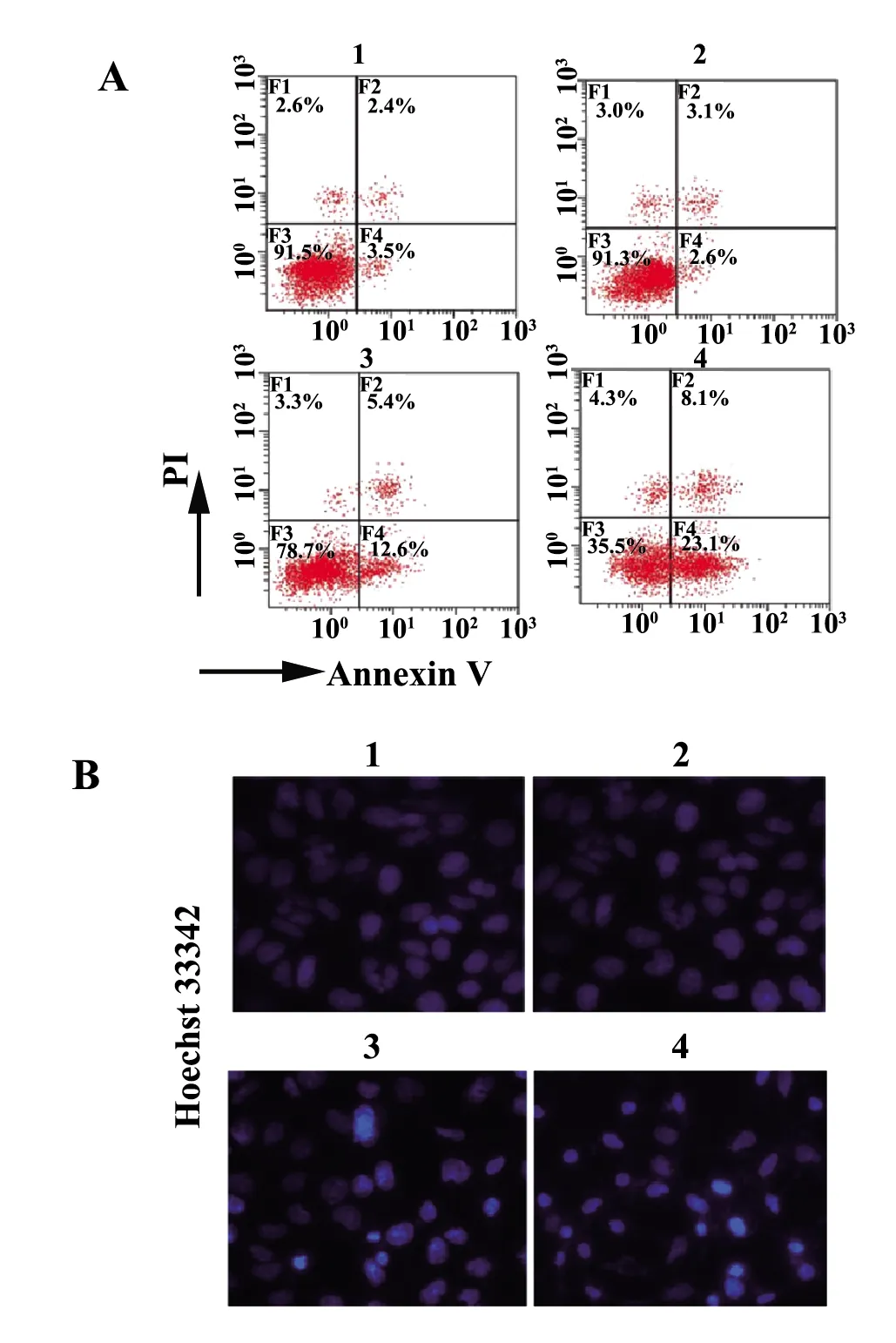
图2 细胞凋亡检测结果
2.3细胞运动能力检测结果 相比对照组,顺式阿曲库铵5 μmol/L组侵袭细胞数目无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组侵袭细胞数目显著降低(P<0.05,图3A)。相比对照组,顺式阿曲库铵5 μmol/L组细胞迁移率无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组细胞迁移率显著降低(P<0.05,图3B)。

图3 细胞运动能力检测结果
2.4细胞运动相关蛋白检测结果 由图4A可知,相比对照组,顺式阿曲库铵5 μmol/L组E-cadherin、N-cadherin蛋白表达无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组N-cadherin蛋白表达显著降低,E-cadherin蛋白表达显著升高(P<0.05);由图4B可知,相比对照组,顺式阿曲库铵5 μmol/L组Viminten阳性斑点数无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组Viminten阳性斑点数显著降低(P<0.05)。
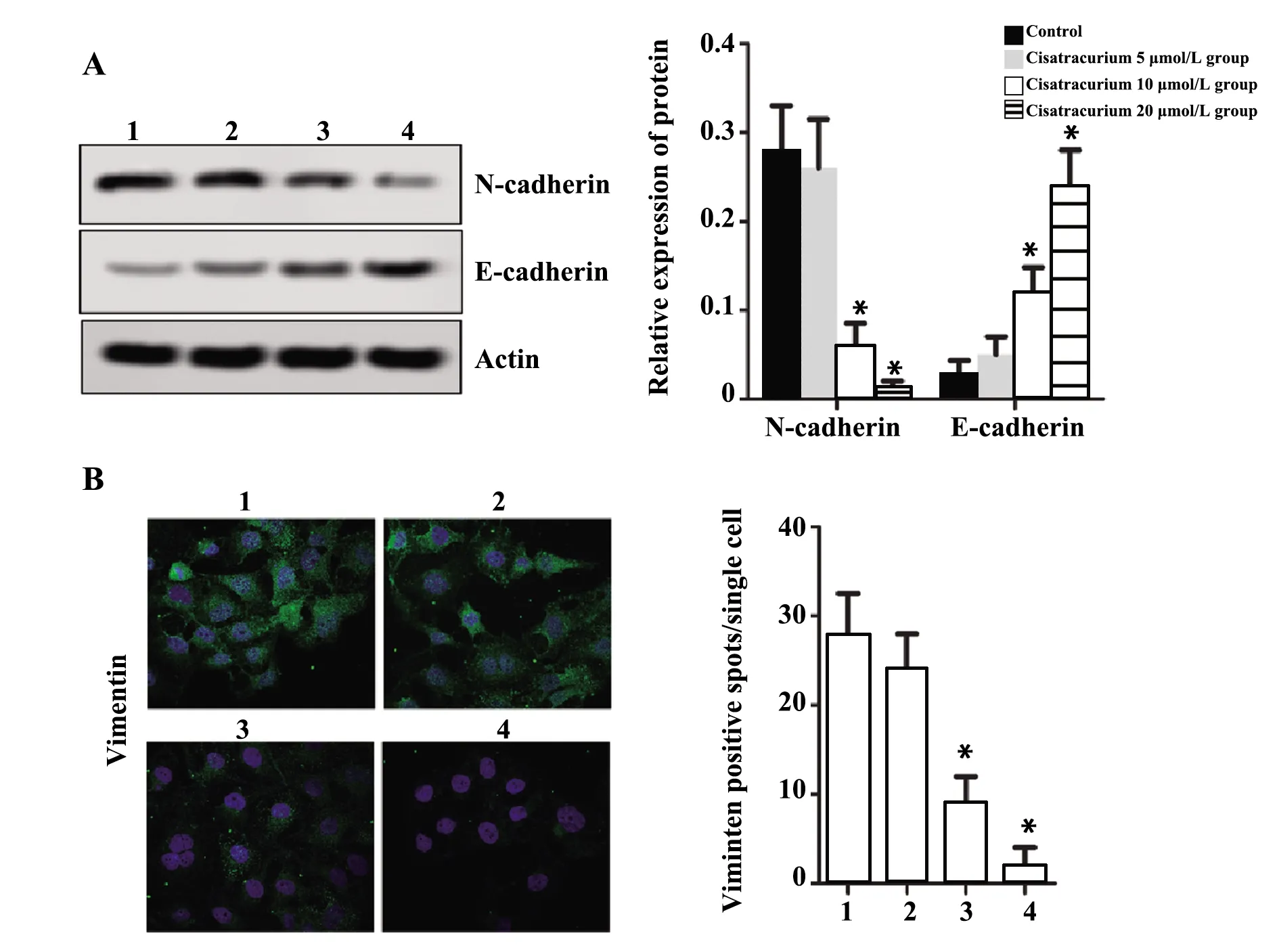
图4 细胞运动相关蛋白检测结果
2.5微管形成实验结果及VEGF表达情况 由图5A可知,相比对照组,顺式阿曲库铵5 μmol/L组节点数目无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L 组节点数目显著降低(P<0.05);由图5B可知,相比对照组,顺式阿曲库铵5 μmol/L组VEGF蛋白表达水平及VEGF mRNA表达无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L VEGF蛋白表达水平及VEGF mRNA表达显著降低(P<0.05)。
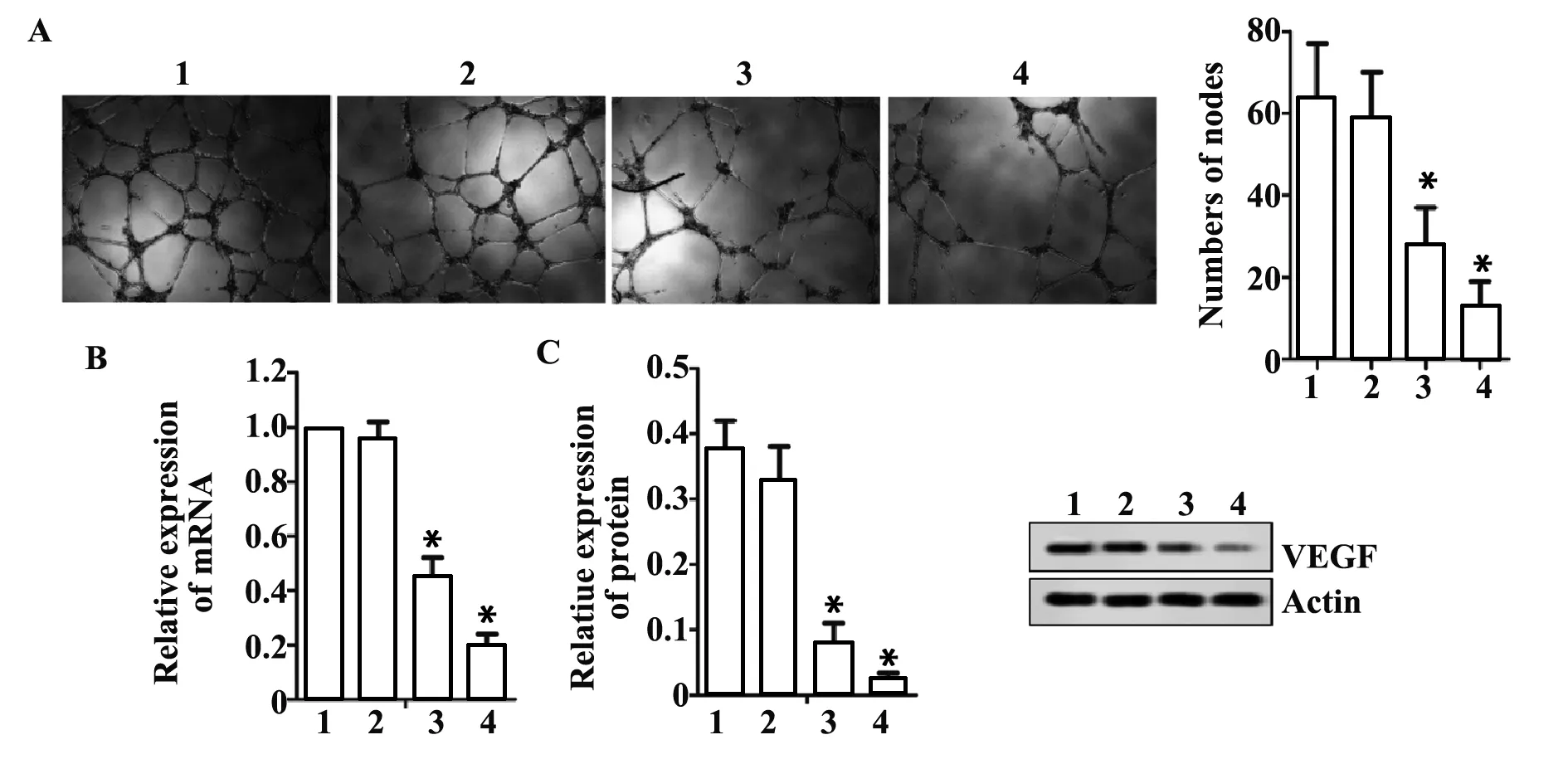
图5 微管形成实验结果及VEGF表达情况
2.6凋亡相关蛋白表达结果 由图6可知,相比对照组,顺式阿曲库铵5 μmol/L组Bax、Bcl-2、cytochrome C、PARP和cleaved PARP蛋白表达水平无显著变化(P>0.05),顺式阿曲库铵10、20 μmol/L组Bax、cytochrome C、PARP和cleaved PARP蛋白表达水平显著升高,Bcl-2蛋白表达水平显著降低(P<0.05)。
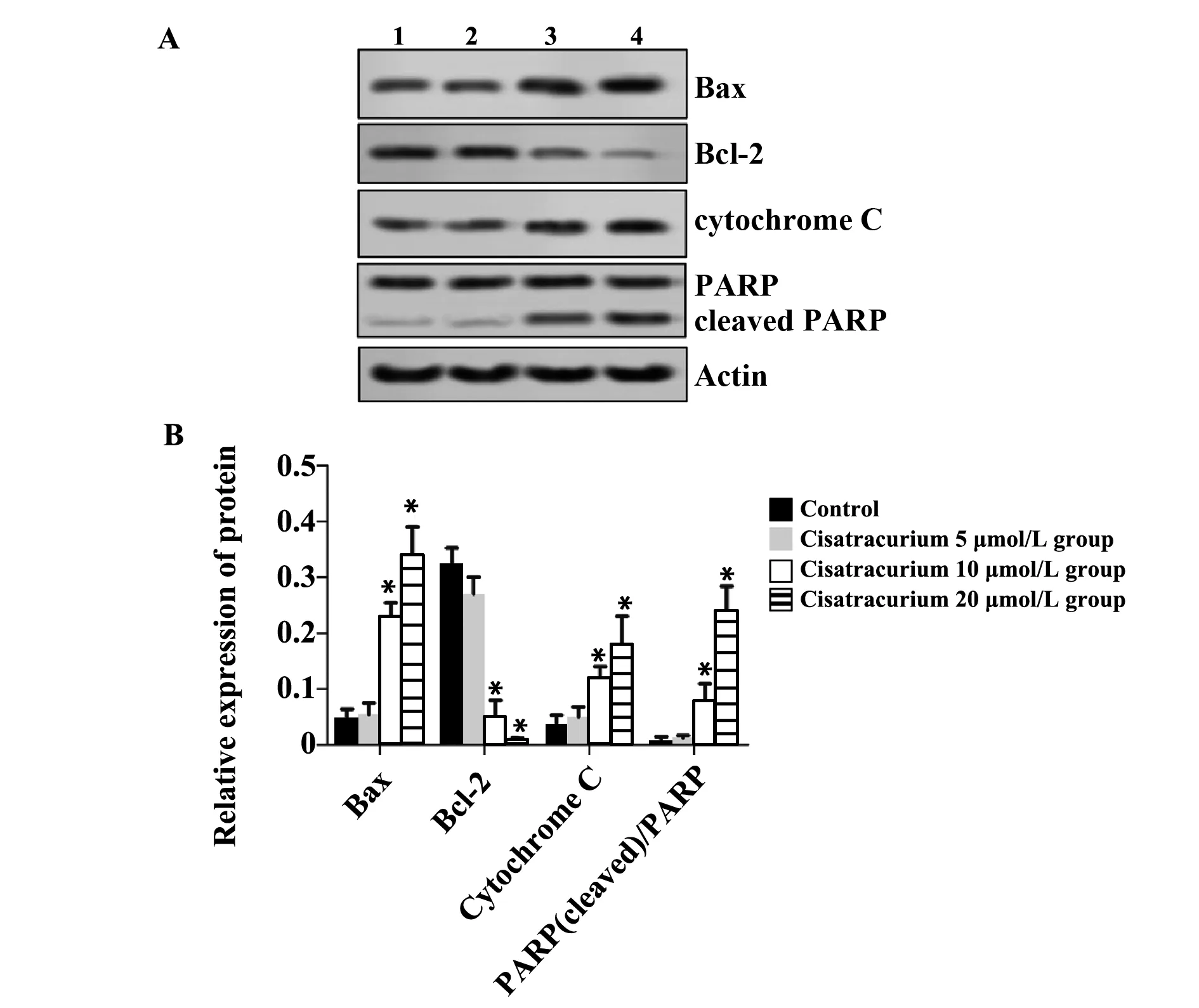
图6 凋亡相关蛋白表达结果
3 讨论
血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)能特异性作用于血管内皮细胞,并促进血管内皮细胞增殖,其在胚胎发育、创伤愈合、肿瘤生长及转移过程中发挥重要作用[7]。王文廉等[8]研究表明VEGF可引起血管内皮细胞的分裂、增殖及迁移,从而促进肿瘤细胞的进一步生长。本研究表明,相比对照组,顺式阿曲库铵5 μmol/L组VEGF蛋白表达水平及VEGF mRNA表达无显著变化,顺式阿曲库铵10、20 μmol/L组VEGF蛋白及mRNA表达显著降低。EDU染色结果显示,相比对照组,顺式阿曲库铵5 μmol/L组细胞阳性细胞数目无显著变化,顺式阿曲库铵10 μmol/L组阳性细胞数目显著降低。平板克隆实验结果分析显示,相比对照组,顺式阿曲库铵5 μmol/L组细胞克隆形成率无显著变化,顺式阿曲库铵10 μmol/L组细胞克隆形成率显著降低。提示顺式阿曲库铵可有效降低乳腺癌MCF-7细胞的增殖能力,但当顺式阿曲库铵剂量低于5 μmol/L时作用效果并不明显。宋莹等[9]研究表明,抑制VEGF-A表达可抑制乳腺癌细胞的增殖、侵袭与转移,与本研究结论一致。
细胞的侵袭和迁移受上皮间质转化(epithelial mesenchymal transition,EMT)调节[10-11]。EMT是指上皮细胞能暂时丧失细胞极性获得间质细胞移动能力。肿瘤细胞能够通过细胞极性丧失改变自身细胞形态与其他细胞分离[12-13];N-钙黏蛋白(N-cadherin,CDH2)也称为钙黏着蛋白-2或神经钙黏着蛋白,是人体由CDH2 基因编码的蛋白质。N-钙黏蛋白是在多种组织中表达并起到介导细胞-细胞黏附功能的跨膜蛋白。付丽梅等[14]研究表明,N-cadherin阳性表达率与癌的浸润深度、分化程度、转移呈正相关,且随着癌症转移的发生N-cadherin蛋白表达量显著增加。唐莹等[15]研究表明,Vimentin是一种间质细胞来源的骨架蛋白,在维持间质细胞特性中起关键作用。其研究还表明,Vimentin表达出现异常时,细胞骨架蛋白的构成也会发生显著改变,这种改变会导致正常上皮细胞变成纤维状且易于游动迁移,促使细胞的侵袭、迁移能力增强。EMT晚期时Vimentin表达量通常会显著强加,这也是EMT晚期的显著标志之一[16]。本研究表明,相比对照组,顺式阿曲库铵5 μmol/L组E-cadherin N-cadherin蛋白表达及Viminten阳性斑点数无显著变化,顺式阿曲库铵10、20 μmol/L组N-cadherin蛋白表达及Viminten阳性斑点数显著降低,E-cadherin蛋白表达显著升高。同时Transwell结果及划痕实验结果也表明使用10 μmol/L顺式阿曲库铵后乳腺癌MCF-7细胞的侵袭及迁移能力显著降低。这可能是由于顺式阿曲库铵可通过抑制乳腺癌细胞的EMT过程增强细胞间的黏附能力,阻止肿瘤细胞运动,从而达到抑制乳腺癌细胞扩散的效果。郭昭泽等[17]研究表明,调节EMT过程可使乳腺癌细胞的侵袭及迁移能力减弱,与本研究得出的结论一致。
聚腺苷二磷酸核糖聚合酶(cleaved-PARP,c-PARP)是一种与DNA损伤修复及细胞凋亡密切相关的酶[18]。PARP影响细胞凋亡与Caspase 家族的凋亡执行因子Caspase-3密切相关[19]。当细胞凋亡启动时会激活Caspase-3,将PARP剪切成 85 kD 和 31 kD 2个片段,破坏PARP与DNA 的相互作用可导致PARP的靶蛋白Ca2+/Mg2+依赖性核酸内切酶活性增强,促使DNA裂解,最终导致细胞凋亡。除了Caspase家族基因可以调控凋亡外,Bcl-2 家族的基因也是常见的凋亡控制基因。Bcl-2 家族主要通过Bcl-2和Bax这两种蛋白表达量观察细胞是否凋亡[20-22]。Bax和Bcl-2表达呈相反趋势,当Bcl-2表达下降时 Bax 表达上升,此时会促进细胞凋亡;当Bcl-2 表达升高,Bax表达降低时,则会抑制细胞凋亡。当细胞接收到凋亡信号后,Bax/Bcl-2比值升高,线粒体膜电位变化并最终提高线粒体外膜通透性,同时会将cytochrome C释放至细胞质,并与 Apaf-1、procaspase-9形成复合体进而激活Caspase-3 进一步增强细胞凋亡过程[23-24]。本研究发现,相比对照组,顺式阿曲库铵5 μmol/L组Bax、Bcl-2、cytochrome C、PARP和cleaved PARP蛋白表达水平无显著变化,顺式阿曲库铵10、20 μmol/L组Bax、cytochrome C、PARP和cleaved PARP蛋白表达水平显著升高。流式细胞术和Hoechst 33342染色结果显示,当顺式阿曲库铵处理浓度达到 10 μmol/L时,细胞凋亡率显著升高,说明低剂量顺式阿曲库铵对乳腺癌MCF-7细胞凋亡影响较小,当处理剂量达到10 μmol/L时细胞凋亡率显著升高。王莹等[25]研究表明,通过促进线粒体凋亡途径可有效促进乳腺癌细胞凋亡,与本研究结论一致。
综上所述,顺式阿曲库铵可显著抑制乳腺癌MCF-7细胞的增殖、侵袭及迁移并促进其凋亡。其作用机制可能与抑制细胞EMT过程并促进细胞凋亡因子Bax及Caspase家族凋亡因子相关,且在低剂量时作用效果不显著,当剂量超过10 μmol/L时,效果显著。本研究未涉及体内实验,计划在后续实验中将乳腺癌MCF-7细胞注射至小鼠体内,在小鼠体内进行成瘤实验,进一步探讨顺式阿曲库铵在小鼠体内是否可以抑制乳腺癌细胞的增殖。
