NKG2D配体在 NK细胞杀伤三氧化二砷诱导的KG1a细胞中的作用①
2021-03-01王艳婕周彦生牛新清
王艳婕 曹 威 周彦生 杨 瑞 牛新清
(新乡医学院第二附属医院,新乡 453003)
化疗是治疗白血病的有效方法,但仍有许多白血病患者不能完全缓解或缓解后复发。白血病患者复发的主要原因是抗癌药物不能完全消除所有的白血病细胞。细胞在治疗期间或治疗后留在患者体内的情况被称为微小残留病变(minimal residual disease,MRD),这些细胞通常是白血病干细胞(leukemia stem cells,LSCs)。LSCs的细胞表面标记表型为CD34+/CD38-,与造血干细胞(hematopoietic stem cells,HSCs)具有相同的特性,且难以消除。许多研究证明LSCs在化疗诱导后对化疗药物的耐受性较正常的白血病细胞更强,因此更容易导致患者复发[1-2]。临床上高剂量阿糖胞苷、米托蒽酮、氯丙嗪、氟达拉滨等药物联合使用用于单纯复发治疗,这种再诱导减少了肿瘤的爆发,但不能长期维持[3]。现代细胞治疗已广泛应用在许多血液病恶性肿瘤中,特别是复发或难治性的血液病。供体淋巴细胞输注或二次造血干细胞移植是一种标准的再诱导后免疫治疗,但一直没有取得较好效果[4]。NK细胞是先天免疫应答的重要组成部分,能够杀伤肿瘤和病毒感染细胞,因此体外活化NK细胞输注已经成为一种有希望的骨髓治疗方法。
ATO作为砷剂的主要成分,是治疗急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的有效药物。大量文献证明,ATO是一个多靶点、多通路的抗肿瘤药物,其治疗白血病的机制与诱导细胞分化、凋亡有关,具有有效的抗肿瘤作用[5]。故本研究探讨联合低浓度的三氧化二砷(arsenic trioxide,ATO)与NK细胞,对急性髓系白血病KG1a细胞株细胞增殖的影响及可能的作用机制。
1 材料与方法
1.1材料 人类急性髓系白血病 KG1a 细胞株为本实验室留存细胞。ATO购自哈尔滨伊达药业有限公司。LDH杀伤活性检测试剂盒购自Promega公司。RPMI1640为Gibco公司产品。胎牛血清购自杭州四季青生物公司。抗 MICA/B单抗、抗ULBP1单抗、抗ULBP2单抗、抗ULBP3单抗购自R&D公司。甲基纤维素、XTT、硫酸酚嗪甲脂(PMS)为Sigma公司产品。淋巴细胞分离液为上海试剂二厂产品。
1.2方法
1.2.1细胞培养 KG1a 细胞培养于RPMI1640细胞培养液(含10%胎牛血清、1%青链霉素),37℃、5%CO2饱和湿度培养箱中培养。24 h细胞定期换液,取生长状态良好的生长对数期细胞进行实验。
1.2.2XTT检测不同浓度ATO 对KG1a细胞24 h、48 h的细胞生长抑制作用 选取生长状态良好的对数期KG1a细胞,调整细胞浓度5.0×104个/ml,96孔板每孔接种80 μl,加入不同终浓度为0、1.0、2.5、5.0、10.0、20.0、40.0 μmol/L的ATO,设3个复孔。细胞培养箱培养24、48 h后,每孔加入XTT(终浓度0.2 mg/ml)及PMS(终浓度25 μmol/ml)混合液20 μl,避光孵育2 h后,酶标仪双波长450 nm、630 nm检测OD值,每组吸光度取3孔均值,计算不同ATO浓度下的KG1a细胞生长抑制率。细胞生长抑制率=(OD对照组-OD加药组)/OD对照组×100%。
1.2.3LDH检测试剂盒检测定NK细胞对ATO作用前后KG1a细胞的杀伤作用 3组实验组分别检测NK细胞对ATO处理前、后KG1a细胞的杀伤作用以及NKG2D单克隆抗体预处理后的NK细胞对ATO处理后KG1a细胞的杀伤作用。实验前抽取健康志愿者外周血,在无菌条件下淋巴细胞分离液梯度密度离心法分离外周血单个核细胞,PBS洗涤后用免疫磁珠分选NK细胞[6]。NKG2D阻滞实验中将免疫磁珠分选出的NK细胞与抗NKG2D 抗体(10 μg/ml)37℃共孵育30 min,然后加入到靶细胞中。细胞杀伤实验按照LDH检测试剂盒操作说明进行实验,靶细胞分别是工作浓度为IC30的ATO 作用前后的KG1a细胞,效应细胞分别为NKG2D单克隆抗体预处理前后的NK细胞,3个实验组依次按照效靶比5∶1、10∶1、20∶1 加入 96 孔板,每组设3个复孔。37℃、5%CO2饱和湿度细胞培养箱培养4 h,容积纠正组及靶细胞最大裂解释放组均加入10 μl裂解液继续孵育,1 h后吸取上清转到另外一个96孔板,加显色混合液常温避光反应30 min,酶标仪检测波长490 nm的吸光度值。计算NK细胞杀伤率:NK细胞杀伤率(%)=(实验组OD平均值-靶细胞自然裂解释放组OD 平均值-效应细胞自然裂解释放组OD平均值)/(靶细胞最大裂解释放组OD平均值-靶细胞自然裂解释放组OD平均值)×100%。
1.2.4甲基纤维素集落形成实验检测不同实验组集落数量 实验设置单纯对照组和3组实验组。对照组为生长状态良好的KG1a细胞,实验组分别是:ATO作用24 h后的KG1a细胞组、NK细胞与ATO作用24 h后的KG1a细胞组、NKG2D单克隆抗体预处理后的NK细胞与ATO作用24 h后的KG1a细胞组。ATO作用KG1a细胞24 h后用PBS清洗细胞3次,按照效靶比20∶1于含有20%的胎牛血清、0.9 %的甲基纤维素的克隆体系中培养14 d,观察集落形成,计数集落数量。实验重复3次。
1.2.5流式细胞术检测ATO作用前后KG1a细胞表面NKG2D 配体表达 该实验分两组,实验组为生长状态良好的KG1a细胞,对照组为2.0 mol/L的ATO处理24 h后的KG1a细胞。收集细胞并调整细胞浓度为1×106个/ml,100 μl待标记细胞与ABMO-1、M295、M310 和M551 一抗4 ℃避光孵育30 min,PBS洗涤2遍后细胞重悬,加荧光素标记的山羊抗鼠IgG1二抗,4℃条件下孵育30 min,阴性对照为同型IgG1 抗体。流式细胞仪分析1×104个细胞中阳性细胞数量并计算其百分率。为减少误差,实验重复3次。

2 结果
2.1ATO对KG1a细胞生长抑制作用 分别用0、1.0、2.5、5.0、10.0、20.0、40.0 μmol/L浓度的ATO处理KG1a细胞24 h、48 h,结果显示ATO对KG1a 细胞具有明显的杀伤作用,其细胞生长抑制率在一定浓度范围内呈明显的时间浓度依赖性,差异有统计学意义(P<0.05)。根据SPSS23.0软件计算ATO抑制30%KG1a细胞24 h的浓度,即IC30值为2.0 μmol/L。选取该浓度作为与 NK细胞联合杀伤KG1a细胞的后续工作浓度。见图1。
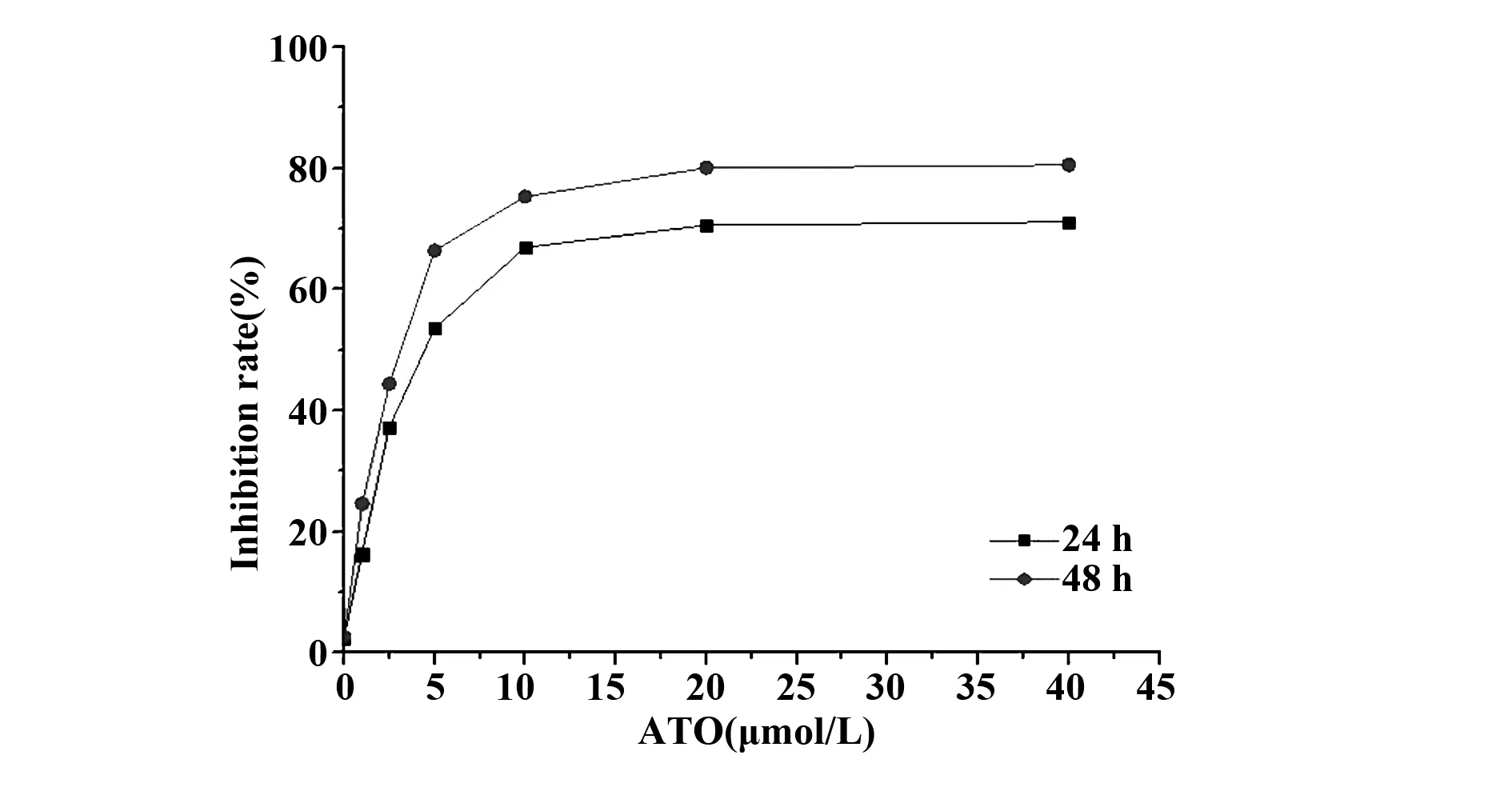
图1 ATO对KG1a 细胞增殖抑制作用
2.2NK细胞对ATO 作用前后KG1a细胞的杀伤率 效靶比分别为5∶1、10∶1、20∶1 时,单纯对照组,NK细胞对ATO 作用前的KG1a细胞的杀伤率分别为(1.74±0.91)%、(2.49±0.87)%、(7.05±2.41)%;实验组1,NKG2D单克隆抗体预处理后的NK细胞对工作浓度为2.0 μmol/L的ATO作用后的KG1a细胞的杀伤率分别为(1.86±0.94)%、(2.56±0.88)%、(7.19±2.54)%;实验组2,NK 细胞对2.0 μmol/L的ATO作用后的KG1a细胞的杀伤率分别为(4.95±0.65)%、(7.32±1.12)%、(19.87±1.87)%。结果显示,NK 细胞对 ATO 作用前后的KG1a 细胞杀伤率之间的差异具有显著统计学意义(P<0.05),NKG2D单克隆抗体预处理前后的NK 细胞对ATO作用后的KG1a 细胞杀伤率之间的差异有显著统计学意义(P<0.05)。这提示NK细胞对ATO作用后的KG1a 细胞杀伤作用明显,且与NKG2D配体表达密切相关。见图2。
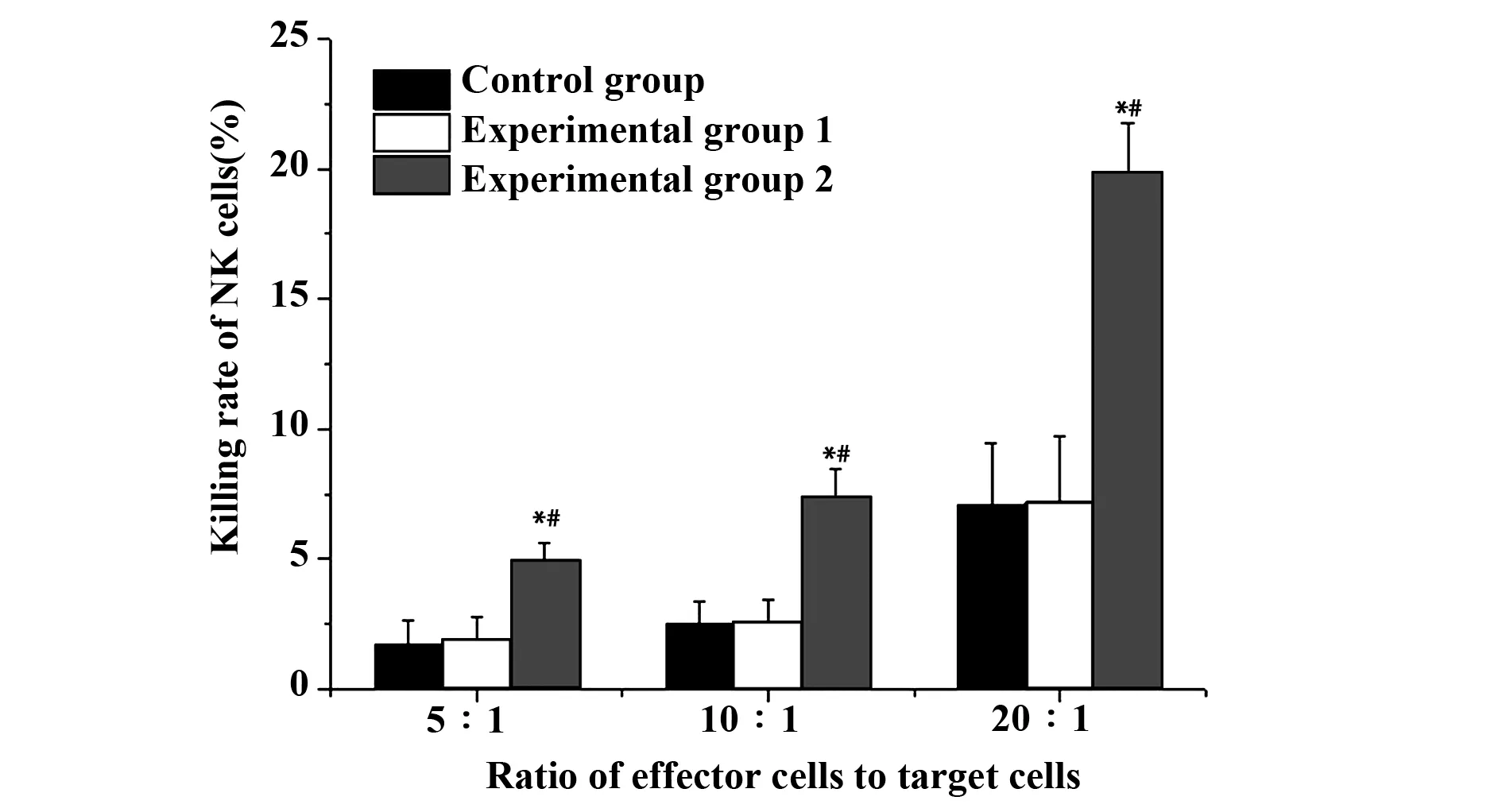
图2 NK细胞对ATO作用前后KG1a细胞的杀伤敏感性
2.3ATO单用及联合NKG2D单克隆抗体预处理前后NK细胞对KG1a细胞集落形成的影响 不同处理组于甲基纤维素集落系中培养KG1a细胞14 d后用倒置显微镜观察细胞集落形成。结果显示,组1:对照组KG1a集落数174.3±8.6,组2:ATO 处理组集落数为112.5±5.1,组3:ATO处理24 h后与NK细胞联用组集落数48.6±7.2,组4:ATO处理24 h后与NKG2D单克隆抗体预处理后NK细胞联用组集落数为108.5±4.9。组间两两比较,组1与组2、组2与组3、组3与组4组间集落数差异有统计学意义(P<0.05)。见图3。
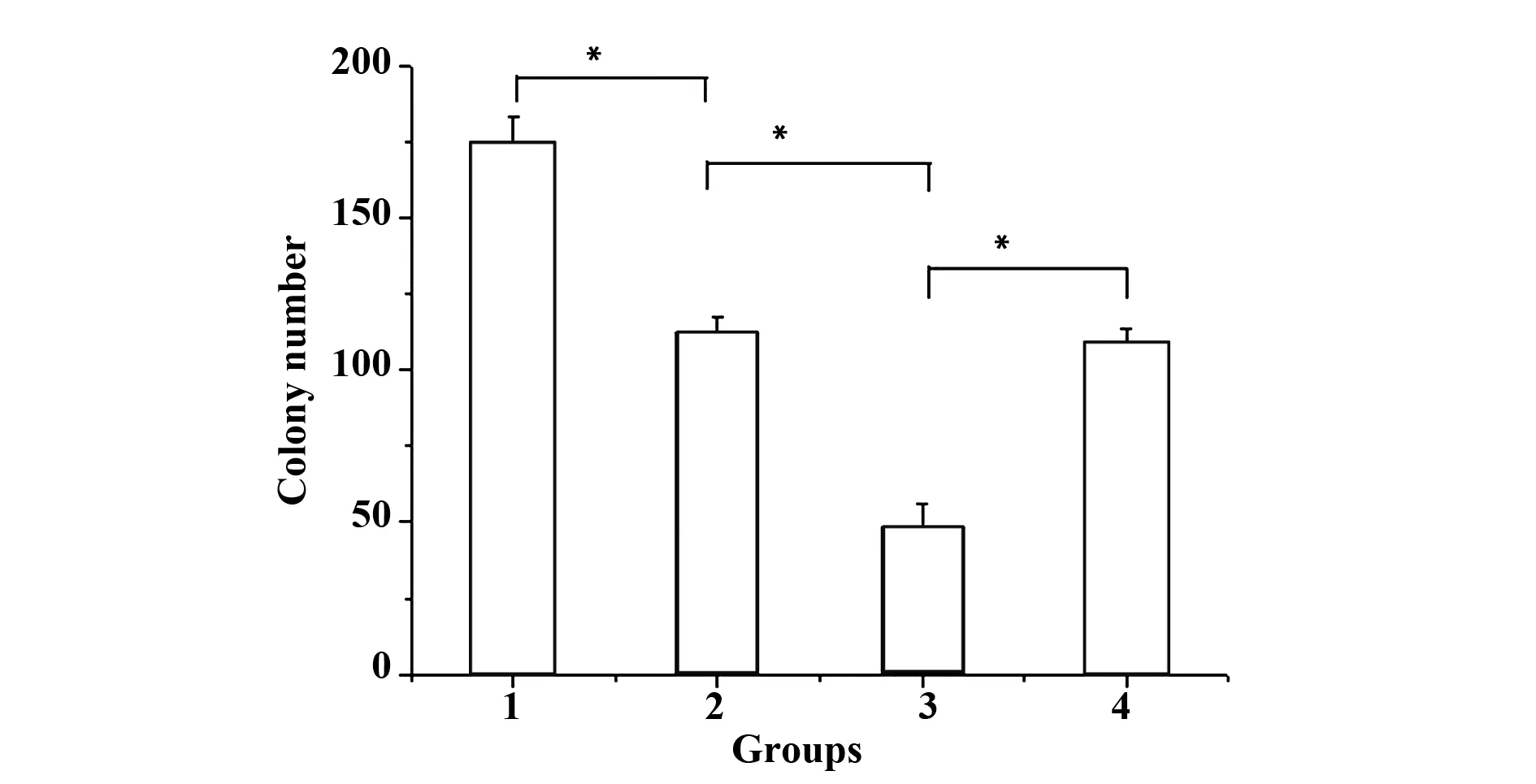
图3 组间集落数比较
2.4ATO作用前后对KG1a细胞 NKG2D 配体表达的作用 单纯对照组与实验组(2.0 μmol/L的LATO处理KG1a细胞24 h后)KG1a细胞表面NKG2D 配体MICA/B、ULBP2、ULBP的表达未见明显改变;而实验组ATO处理KG1a细胞24 h后KG1a细胞表面NKG2D 配体ULBP1 表达增高,且差异有统计学意义(P<0.05)。见表1,图4、5。
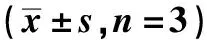
表1 ATO作用KG1a细胞24 h前后KG1a细胞NKG2D配体表达率
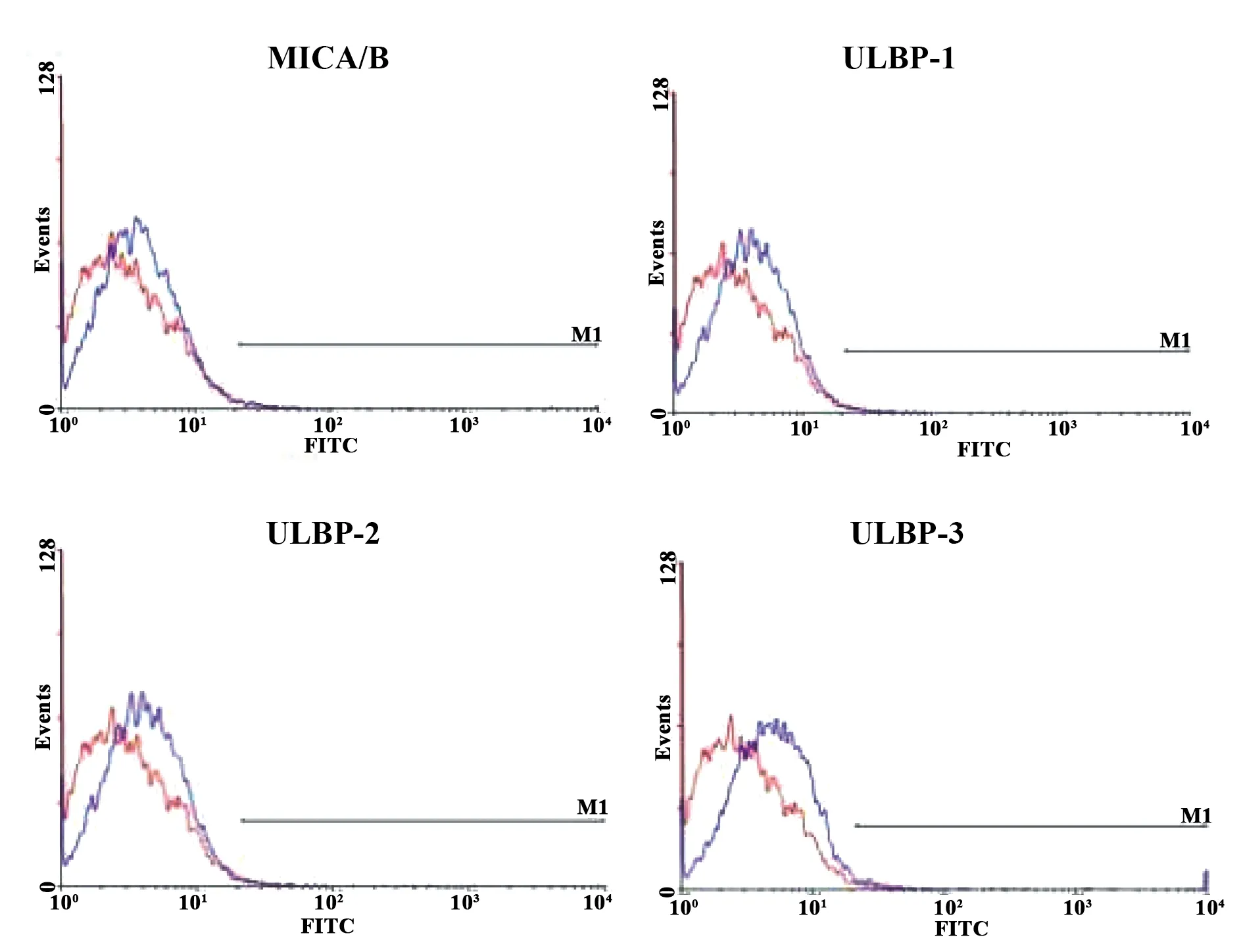
图4 ATO作用前KG1a细胞的MICA/B、ULBPI-3表达
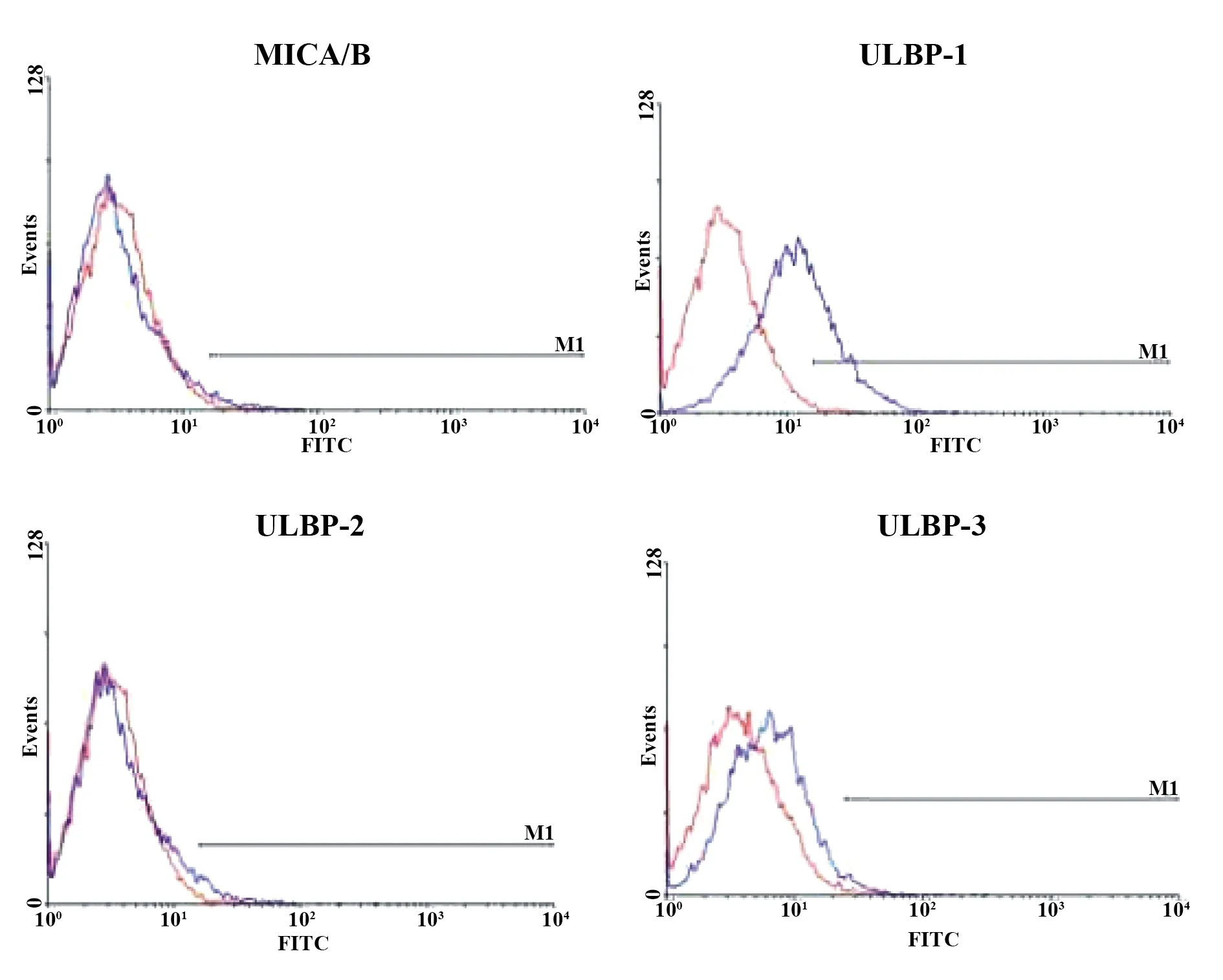
图5 ATO作用24 h后KG1a细胞的MICA/B、ULBPI-3表达
3 讨论
目前,白血病主要的治疗方法包括化疗、放疗、细胞免疫治疗以及这些方法的结合。传统中药及其成分也显示出较强的抗肿瘤作用。如果能更广泛地探索这些药物在癌症治疗中的作用机制,其将有可能用于临床靶向治疗。因此,探索其分子机制对化疗治疗具有极其重要的意义。
NK细胞作为先天免疫应答的一部分,可以通过一系列受体来识别和杀伤病理细胞。这些受体可分为活化受体和抑制受体两大类。其中活化受体主要包括C型凝集素受体(NKG2D/E/F)、天然细胞毒性受体(NKp46、NKp30和NKp44)和活化杀伤细胞免疫球蛋白样受体(KIRs-aKIRs);抑制受体主要包括抑制杀伤细胞免疫球蛋白样受体(KIRS-ikKIRs)和C型凝集素受体(如NKG2A/B)[7-9]。这些受体之间的良好平衡对调节NK细胞功能至关重要,抑制受体通过SHP-1和SHP-2磷酸酶使得激活性受体(DAP10、DAP12)去磷酸化,进而直接抑制受体的激活[10-11]。报道显示KG1a细胞主要为具有LSCs特性的CD34+/CD38-细胞,LSC的数量超过50%,本课题组先前的研究也表明KG1a细胞具有LSCs的特征,包括分化、增殖和自我更新[12]。NKG2DLs(MICA/B、ULBP2、ULBP3)的表达缺失可能是一种普遍的LSC标志物,利用这种功能特性逃避NK细胞免疫监视的能力[13-15]。
本研究结果表明ATO对 KG1a 细胞的增殖抑制作用与时间浓度呈正相关,考虑到临床用药的可能性,选择ATO作用浓度IC30用于后续的实验。结果发现,联合低浓度的ATO 与NK细胞能有效抑制 KG1a 细胞的增殖,降低KG1a 细胞的集落形成能力,且效果好于单用ATO组和ATO联合NKG2D单克隆抗体预处理NK细胞组。这证明ATO可提高NK细胞杀伤KG1a细胞的能力,且与KG1a细胞表面NKG2D配体表达密切相关。我们接下来检测ATO对 KG1a 细胞作用前后细胞表面NKG2D配体表达的变化,流式细胞检测发现KG1a细胞表面NKG2D 配体MICA/B、ULBP2、ULBP3的平均荧光强度(MFI)在ATO作用前后未见明显改变,而ULBP1 表达在ATO处理后明显增高(P<0.05)。综上所述,NK细胞对ATO处理后的KG1a细胞具有明显杀伤作用,联合ATO降低了 KG1a 细胞集落形成能力。这与低浓度的ATO诱导KG1a细胞表面NKG2D配体ULBP1的表达密切相关,深层次的机制仍需进一步研究探讨。
