用锰冶金铁铝废渣从模拟废水中吸附铅离子试验研究
2021-03-01张钰珏苏仕军孙维义丁桑岚
张钰珏,朱 鹏,苏仕军,孙维义,丁桑岚
(四川大学 建筑与环境学院,四川 成都 610065)
铅是强毒性重金属之一,对人类及环境都有严重危害。吸附法处理含铅废水行之有效。铁铝复合氧化物对含金属离子[1-2]、有机染料[3]、磷酸盐[4]、氟化物[5]等的废水具有良好的去污处理能力,是一种性能优异的吸附剂。常见的铁铝复合氧化物吸附材料通常由商品级铁盐和铝盐经过共沉淀—焙烧方式得到[6],制备成本较高。
软锰矿烟气脱硫浸出液中含有大量Fe3+、Al3+杂质,为了得到高质量锰产品,需要在浸出液中加入碱性物质调pH,使Fe3+和Al3+转化为氢氧化铁和氢氧化铝沉淀并从浸出液中分离[7-8],得到铁铝废渣,对铁铝废渣进行焙烧可得铁铝复合氧化物吸附剂[9]。试验采用此法制备铁铝复合氧化物吸附剂,并考察了其从溶液中吸附铅离子的特性,探讨了吸附过程动力学和热力学,以期为大量铁铝废渣的资源化及含铅废水的综合治理提供可供选择的方法。
1 试验部分
1.1 铁铝复合氧化物吸附剂的制备
先用过氧化氢溶液将软锰矿烟气脱硫浸出液中的Fe2+全部氧化成Fe3+;再将硫酸铁或硫酸铝溶液加入到浸出液中,以保证其中Fe3+、Al3+物质的量比为1∶1;再加入氨水使Fe3+、Al3+以氢氧化物形式完全沉淀;离心并洗涤沉淀物,洗涤液呈中性且无锰离子和硫酸根离子后停止洗涤,继续离心;对离心后沉淀物进行干燥、研磨至过200目筛,并在500 ℃下有氧焙烧5 h,得铁铝复合氧化物。
1.2 试验材料
过氧化氢、硝酸钠、硝酸铅、一水合氨、二甲酚橙、氢氧化钠、硝酸、冰乙酸、无水乙酸钠,均为分析纯试剂。
硝酸铅溶液:室温下,用硝酸铅和去离子水在1 L容量瓶中配制,初始浓度1 mol/L。
吸附试验以480 min为一批次,每次所用模拟含铅废水均利用硝酸铅溶液稀释配制。
1.3 试验仪器与设备
JJ-1型精密增力电动搅拌器,DK-98-ⅡA型电热恒温水浴锅,101-2AB型电热鼓风干燥箱,TDL-60B型低速台式离心机,pHs-3C型雷磁pH计,SX-G12123型马弗炉。
1.4 试验方法
将不同质量吸附剂投入到200 mL模拟含铅废水(初始Pb2+质量浓度不同)的锥形瓶中,调废水pH并将锥形瓶置于不同温度下的恒温水浴锅中,每隔一段时间取溶液分析其中Pb2+浓度直至反应平衡,得出最佳条件下Pb2+去除率及吸附量。采用Langmuir、Freundlich等温吸附模型及伪一级、伪二级、颗粒内扩散动力学模型对所得数据进行拟合,并通过计算吉布斯自由能及反应焓变,考察铁铝复合氧化物对Pb2+的吸附性能及作用机制。
Pb2+去除率及平衡吸附量计算公式如下:
(1)
(2)
式中:ρ0—模拟废水初始Pb2+质量浓度,mg/L;ρe—Pb2+平衡质量浓度,mg/L;η—Pb2+去除率,%;V—模拟废水体积,mL;m—吸附剂质量,g;qe—Pb2+平衡吸附量,mg/g。
2 试验结果与讨论
2.1 铁铝复合氧化物吸附剂对Pb2+的吸附
2.1.1 吸附剂用量对吸附的影响
在初始Pb2+质量浓度200 mg/L、废水体积200 mL、反应温度(30±1) ℃、反应时间2~480 min 条件下,铁铝复合氧化物吸附剂用量对吸附去除Pb2+的影响试验结果如图1所示。
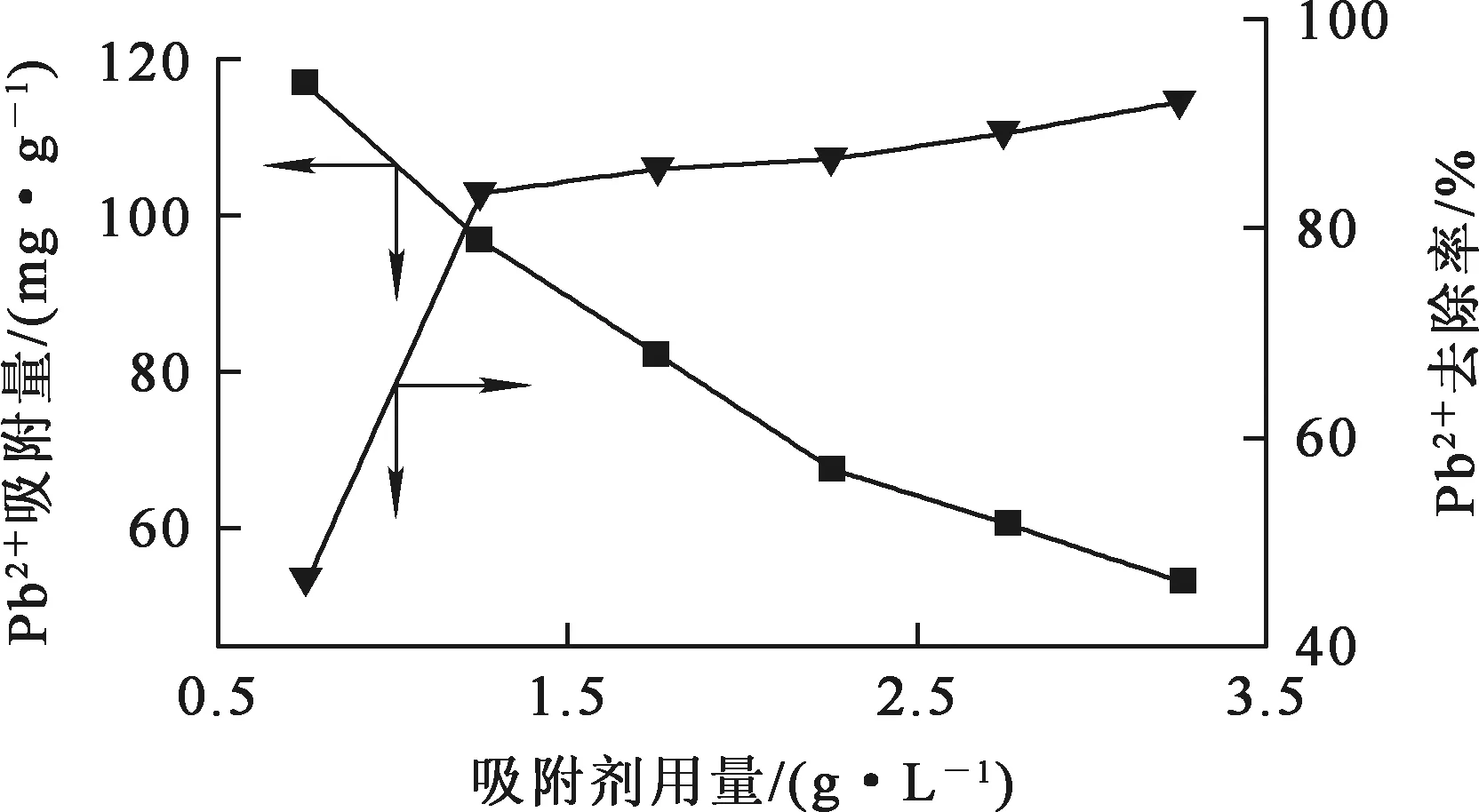
图1 吸附剂用量对吸附去除Pb2+的影响
由图1看出:随吸附剂用量增大,Pb2+去除率提高,但吸附剂对Pb2+吸附量下降;吸附剂用量增至1.25 g/L时,Pb2+去除率提高到83.53%;继续增大吸附剂用量,Pb2+去除率变化不大;吸附剂用量增至3.25 g/L时,Pb2+吸附量降至53.27 mg/g 。随吸附剂用量增大,反应活性位点数增加,这使其在吸附反应初期可以快速吸附Pb2+[10];但吸附剂用量过大,会使颗粒之间形成竞争吸附,表面活性点位不能充分利用[11]。综合考虑,确定吸附剂最佳用量为1.25 g/L。
2.1.2 模拟废水pH对吸附的影响
在初始Pb2+质量浓度200 mg/L、废水体积200 mL、反应温度(30±1) ℃、吸附剂用量1.25 g/L、 反应时间2~480 min条件下,用0.1 mol/L 硝酸或氢氧化钠溶液调节废水pH,废水pH对铁铝复合氧化物吸附剂吸附去除Pb2+的影响试验结果如图2所示。
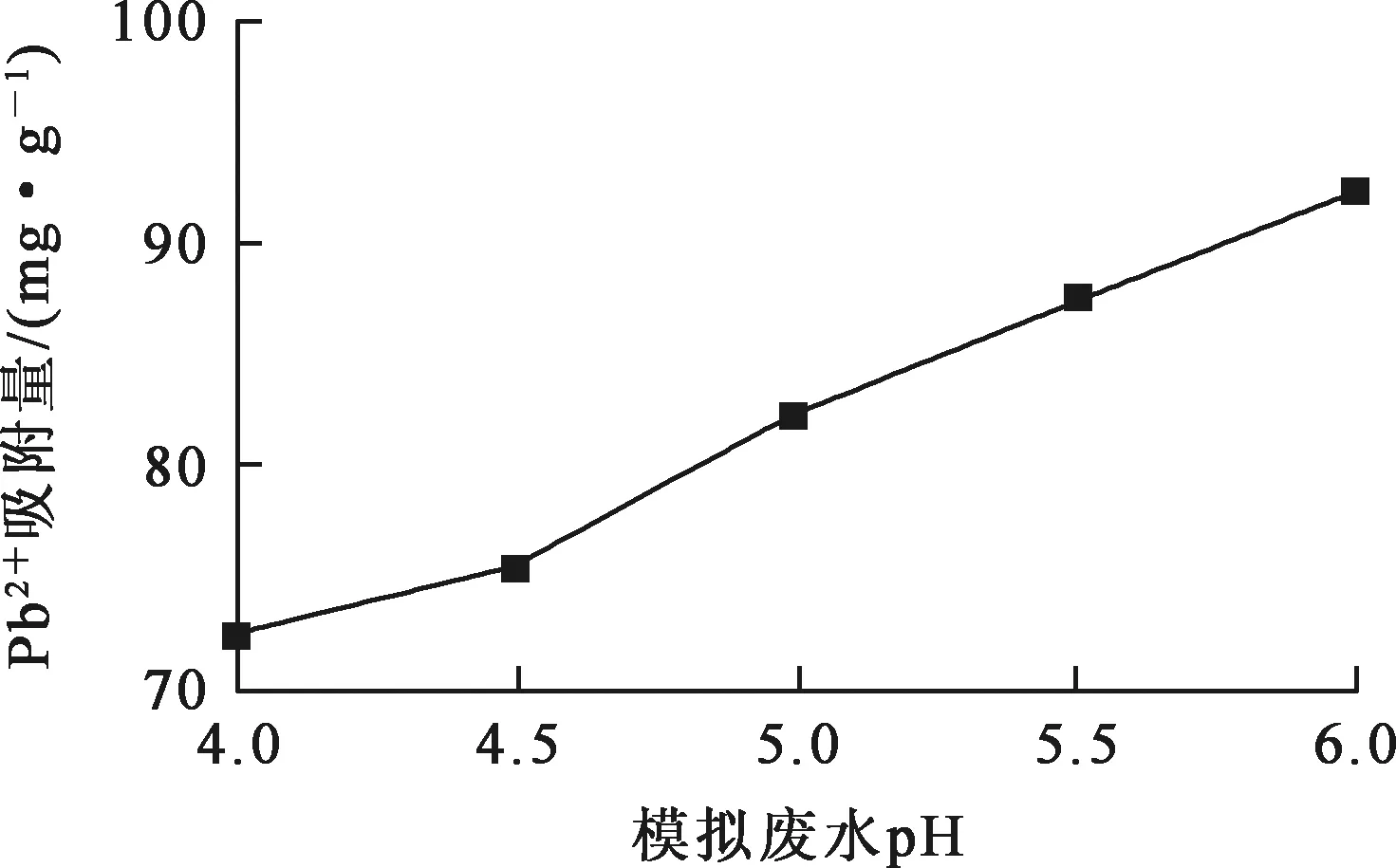
图2 模拟废水pH对Pb2+吸附量的影响
由图2看出:铁铝复合氧化物吸附剂对Pb2+吸附能力随废水pH升高而增大;溶液pH=5.0时,Pb2+吸附量为82.29 mg/g。低pH条件下,吸附剂表面羟基的质子化通过静电斥力阻止了金属阳离子接近吸附中心[12];随pH升高,H+与Pb2+竞争吸附减少,吸附剂与Pb2+之间的静电引力增强,吸附能力增强。同时,考虑到Pb2+的水解问题,确定溶液pH以控制在5.0较为适宜[13]。
2.1.3 反应温度对吸附的影响
在废水pH=5.0、吸附剂用量1.25 g/L、初始Pb2+质量浓度200 mg/L、废水体积200 mL、反应时间2~480 min条件下,反应温度对铁铝复合氧化物吸附剂吸附去除Pb2+的影响试验结果如图3所示。可以看出:随反应温度升高,吸附剂对Pb2+吸附量升高;反应温度为60 ℃时,Pb2+吸附量提高到126.92 mg/g。温度升高加快了分子间的布朗运动,有利于增加Pb2+与吸附剂颗粒的有效碰撞概率,从而加快反应速率;该吸附反应为吸热反应,温度升高有利于反应进行,从而提高污染物去除率[14]。
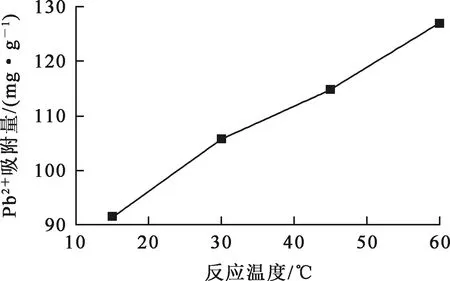
图3 反应温度对Pb2+吸附量的影响
2.1.4 初始Pb2+质量浓度对吸附的影响
在废水pH=5.0、吸附剂用量1.25 g/L、废水体积200 mL、反应温度(60±1) ℃、反应时间2~480 min条件下,铁铝复合氧化物中初始Pb2+质量浓度对吸附去除Pb2+的影响试验结果如图4所示。可以看出:随初始Pb2+质量浓度升高,吸附剂对Pb2+吸附量提高,但对Pb2+去除率下降;当初始Pb2+质量浓度达240 mg/L以上时,吸附趋于平衡。吸附剂质量一定时,总的活性位点不变,Pb2+质量浓度升高会使活性位点相对减少并逐渐被占据,颗粒内扩散受阻,从而导致Pb2+去除率下降[14]。
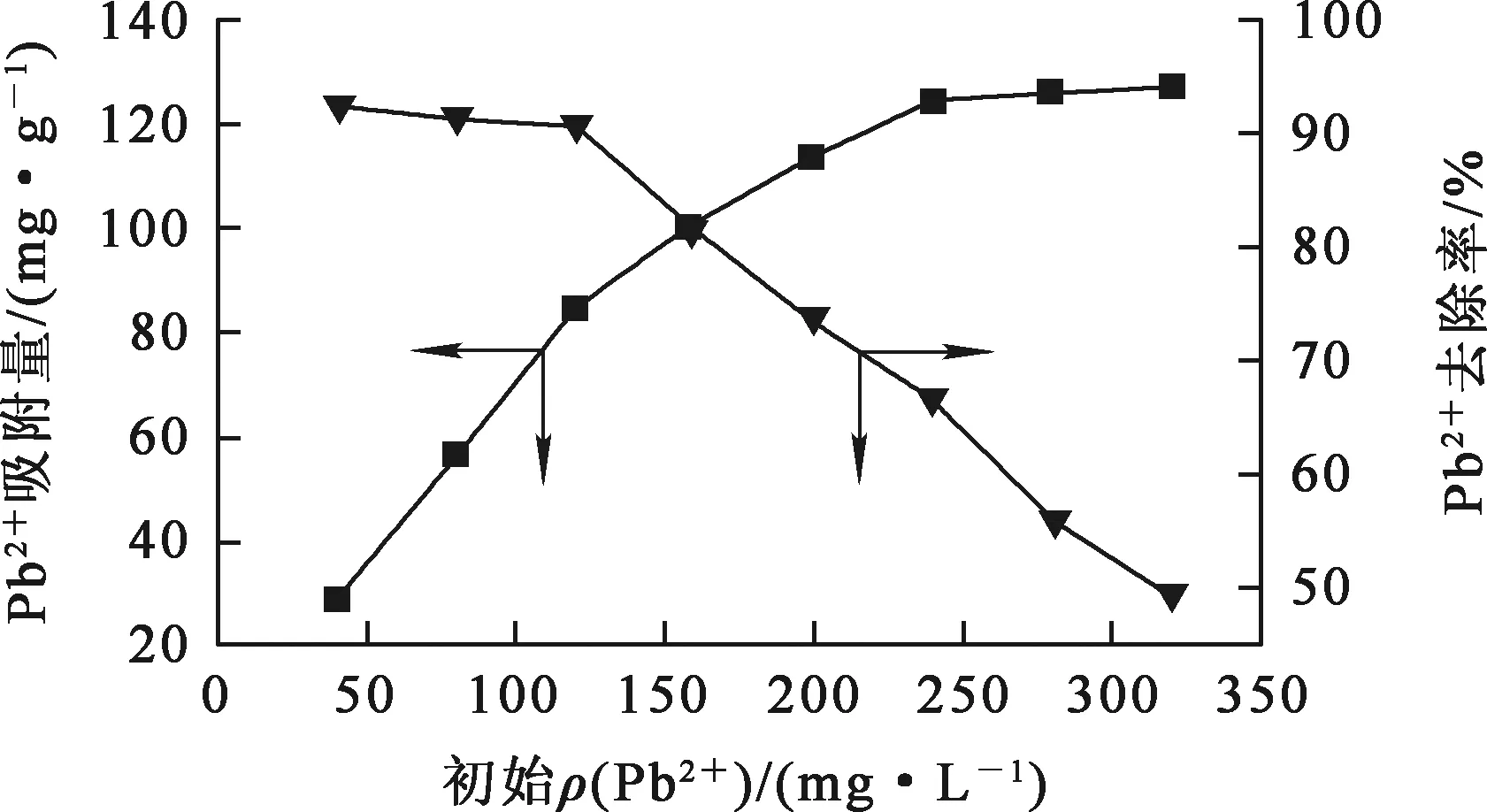
图4 初始Pb2+质量浓度对吸附去除Pb2+的影响
2.2 吸附反应热力学
2.2.1 吸附等温线
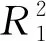

图5 Langmuir(a)和Freundlich(b)吸附等温模型拟合曲线
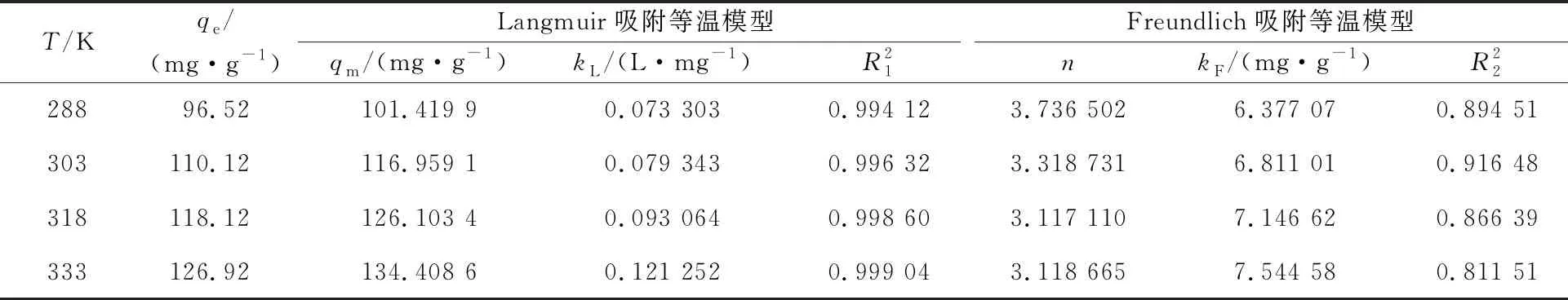
表1 Langmuir和Freundlich吸附等温模型拟合参数
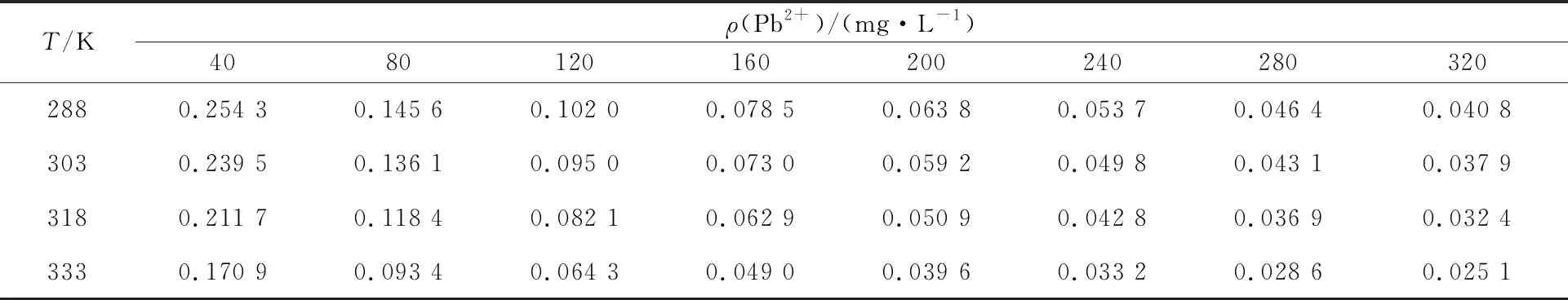
表2 不同Pb2+初始质量浓度下的RL
2.2.2 吸附热力学
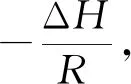
(1)
ΔG=ΔH-TΔS。
(2)
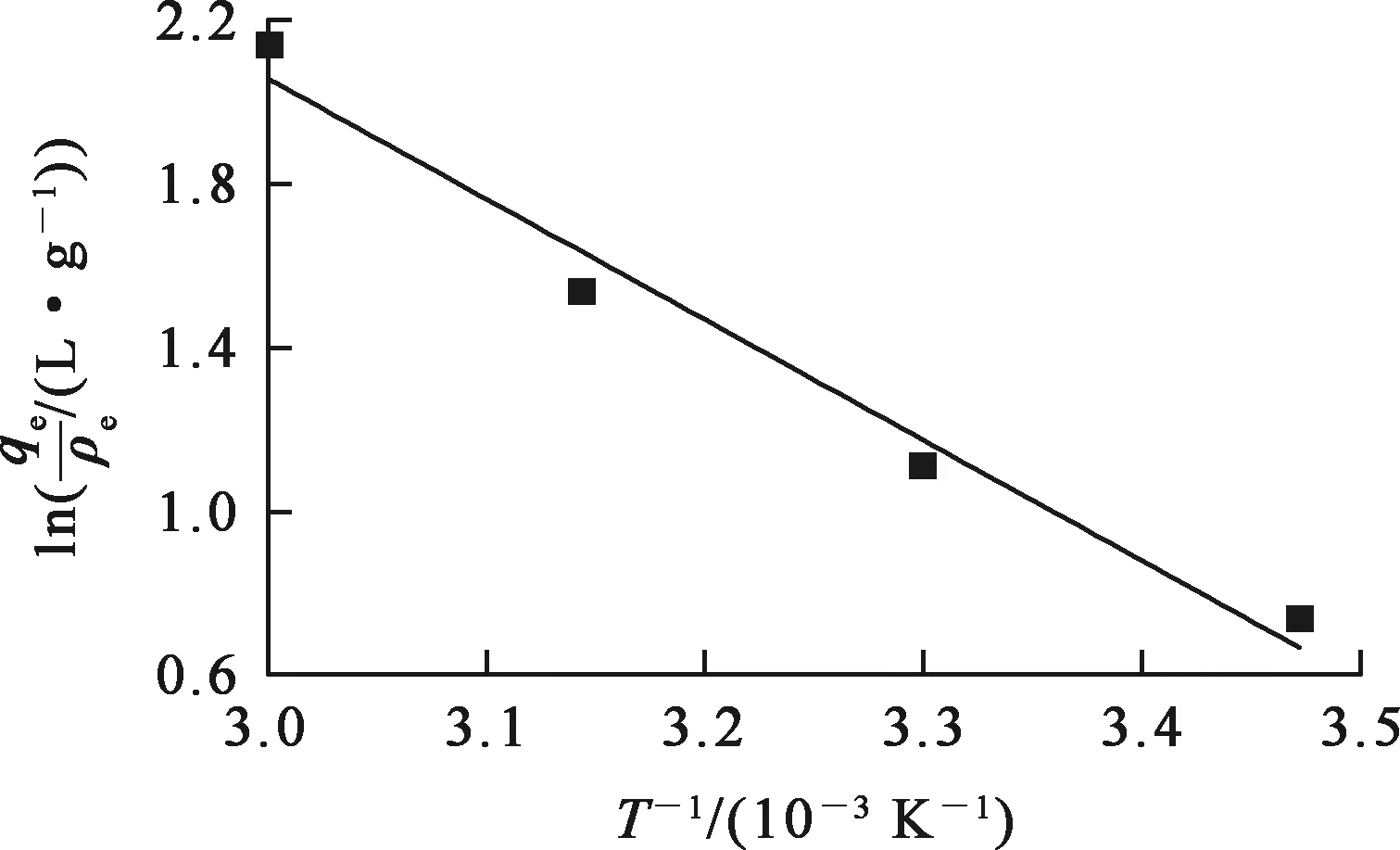
图6 吸附热力学拟合曲线

表3 铁铝复合氧化物在不同温度下吸附Pb2+的热力学参数
由表3看出:ΔH>0,表明吸附反应吸热;ΔG<0,表明吸附反应可自发进行,有很好的吸附效果;ΔS>0,表明吸附剂结构在吸附前后发生了改变[15]。
2.3 吸附反应动力学
分别对Pb2+质量浓度为200、240 mg/L的模拟废水在不同温度下进行吸附试验,并采用伪一级、伪二级和颗粒内扩散动力学模型对试验数据进行线性拟合,结果如表4和图7所示。
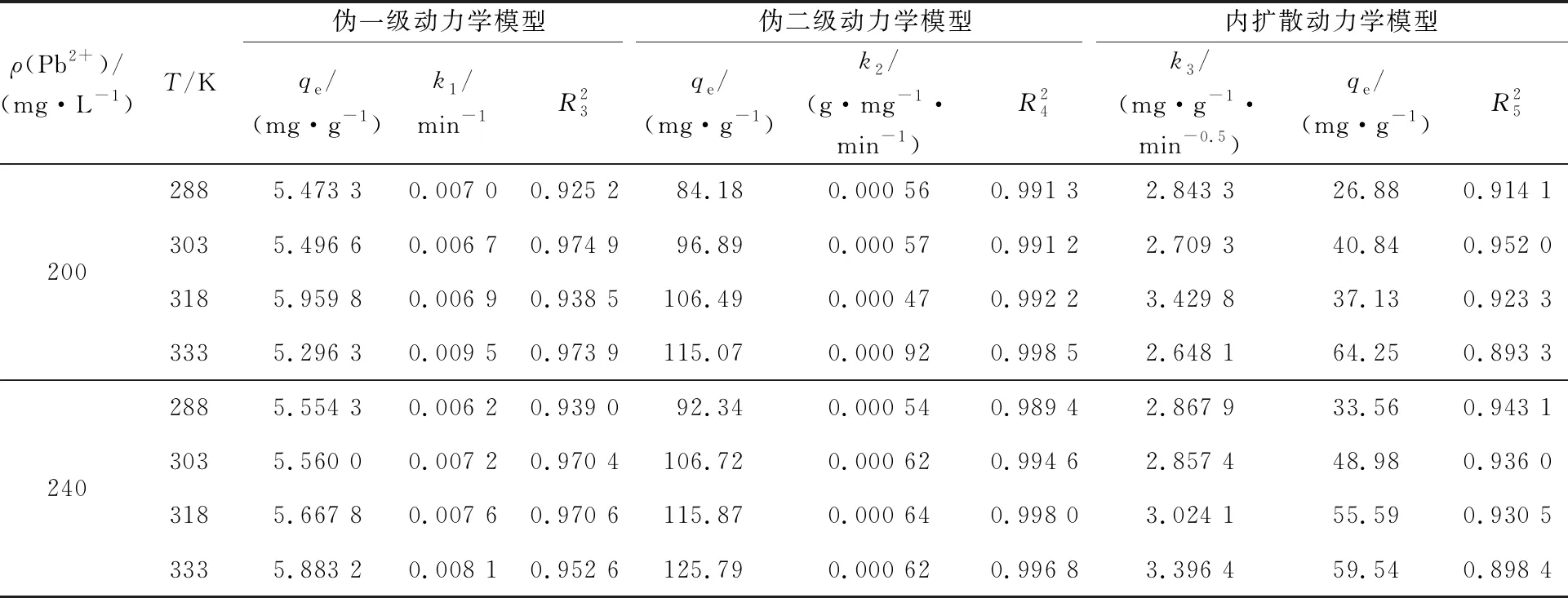
表4 铁铝复合氧化物吸附Pb2+的动力学模型拟合参数
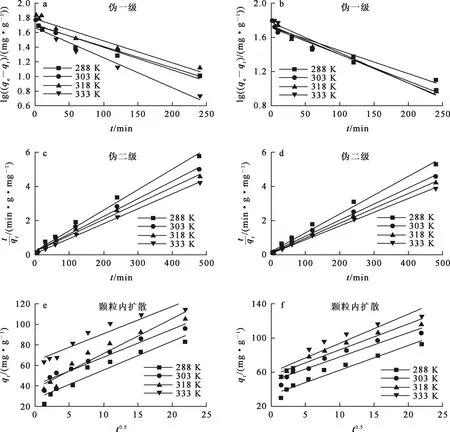
a、c、e—ρ(Pb2+)=200 mg/L; b、d、f—ρ(Pb2+)=240 mg/L。图7 不同ρ(Pb2+)条件下的3个动力学模型拟合曲线
3 结论
由软锰矿浸出液制备铁铝复合氧化物并用于吸附去除废水中的Pb2+是可行的;对于pH=5.0的含铅废水,用此吸附剂吸附去除Pb2+,适宜条件下,吸附量可达126.92 mg/g,吸附效果较好;吸附过程符合Langmuir等温吸附模型,属于单分子层吸附,反应过程中吸热,一定温度下吸附反应自发进行。吸附过程遵循伪二级动力学模型,主要速率控制因素为化学吸附。
