黄杆菌褐藻胶裂解酶的高效表达及其在褐藻寡糖制备中的应用
2021-03-01杨绍青闫巧娟江正强
江 君,刘 军,杨绍青,马 帅,闫巧娟,江正强,*
(1.中国农业大学食品科学与营养工程学院,中国轻工业食品生物工程重点实验室,北京 100083;2.中国农业大学工学院,北京 100083)
褐藻胶裂解酶作为一种多糖裂解酶(polysaccharide lyase,PL),可通过β-消去机理以内切或外切方式将褐藻酸钠裂解为非还原端带双键的不饱和糖醛酸寡糖和不饱和糖醛酸单糖。根据褐藻胶裂解酶底物特异性差异可分为3 种类型:聚甘露糖醛酸(polyM)特异性裂解酶(EC 4.2.2.3)、聚古罗糖醛酸(polyG)特异性裂解酶(EC 4.2.2.11)和双功能裂解酶(EC 4.2.2.-)[1]。根据序列相似性,褐藻胶裂解酶可划分为7 个PL家族,即PL-5、-6、-7、-14、-15、-17和-18家族[2]。目前已从海洋和陆地细菌、海洋软体动物和藻类中发掘多种褐藻胶裂解酶,但野生型褐藻胶裂解酶活力及产量一般较低,限制了其工业化应用。采用基因工程菌表达重组酶可提高酶活力和产量,海洋细菌Thalassotalea crassostreae来源的外切型褐藻胶裂解酶基因(TcAlg1)已成功在大肠杆菌BL21(DE3)表达[3]。Flavobacteriumsp.strain UMI-01来源褐藻胶裂解酶基因(FlAlyA)在大肠杆菌中表达,重组褐藻胶裂解酶(rFlAlyA)较野生型提高了近8 倍[4]。经毕赤酵母表达后高密度发酵,Flavobacteriumsp.H63褐藻胶裂解酶sagl(rSAGL)酶活力可达226.4 µg/mL(915.5 U/mL)[5]。枯草芽孢杆菌(Bacillus subtilis)是公认安全(generally recognized as safe,GRAS)级菌株,其具有非致病性、高分泌、易于培养和易放大等优点[6],目前利用枯草芽孢杆菌表达褐藻胶裂解酶报道较少,并且Flavobacteriumsp.strain A1来源褐藻胶裂解酶A1-III在枯草芽孢杆菌中的表达水平低(0.3 mg/mL)[7]。因此,利用枯草芽孢杆菌作为表达系统提高重组褐藻胶裂解酶活力及产量有待进一步深入研究。
褐藻胶是由β-D-甘露糖醛酸(β-D-mannuronic acid,M)和α-L-古罗糖醛酸(α-L-guluronic acid,G)通过1,4-糖苷键聚合而成的酸性多糖。根据单糖组成的不同,可分为聚甘露糖醛酸(polyM)、聚古罗糖醛酸(polyG)和混合型(polyMG)褐藻胶3 种类型[8]。作为褐藻中含量最丰富的碳水化合物,褐藻胶占褐藻干质量的10%~45%[9]。褐藻胶在食品和制药行业中广泛用作增稠剂和胶凝剂[10],并具有修复受损皮肤[11]以及酶和细胞的固定[12]等功能特性。研究发现由褐藻胶降解所得褐藻寡糖具有抗氧化[13]、抑菌[14]、抗癌和免疫调节[15]等多种生理活性。化学与物理方法降解褐藻胶生产褐藻寡糖存在反应条件剧烈、产物难以控制、能耗大、污染环境等缺点。酶法生产褐藻寡糖具有产物得率高、特异性强以及反应条件温和等优点且已成为研究热点[16]。利用褐藻胶裂解酶Cel32酶解褐藻酸钠可生产二糖、三糖等低聚合度(degree of polymerization,DP)的褐藻寡糖[17]。Bacillussp.Alg07褐藻胶裂解酶AlgA可在40 ℃下酶解褐藻酸钠生产甘露糖醛酸二糖、三糖、四糖及古罗糖醛酸片段[18];通过褐藻胶裂解酶TcAlg1酶解褐藻酸钠可生产4-脱氧-L-赤型-5-己糖醛酸(4-deoxy-L-erythro-5-hexoseulose uronate,DEH)和低分子质量古罗糖醛酸片段[3]。
黄杆菌FlAlyA(基因号AB898059)经大肠杆菌[4]重组表达后酶活力为168 U/mL,蛋白质质量浓度为0.176 mg/mL;经短小芽孢杆菌[19]重组表达后比酶活力几乎不变,表达量相比大肠杆菌表达高出约7.1 倍,但仍无法满足工业化生产褐藻寡糖需求。基于以上研究进展,本研究将rFlAlyA在枯草芽孢杆菌中进行表达,通过高密度发酵实现rFlAlyA的高效生产,采用电喷雾电离-质谱(electrospray ionization ion trap-mass spectrometry,ESI-MS)分析rFlAlyA降解褐藻酸钠的褐藻寡糖组成,离子色谱分析相对含量。研究结果将为褐藻胶裂解酶的高效生产及制备褐藻寡糖提供依据。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌WB600和质粒pWB980均由广西大学韦宇拓课题组惠赠;细菌基因组提取试剂盒、琼脂糖凝胶纯化回收试剂盒和质粒提取试剂盒、TransStart FastpfuDNA polymerase 北京全式金生物技术有限公司;ExTaqDNA Polymerase、低分子质量蛋白质标准、DNA Marker 安诺伦(北京)生物科技有限公司;Phusion DNA polymerase 美国NEB公司;强阳离子交换层析柱料SP 美国GE Healthcare公司;卡那霉素 美国Inalco公司;Kieselgel 60硅胶板 德国Merck公司;甘露糖醛酸寡糖(DP:1~6) 青岛博智汇力生物技术有限公司;其他试剂如无特殊说明均为分析纯。
LB液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L;LB固体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂20 g/L;发酵培养基:葡萄糖10 g/L,蛋白胨20 g/L,酵母粉10 g/L,KH2PO40.3 g/L,Na2HPO46 g/L,MgSO40.3 g/L;流加补料培养基:葡萄糖500 g/L,蛋白胨75 g/L,培养基中葡萄糖和蛋白胨分开灭菌,冷却至室温后混匀;SpII+乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA):SpII 200 mL,EGTA溶液(0.1 mol/L,pH 8.0)4 mL;SpII:T-base 200 mL,500 mg/mL葡萄糖溶液2 mL,12 mg/mL MgSO4g 3H2O溶液14 mL,10%酵母提取物2 mL,10 mg/mL酪蛋白氨基酸溶液2 mL,0.1 mol/L CaCl2溶液1 mL;T-base:(NH4)2SO42 g/L,K2HPO4g 3H2O 18.3 g/L,KH2PO46 g/L,柠檬酸三钠1 g/L。
1.2 仪器与设备
紫外-可见分光光度计 北京普析通用仪器设备有限责任公司;Power Pac BasicTM型电泳仪、MyCycler聚合酶链式反应(polymerase chain reaction,PCR)自动扩增仪 美国Bio-Rad公司;5 L发酵罐 上海国强生化工程有限公司;HZQ-X100恒温双层振荡培养箱 江苏太仓实验设备厂;CBIO-GelPro凝胶成像分析系统北京赛百奥科技有限公司;JY92-II超声波细胞粉碎机宁波新芝生物科技股份有限公司;GL-20B高速冷冻离心机 上海安亭科学仪器厂;PB21型pH计 德国赛多利斯公司;ÄKTA蛋白纯化系统 美国GE Healthcare公司;ICS-5000+高效离子交换色谱(安倍脉冲检测器)、CarboaPacTMPA1阴离子交换柱 美国Thermo公司。
1.3 方法
1.3.1rFlAlyA在枯草芽孢杆菌中的表达
褐藻胶裂解酶基因rFlAlyA由上海生工(北京)生物工程有限公司合成,参考You Chun等[20]方法构建枯草芽孢杆菌重组表达载体。设计2 对引物(rFlAlyA-IF、rFlAlyA-IR和pWB-VF、pWB-VR),采用NEB Phusion DNA polymerase PCR扩增目的基因和表达载体。PCR程序为:98 ℃变性30 s,98 ℃退火10 s,72 ℃延伸90 s;30 个循环;72 ℃延伸10 min。
通过prolonged overlap extension-PCR(POE-PCR)扩增多聚体质粒。PCR体系组成包括:dNTPs 0.2 mmol/L,插入片段2 ng/μL,载体和插入片段物质的量比为1∶1;0.04 U/μL NEB Phusion DNA polymerase。PCR条件为:98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火20 s,72 ℃延伸60 s,29 个循环;72 ℃延伸10 min。
参考Zhang Xiaozhou等[21]的方法将多聚体质粒直接转入枯草芽孢杆菌感受态。将保存于-80 ℃条件下的枯草芽孢杆菌WB600感受态细胞取出,37 ℃水浴解冻;取上述多聚体质粒5~10 μL加入500 μL枯草芽孢杆菌感受态细胞中,加入等体积的SpII+EGTA,37 ℃孵育1.5 h,涂布于含20 μg/mL卡那霉素的平板,37 ℃倒置培养。挑取单菌落接种于20 mL LB液体培养基中37 ℃进行培养,每6 h取样,6 000 r/min离心5 min,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定上清液中褐藻胶裂解酶活力,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析目的基因表达情况。
1.3.2 高密度发酵
挑取单菌落接种于20 mL LB培养基,37 ℃、200 r/min培养过夜;以1%接种量转接至100 mL LB培养基培养10~11 h得种子液,此时培养基内的枯草芽孢杆菌处于对数生长期。5 L发酵罐中加入2 L发酵培养基,按照接种量5%进行接种发酵,发酵条件为:37 ℃,通气量1.5 m3/(m3g min),搅拌转速600 r/min,28%氨水调节pH值至7.0。待碳源消耗殆尽时,采用DO-stat策略,维持发酵罐中葡萄糖质量浓度低于2 g/L,当溶氧高于限定值(40%~45%)时开始流加补料,速率为100~120 s/次。每6 h取样,测定菌体密度(OD600nm)、褐藻胶裂解酶活力(DNS法)、蛋白含量(Lowry法),采用SDS-PAGE分析褐藻胶裂解酶表达情况。
1.3.3 rFlAlyA酶活力和蛋白含量测定
采用DNS法[22]。取100 μL适当稀释的酶液加入900 μL 0.3%褐藻胶底物中,50 ℃反应10 min,加入750 μL DNS试剂终止反应,沸水中显色10 min,迅速冷却至室温,540 nm波长下测定吸光度。以葡萄糖为标准,计算反应生成还原糖的量,在上述反应条件下,每分钟生成1 μmol还原糖所需要的酶量定义为1 个酶活力单位(U)。蛋白含量的测定参考Lowry等[23]的方法,以牛血清蛋白作为标准蛋白。
1.3.4 rFlAlyA的纯化
取饱和度60%~80%的(NH4)2SO4对高密度发酵上清液中的蛋白进行分级分离,收集目的蛋白沉淀并溶解于磷酸盐缓冲液(pH 7.0,20 mmol/L),4 ℃透析12 h,10 000 r/min离心10 min并收集上清液。采用ÄKTA纯化系统对上清液中目的蛋白进行纯化,SP强阳离子交换柱经20 mmol/L pH 7.0的磷酸盐缓冲液预平衡后上样,采用含75 mmol/L NaCl的磷酸盐缓冲液(pH 7.0,20 mmol/L)等度洗脱目的蛋白,SDS-PAGE检测目的蛋白纯度。
1.3.5 rFlAlyA的酶学性质测定
最适pH值的测定:选用50 mmol/L不同pH值的缓冲液(MES缓冲液,pH 5.5~6.5;磷酸盐缓冲液,pH 6.0~8.0;MOPS缓冲液,pH 6.5~7.5;CHES缓冲液,pH 8.0~10.0;CAPS缓冲液,pH 10.0~11.0),按照DNS法测定褐藻胶裂解酶活力,以最大值为100%,分别计算各pH值条件下的相对酶活力。
pH值稳定性的测定:采用50 mmol/L不同pH值的缓冲液(柠檬酸盐,pH 3.0~6.0;MES缓冲液,pH 5.5~6.5;磷酸盐缓冲液,p H 6.0 ~8.0;M O P S 缓冲液,pH 6.5~7.5;CHES缓冲液,pH 8.0~10.0;CAPS缓冲液,pH 10.0~11.0;Na2HPO4-NaOH缓冲液,pH 11.0~12.0)对酶液进行适当稀释,30 ℃水浴保温30 min,立即冰水浴冷却30 min,在最适pH值下采用DNS法测定残余酶活力,以未经处理的酶液为对照(100%),分别计算各pH值缓冲液处理后的相对残余酶活力。
最适反应温度的测定:采用磷酸盐缓冲液(50 mmol/L,pH 7.5),在不同温度下(30~70 ℃)采用DNS法测定褐藻胶裂解酶活力,以最大值为100%,分别计算各温度处理条件下的相对酶活力。
热稳定性的测定:采用磷酸盐缓冲液(50 mmol/L,p H 7.5)对酶液进行适当稀释,在不同温度下(20~60 ℃)保温30 min,立即冰水浴冷却30 min,在最适温度下采用DNS法测定残余酶活力,以未经处理的酶液为对照(100%),分别计算各温度处理后的相对残余酶活力。
1.3.6 rFlAlyA底物特异性及水解特性
以不同种类的多糖为底物测定rFlAlyA的底物特异性。采用DNS法测定酶活力,以polyM为底物时测定的酶活力为100%,分别计算rFlAlyA对各种底物的比酶活力和相对酶活力。底物包括:褐藻酸钠、polyM、polyG、几丁质和琼脂,各底物质量浓度均为3 mg/mL。
以褐藻酸钠、甘露糖醛酸二糖(M 2)、三糖(M3)、四糖(M4)、五糖(M5)和六糖(M6)作为底物分析rFlAlyA水解特性。酶解反应条件为:磷酸盐缓冲液(50 mmol/L,pH 7.5)溶解褐藻胶和甘露糖醛酸寡糖(10 mg/mL),加酶量1 U/mL,50 ℃保温12 h。分别在反应不同时间点取样,煮沸5 min终止反应。样品经10 000 r/min离心10 min后上样于Kieselgel 60硅胶板,将硅胶板置于展层剂中展开,用显色剂完全浸润硅胶板后吹干,烘烤至显色。展层剂为正丁醇-甲酸-水(2∶1∶1,V/V),显色剂为浓硫酸-甲醇(1∶9,V/V)。
1.3.7 褐藻寡糖制备条件优化和酶解产物的分析
采用rFlAlyA酶解褐藻酸钠制备褐藻寡糖并对酶解反应条件进行优化,考察底物质量浓度(20、40、60、80、100 mg/mL和120 mg/mL)、加酶量(10、20、40、50、60、70 U/g)及酶解时间(0.5、1、2、3、4、8、12 h)对还原糖得率的影响。酶解反应结束将酶解液于100 ℃加热5 min终止反应,采用DNS法测定反应过程中还原糖含量。根据Li Haifeng等[5]方法取离心所得上清液过0.22 μm微孔滤膜并收集滤液,冻干至恒质量。褐藻寡糖的质量为冻干物质量减去溶液中所含磷酸盐缓冲液中盐的质量,底物转化率为褐藻寡糖质量占褐藻胶质量的百分比。
取经条件优化后酶解所得滤液经脱盐处理后浓缩、冻干,采用ESI-MS分析褐藻寡糖组成。电离源为ESI,喷雾电压4 kV,毛细管温度350 ℃,管透镜120 V,鞘气压力45 AU,质量扫描范围m/z50~1 500。
采用离子色谱测定各寡糖的相对含量,色谱柱为CarboPac PA-1 column(4 mm×250 mm),柱温为30 ℃,流速为1 mL/min;洗脱方式为0~60 min内流动相A(100 mmol/L NaOH)从100%降至0%,流动相B(100 mmol/L NaOH+1 mol/L NaOAc)从0%升至100%。标准品为不同DP甘露糖醛酸,未知的寡糖样品根据与其保留时间最近的标准品进行定量。
1.4 数据分析
SDS-PAGE和薄层层析图片采用Photoshop CS6处理,相关数据采用Origin 8.0作图。
2 结果与分析
2.1 rFlAlyA的高效表达和高密度发酵
分别利用引物扩增编码成熟蛋白(rFlAlyA)的核酸序列和pWB980载体骨架序列,得到5’和3’端分别带有同源序列的目的基因和表达载体。将POE-PCR扩增得到的含有目的基因的多聚体质粒转化至枯草芽孢杆菌WB600中,成功筛选出1 株高产褐藻胶裂解酶且稳定的重组菌株。采用5 L发酵罐进行高密度发酵培养。rFlAlyA高密度发酵历程如图1a所示,采用SDS-PAGE对发酵液中rFlAlyA的表达进行分析(图1b)。经高密度发酵48 h后,rFlAlyA最高酶活力达2 550 U/mL,蛋白质质量浓度为4.5 mg/mL。SDS-PAGE分析表明,发酵液中的主条带分子质量约为30 kDa,且随着发酵时间的延长,主条带逐渐加深。

图1 重组褐藻胶裂解酶rFlAlyA高密度发酵历程(a)及发酵上清液SDS-PAGE分析(b)Fig.1 Time course of high-density fermentation of recombinant rFlAlyA (a)and SDS-PAGE analysis of proteins in the fermentation supernatant (b)
采用枯草芽孢杆菌表达黄杆菌来源褐藻胶裂解酶rFlAlyA,与文献中已报道的褐藻胶裂解酶表达水平对比发现,褐藻胶裂解酶rSAGL在毕赤酵母表达后酶活力为915.5 U/mL,蛋白质量浓度为0.23 mg/mL[5];Bacillussp.产褐藻胶裂解酶Alg07比酶活力为8 306.7 U/mg,然而其发酵上清液中酶活力仅为5 1 0 U/m L[18];Flavobacteriumsp.strain A1褐藻胶裂解酶A1-III在枯草芽孢杆菌中的表达量为0.3 mg/mL[7]。本研究中褐藻胶裂解酶rFlAlyA经枯草芽孢杆菌表达后的酶活力显著高于目前已报道的褐藻胶裂解酶的酶活力,达到最高水平。
2.2 rFlAlyA的纯化
如表1所示,经饱和度60%~80%的(NH4)2SO4分级分离后酶液比酶活力为728.3 U/mg,纯化倍数为1.5 倍;最终经SP柱纯化后比酶活力为1 768.6 U/mg,纯化倍数为3.8 倍,回收率为20.6%。
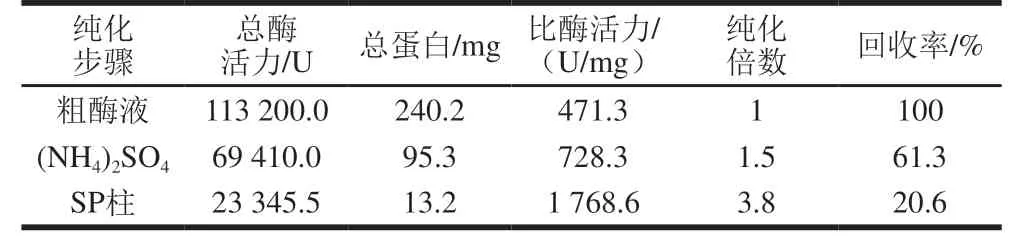
表1 rFlAlyA纯化指标Table 1 Summary of the purification process of rFlAlyA

图2 褐藻胶裂解酶rFlAlyA纯化图Fig.2 SDS-PAGE analysis of the purified rFlAlyA
由图2可知,经SDS-PAGE分析鉴定该酶分子质量约30 kDa。不同来源的褐藻胶裂解酶根据分子质量大小可分成3 类:低分子质量(25~30 kDa)、中分子质量(≈40 kDa)和高分子质量(>60 kDa)[24]。Pseudoalteromonassp.SM0524来源的褐藻胶裂解酶AlySJ-02[24]和Agarivoranssp.JAM-A1m来源的褐藻胶裂解酶Alm[25]分子质量分别为32 kDa和31 kDa。本研究纯化的褐藻胶裂解酶rFlAlyA分子质量与二者接近,同属于低分子质量褐藻胶裂解酶。Vibriosp.QY105褐藻胶裂解酶AlyV5[26]分子质量为37 kDa,属于中分子质量褐藻胶裂解酶。Shewanellasp.Kz7褐藻胶裂解酶Oal17[27]分子质量为82 kDa,属高分子质量褐藻胶裂解酶。
2.3 rFlAlyA酶学性质
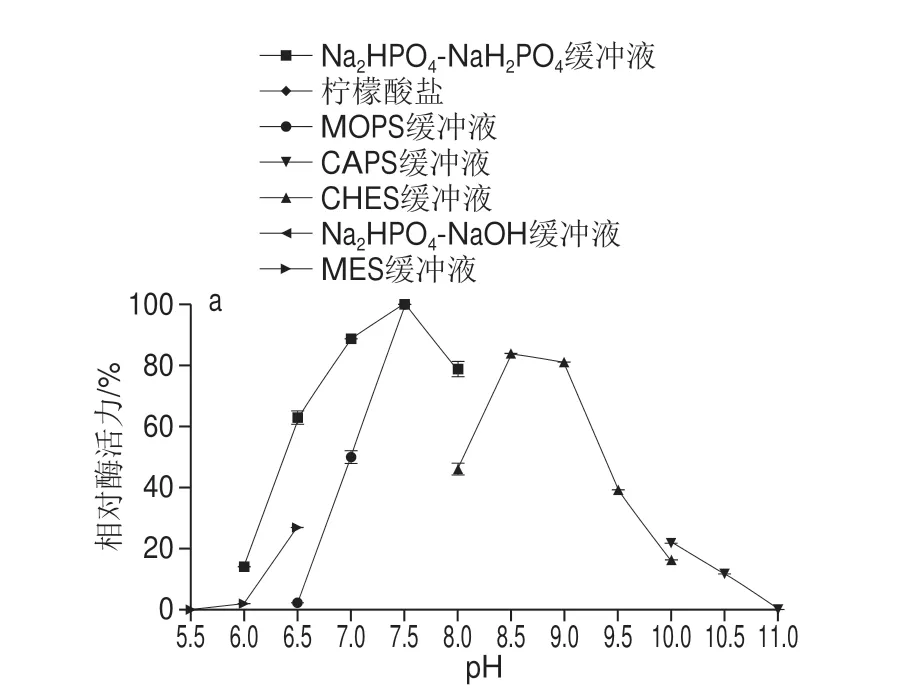
如图3所示,褐藻胶裂解酶rFlAlyA的最适pH值为7.5,在pH 4.0~11.0范围内处理30 min可保持80%以上的酶活力;最适温度为50 ℃,可在50 ℃及以下处理30 min保持80%以上的酶活力。
已报道褐藻胶裂解酶最适pH值大多在7.5~8.0范围内[18],天然黄杆菌来源褐藻胶裂解酶FlAlyA及在大肠杆菌中表达的褐藻胶裂解酶recFlAlyA最适pH值为7.8,在pH 7.8~10.5范围内保持80%以上的酶活力[4]。rFlAlyA的最适pH值与其相近,pH值稳定范围较recFlAlyA更宽。大部分PL-7家族褐藻胶裂解酶在较窄pH值范围内保持稳定,如来源于Pseudoalteromonassp.SM0524的褐藻胶裂解酶AlySJ-02在pH 7.0~10.0保持稳定[24],而Isoptericola halotoleransCGMCC5336的褐藻胶裂解酶AlyIH在pH 7.0~8.0保持稳定[28]。良好的pH值稳定性使rFlAlyA能适应和满足工业生产中不同pH值环境条件。天然黄杆菌来源褐藻胶裂解酶FlAlyA及在大肠杆菌中表达的褐藻胶裂解酶recFlAlyA最适温度约为55 ℃,在45 ℃以下保持稳定[4];rFlAlyA的最适温度与其相比降低了约5 ℃,而温度稳定性范围提高了5 ℃。大部分内切型褐藻胶裂解酶最适温度在30~45 ℃之间,如Vibriosp.W13褐藻胶裂解酶Algb[29]和Vibriosp.JAM-A9m褐藻胶裂解酶rA9mT[30]最适温度均为30 ℃,热稳定性较差。少数褐藻胶裂解酶具有较好的热稳定性,如Nitratiruptorsp.SB155-2的褐藻胶裂解酶最适温度为70 ℃[31],在67 ℃处理30 min后可保持50%的酶活力。热稳定性较好的褐藻胶裂解酶rFlAlyA具有较大的应用潜力。
2.4 rFlAlyA底物特异性及水解特性
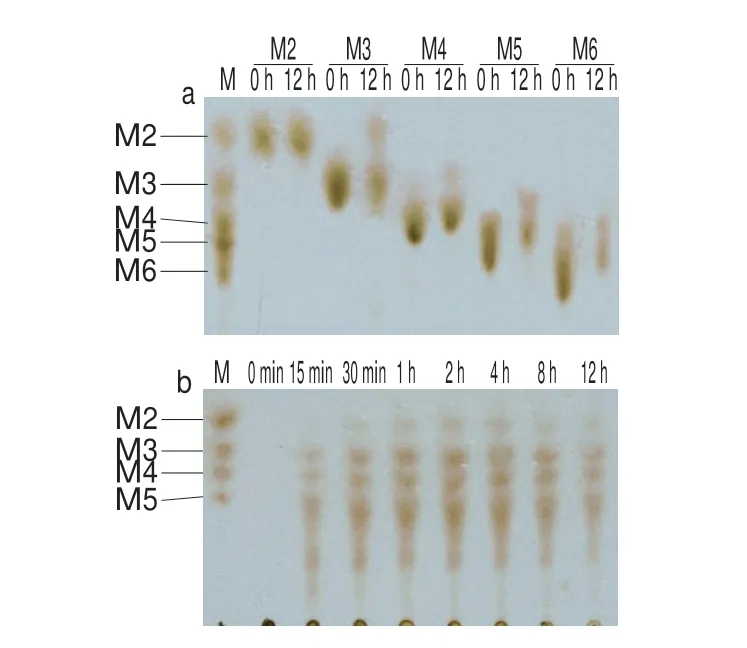
图4 褐藻胶裂解酶rFlAlyA酶解甘露糖醛酸寡糖(DP=2~6)(a)及褐藻胶(b)产物分析Fig.4 Analysis of the hydrolysates of mannonate oligosaccharides(DP = 2–6) (a) and sodium alginate (b) by rFlAlyA
rFlAlyA可降解褐藻酸钠、polyM和polyG,对polyM的相对酶活力最高(100%),对polyG相对酶活力较低(13%),不水解几丁质和琼脂(数据未列出)。通过对rFlAlyA裂解不同DP的甘露糖醛酸寡糖(M2~M6)的产物进行分析(图4a),该酶无法水解M2,可裂解M3产DEH和甘露糖醛酸二糖。经薄层层析分析rFlAlyA酶解褐藻酸钠历程(图4b),在酶解前期即产生不同DP的褐藻寡糖,随着酶解时间的延长,酶解12 h后,产物以M2~M5及DP更高的寡糖为主。
rFlAlyA可特异性地降解polyM,属于polyM特异性裂解酶。M3是褐藻胶裂解酶rFlAlyA可裂解的最短链底物,该酶以内切方式从还原端裂解M3产生DEH和M2,DEH不显色[32]。该酶在酶解历程的最初阶段迅速产生不同DP的褐藻寡糖,并随酶解时间的延长低分子质量褐藻寡糖含量逐渐增加,表明该酶为内切型褐藻胶裂解酶。已报道的内切型polyM特异性裂解酶,如Pseudomonassp.E03褐藻胶裂解酶AlgA[33]和Pseudomonassp.strain KS-408褐藻胶裂解酶AlyA[34],酶解产物主要为DP=2~5的褐藻寡糖;Flavobacteriumsp.来源的商品酶AlyDW11裂解褐藻酸钠产生DP=5~7的较高聚合度的褐藻寡糖[35];Vibriosp.W13褐藻胶裂解酶Alg7A酶解褐藻酸钠则主要产生三糖[36]。
2.5 褐藻寡糖制备条件优化和产物的组成分析
底物质量浓度、加酶量及酶解时间对rFlAlyA酶解褐藻酸钠制备褐藻寡糖的影响如图5所示。随着底物质量浓度的增加,酶解液中的还原糖质量浓度逐渐增加,底物转化率降低。综合考虑选择100 mg/mL的底物质量浓度为较优条件(图5a)。随加酶量的增加,酶解反应产生的还原糖质量浓度逐渐增加,当加酶量为50 U/g时,酶解液中还原糖质量浓度基本保持不变。因此,选择50 U/g为较适加酶量(图5b)。在酶解初期(0~1 h),褐藻胶裂解酶rFlAlyA以内切方式酶解褐藻酸钠产生褐藻寡糖,还原糖含量快速增加;酶解4 h后还原糖质量浓度达到最高33 mg/mL。随着酶解时间的继续延长,酶解液中还原糖质量浓度无显著变化,因此选择4 h为酶解最优时间(图5c)。
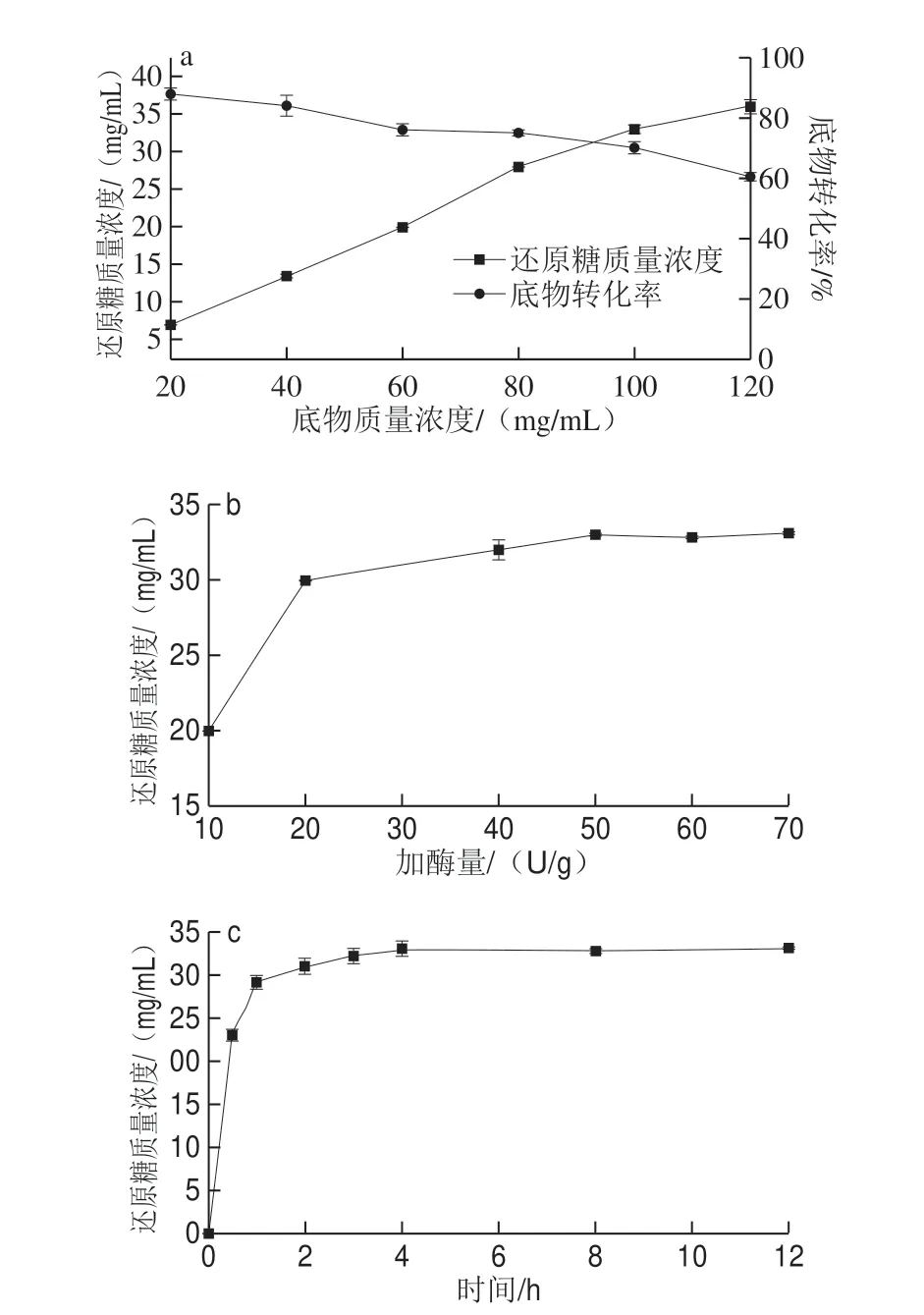
图5 底物质量浓度(a)、加酶量(b)和酶解时间(c)对rFlalyA酶解褐藻酸钠的影响Fig.5 Effects of substrate concentration (a), enzyme dosage (b) and hydrolysis time (c) on alginate hydrolysis by rFlAlyA
采用优化后条件制备褐藻寡糖,酶解4 h后,还原糖质量浓度达到最高33 mg/mL,通过冻干计算得到rFlAlyA对褐藻胶的转化率为70.1%。Li Haifeng等[5]采用褐藻胶裂解酶rSAGL酶解褐藻胶产褐藻寡糖,酶解32 h后还原糖质量浓度为9.51 mg/mL,底物转化率为97.2%。Zhu Benwei等[17]采用褐藻胶裂解酶Cel32酶解褐藻酸钠72 h后还原糖质量浓度为25.2 mg/mL。可见,rFlAlyA裂解褐藻酸钠至基本完全所需酶解时间更短,效率更高。为进一步确定酶解产物的组成,采用ESI-MS对酶解所得褐藻寡糖进行组成分析。如图6所示,褐藻胶经rFlAlyA酶解后的产物组成包括单糖(DEH)、二糖([DP2-H]-)、三糖([DP3-H]-)、四糖([DP4-H]-)、五糖([DP5-H]-)、六糖([DP6-H]-)、七糖([DP7+2Na-5H]-)和八糖([DP8+4Na-5H]-)。通过离子色谱测定各寡糖的相对含量,主要检出2~8糖,寡糖的相对比例如表2所示,其中三糖比例最高,七糖最少。

图6 褐藻酸钠酶解产物分析Fig.6 Analysis of oligosaccharide composition in alginate hydrolysate by rFlAlyA

表2 各寡糖的相对含量Table 2 Relative contents of oligosaccharides in alginate hydrolysate
3 结 论
本实验利用枯草芽孢杆菌成功实现了黄杆菌来源褐藻胶裂解酶基因rFlAlyA的高效表达,采用高密度发酵最高酶活力达2 550 U/mL,显著高于目前已报道褐藻胶裂解酶活力的最高水平。该酶具有良好的pH值稳定性及热稳定性,属于polyM特异性内切型褐藻胶裂解酶,其可裂解的最短链底物为M3。该酶对褐藻胶转化效率显著高于已报道褐藻胶裂解酶,酶解4 h还原糖质量浓度可达33 mg/mL,酶解产物DP为1~8,其中三糖含量最高。因此,枯草芽孢杆菌可用于褐藻胶裂解酶的高效生产并且在褐藻寡糖制备中具有广阔的应用前景。
