补阳还五汤抑制大鼠肺纤维化及对肺组织TGF-β/Smads信号通路的影响
2021-03-01李晓明李作盐石坷林大永
李晓明,李作盐,石坷,林大永
辽宁省健康产业集团铁煤总医院,辽宁铁岭112700
肺纤维化(PF)是一种慢性肺部疾病,表现为成纤维细胞过度积累,细胞外胶原异常沉积,肺泡结构破坏,导致肺的顺应性降低,最终发生肺功能障碍[1-2]。PF既可由病毒感染、放疗暴露、化疗药物损伤或雾化环境毒素损害等引发,也可由类风湿关节炎或系统性硬化等结缔组织病或免疫系统疾病并发。在肺纤维化形成过程中,有多种信号通路的参与,其中转化生长因子β(TGF-β)/Smads信号转导通路的活化具有关键性作用。PF患者预后极差,确诊后生存期仅为2.5~3.5年[3]。虽然近年来在PF的药物治疗上取得了一定的进展,如nintedanib和pirfenidone等生物制剂能够延缓PF进展[4-5],但不良反应较为突出,限制了其临床应用。PF在中医学上属于肺痿、肺痹范畴,与肺气虚弱、气血瘀滞有关,多采取益气活血方剂进行治疗。补阳还五汤是中医名方,具有补气、活血、通络的功效,可治疗半身不遂之中风,临床发现其对PF亦具有较好效果。2020年4月—5月,我们观察了补阳还五汤对大鼠PF的抑制作用,并通过TGF-β/Smads通路活性变化进一步探讨其治疗的机制,为该方的开发应用提供理论依据。
1 材料与方法
1.1 主要药品、试剂及仪器 补阳还五汤煎剂(生黄芪120 g、当归尾 3 g、赤芍 5 g、地龙 3 g、川芎 3 g、红花3 g、桃仁3 g,水煎后去渣,浓缩至含生药1 g/mL),博莱霉素(天津太和制药有限公司);RNA抽提试剂盒、实时荧光定量聚合酶链式反应(RT-PCR)试剂盒、互补脱氧核糖核酸(cDNA)第一链合成试剂盒(南京建成生物工程研究所),TGF-β、p-Smad3一抗(武汉博士德公司),RIPA蛋白裂解液及白蛋白(BSA)定量试剂盒(浙江碧云天生物试剂公司),Pro-Flex型PCR仪(赛默飞世尔公司),EUROBlotMaster自动免疫印迹分析仪(德国欧蒙公司)。
1.2 实验方法
1.2.1 动物饲养与分组 雄性SD大鼠,5~6周龄,体质量110~130 g,清洁级,购于中国上海SLAC实验动物中心;于室温、50%~70%湿度环境中饲养,定量喂食,自由饮水;所有操作符合《实验动物管理条例》《关于善待实验动物的指导性意见》,尽量减少动物痛苦;将大鼠饲养1周适应环境,取36只采用随机数字表法分为对照组、模型组及干预组,每组12只,分笼饲养。
1.2.2 动物造模与药物干预 模型组及干预组用博来霉素诱导PF模型,对照组不造模。三组采用2%戊巴比妥钠45 mg/kg腹腔注射麻醉后,将大鼠固定于动物解剖台;消毒,颈部正中切开,显露气管;模型组及干预组向气管内注入5 mg/L博来霉素溶液0.3 mL,对照组注入等体积生理盐水;注入后翻转动物,使药物在肺部均匀分布。将大鼠分笼饲养,自由饮水,定量喂食;大鼠出现活动力下降,挠鼻、咳嗽等呼吸道症状表示造模成功。造模1周后干预组每日以补阳还五汤煎剂4 g/kg灌胃,2次/天;模型组和对照组每日以等体积生理盐水灌胃,使用方法同干预组。各组均连续给药1周。
1.2.3 肺组织标本采集 大鼠造模1周后,断头法处死。消毒开胸,解剖分离肺组织;取左肺放入DEPC水中处理后以甲醛固定,脱水后常规石蜡包埋;取右肺上中叶保存于冷冻管中,迅速置于液氮中备用。
1.2.4 肺组织病理学观察及肺泡炎症、PF程度评价 肺组织病理切片行HE染色和Masson染色,光镜下观察病理组织学变化并摄片,参照Szapiel方法评价大鼠肺泡炎症反应程度及PF程度。肺泡炎症程度评分:0分为肺泡腔内无炎症渗出,肺组织结构正常;1分为肺泡腔内可见单核细胞渗出,局部可见肺泡间隔增宽,肺间质病变面积<20%,肺泡结构基本正常;2分为肺泡内可见较多炎症细胞,肺间质病变面积20%~50%;3分为肺泡腔内大量炎症细胞或实变,肺间质病变面积>50%。PF程度评分:0分为无PF;1分为轻度,PF病变面积<20%;2分为中度,PF病变面积20%~50%;3分为重度,PF病变面积>50%。
1.2.5 肺组织TGF-β、Smad3 mRNA检测 采用RT-PCR法。肺组织标本解融,剪碎后研磨,制备匀浆;TRIzol法提取总RNA,使用第一链cDNA合成试剂盒转录合成cDNA。分别在280、260 nm波长下,采用分光光度计法计算RNA原液浓度和OD260/OD280。根据RNA原液浓度以及试剂盒说明调整RNA浓度,使RNA稀释液浓度为500 ng/μL。按试剂盒要求配制反应体系,反应条件为37℃15 min、85℃5 s,4℃保存。合成的cDNA于-20℃保存。引物序列:TGF-β上游引物 5′-GTTCCTGCCATTCTGGTGCA-3′、下游引物 5′-TGCGTGTCAGGGGTTGGTTAC-3′,Smad3 上 游 引 物 5′-CTACCGACTGCGAGGCATAA-3'、下游引物5'-CGAGCCGATACATCGATCCT-3',内参GAPDH上游引物5'-CAGATGCTCGCAAGGTAGGA-3′、下游引物5′-ACAGAAGTAGTACGCAGACTG-3′。反应条件:50 ℃ 2 min,95℃ 2 min预变性;95℃ 15 s变性,60℃ 1 min退火,共40个循环;95 ℃ 15 s、60 ℃ 1 min,95 ℃ 30 s、60℃15 s延伸。使用ABI Prism 7500序列检测系统进行三次反应,通过2-ΔΔCt分析TGF-β、Smad3 mRNA相对表达量。
1.2.6 肺组织TGF-β、p-Smad3蛋白检测 采用免疫印迹法。将深低温保存的肺组织于液氮中充分研磨,用RIPA溶解缓冲液在冰上提取肺组织蛋白;以离心半径15 cm、12 000 r/min离心5 min,吸取上清液;加入苯基甲基磺酰氟蛋白酶抑制剂,采用Bradford法测定样品蛋白浓度。在12%SDS-聚丙烯酰胺凝胶上分离出每个样品中等量的蛋白(50 mg),转移到直径0.22 μm的硝化纤维素滤膜上;滴加TGF-β(1∶1 000)、p-Smad(1∶1 000)和 β-actin(1∶3 000)一抗,4℃下摇床温育过夜;滴加山羊抗兔IgG二抗,室温下孵育1 h,冲洗后加入ECL发光液。采用美国Pierce、Rockford等超级信号Western Pico化学发光基板,用Quantity One软件对信号进行可视化处理,以目的蛋白与内参光密度比值表示其相对表达量。
1.3 统计学方法 采用SPSS20.0统计软件。计量资料以表示,多组间比较行单因素方差分析,组间两两比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理变化 HE染色显示,对照组肺组织结构正常,无间隔水肿、肺泡可见少许炎症细胞浸润和胶原纤维沉积;模型组肺组织炎症反应明显,肺泡内可见大量炎症细胞渗出,成纤维细胞增生,形成大面积纤维化病灶;干预组肺组织炎症反应较为明显,肺泡内可见炎症细胞渗出,肺组织可见成纤维细胞增生,部分区域可见纤维化病灶。
2.2 各组大鼠肺泡炎症及PF程度比较 大鼠肺泡炎症评分及PF评分模型组高于对照组,而干预组低于模型组(P均<0.05)。见表1。
表1 各组大鼠肺泡炎症评分、PF评分比较(分,)

表1 各组大鼠肺泡炎症评分、PF评分比较(分,)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
images/BZ_42_234_2378_1193_2437.png干预组模型组对照组12 12 12 FP 1.38±0.56*#2.43±0.29*0.14±0.41 18.533 0.003 1.26±0.61*#2.32±0.21*0.26±0.02 26.112 0.002
2.3 各组大鼠肺组织TGF-β、Smad3 mRNA表达比较 大鼠肺组织TGF-β、Smad3 mRNA表达水平模型组高于对照组,而干预组低于模型组(P均<0.05)。见表2。
2.4 各组大鼠肺组织TGF-β、p-Smad3蛋白表达比较 肺组织TGF-β、p-Smad3蛋白表达水平模型组高于对照组,而干预组低于模型组(P均<0.05)。见表3。
表2 各组大鼠肺组织TGF-β、Smad3 mRNA表达比较()
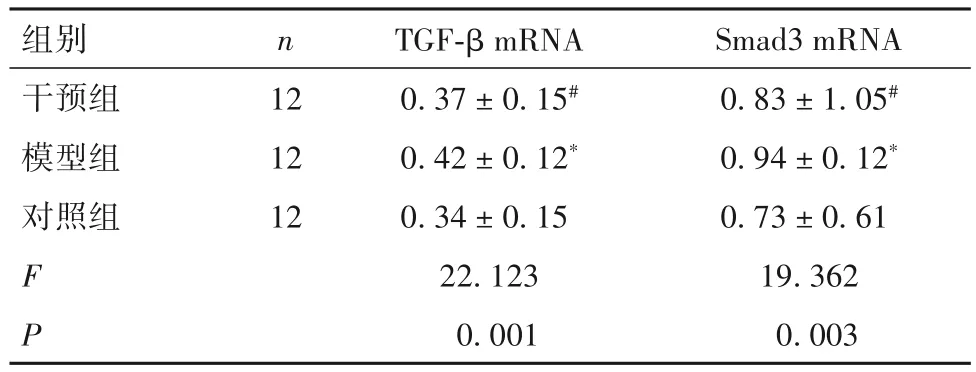
表2 各组大鼠肺组织TGF-β、Smad3 mRNA表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
images/BZ_42_1284_403_2243_462.png干预组模型组对照组12 12 12 FP 0.83±1.05#0.94±0.12*0.73±0.61 19.362 0.003 0.37±0.15#0.42±0.12*0.34±0.15 22.123 0.001
表3 各组大鼠肺组织TGF-β、p-Smad3蛋白表达比较()

表3 各组大鼠肺组织TGF-β、p-Smad3蛋白表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
images/BZ_42_1284_904_2243_963.png干预组模型组对照组12 12 12 FP 0.34±0.09#0.79±0.01*0.28±0.01 25.118 0.002 0.44±0.09#0.78±0.01*0.39±0.03 25.693 0.003
3 讨论
PF是由各种原因所致肺组织细胞外基质聚集、炎性损伤及间质纤维细胞增殖,最终引起PF;肺组织的顺应性下降,同时伴有肺泡结构的损伤,肺的通气及换气功能障碍,最终导致呼吸功能下降或衰竭。PF的发病机制复杂,炎性损伤、免疫反应及遗传学因素等均参与PF的过程。虽然,近年来PF的临床治疗取得了一定进展,但临床疗效仍不理想,大部分患者最终会进展为呼吸功能衰竭,预后极差。PF发生的中心环节是肺实质纤维组织过度增生,与细胞增殖有关的细胞因子、信号通路和PF的发生密切相关,如在PF过程中TGF-β/Smad3信号通路的激活。TGF-β通过激活其受体触发细胞反应,从而触发Smads磷酸化[7];磷酸化后Smad2、Smad3与Smad4形成异构体复合物,复合体转位到细胞核并打开基因转录,因此抑制Smads能够降低TGF-β信号通路的活性。Smad3特异性抑制剂SIS3可抑制Smad3的磷酸化,可以抑制TGF-β处理的人真皮成纤维细胞的肌成纤维细胞分化和胶原生成,可通过抑制TGF-β/Smad3信号通路来改善纤维化、凋亡和炎症反应[8];此外,SIS3能够通过抑制上皮—间充质转化(EMT)和纤维化延缓1型糖尿病小鼠模型糖尿病肾病的早期发展[9]。这些研究表明,抑制 TGF-β/Smad3信号通路功能及活性可能在纤维化相关疾病的治疗中具有重要作用[10-11]。
中医学对PF的治疗由来已久,多从肺痿、肺痹施治。中医学认为,肺脏虚损,津气耗伤,血脉瘀阻,以致肺叶枯萎。肺痿属内伤虚证,病情较重且迁延难愈,因此中医多采用补气活血功效的方剂进行治疗。补阳还五汤出自清代王清任《医林改错》,具有益气、活血、通络的作用,在气虚血瘀所致胸痛、痹症等治疗中具有极其重要的临床价值。现代医学研究显示,补阳还五汤方剂具有抗炎、抗氧化、抑制细胞凋亡等作用。本研究发现,在博来霉素诱导的PF大鼠模型肺组织发生明显的肺泡炎症及纤维化等改变,但在采用补阳还五汤干预的干预组大鼠肺泡炎症及PF评分均明显低于模型组,说明补阳还五汤能减轻博来霉素诱导的大鼠PF模型的肺部炎症损害和纤维组织增生;进一步研究发现,模型组大鼠肺组织TGF-β、Smad3 mRNA及蛋白表达上调,而干预组TGF-β、Smad3 mRNA及蛋白上调水平低于模型组。这说明TGF-β/Smad3信号通路激活参与PF的过程,而补阳还五汤能够抑制TGF-β/Smad3信号通路中Smad3的磷酸化过程,进而降低TGF-β/Smad3信号通路活性,发挥抑制肺部炎症反应及PF的作用。既往研究表明表明,TGF-β/Smads信号通路在PF的发病机制中起重要作用,养阴益气合剂对TGF-β/Smads信号通路具有调节作用,提示具有补益作用的中药对PF具有治疗作用[13]。在纤维细胞活化及增殖过程中,TGF-β信号通路激活是导致组织或脏器纤维化的原因之一;其能通过上调氧化因子、金属弹性蛋白酶以及抑制细胞凋亡等途径加速纤维细胞的沉积[14-17],对其诱导纤维化过程的细胞因子或转导信号活性进行干预是防治PF的有效途径[18]。补阳还五汤含有黄芪、当归、赤芍、地龙、川芎等有效成分。既往研究显示[19-20],黄芪中的多糖组分能够通过调节TGF-β1/Smads信号通路对百草枯诱导的大鼠PF发挥拮抗作用;同时,也能通过抑制mTOR及其下游p-S6的表达,影响α平滑肌肌动蛋白生成,干预博来霉素诱导的大鼠PF发生。当归中多糖、当归醇等组分能通过抑制TGF-β、血管内皮生长因子表达,延缓博来霉素诱导的PF大鼠模型肺部病变的进展。以上研究提示,补阳还五汤中的药物组分对PF的调节可能通过多途径发挥作用。
综上所述,补阳还五汤能够减轻PF大鼠肺组织炎症及纤维化程度,可能与其抑制肺组织TGF-β/Smad3信号通路中TGF-β蛋白表达同时降低Smad3磷酸化水平有关,这为临床应用补阳还五汤治疗PF提供了一定的理论支持。
