地塞米松宫腔灌注在中重度宫腔粘连中的应用
2021-03-01栗浩然相元翠
栗浩然,相元翠
子宫内膜基底层在多种因素的作用下受到损伤,造成宫腔前、后壁相互粘连,最终引发宫腔粘连[1]。宫腔粘连患者临床常表现为月经异常、周期性下腹痛、习惯性流产[2]。 现阶段,临床常采用宫腔粘连分离术治疗宫腔粘连,但患者术后宫腔内膜需要时间进行修复,使再粘连的风险提升[3]。采取更加有效的方法预防宫腔粘连,对宫腔粘连患者术后恢复有着重要的临床价值。 因此,该研究探讨地塞米松宫腔灌注在中重度宫腔粘连中的应用效果,现将结果报告如下。
1 资料与方法
1.1 一般资料选取2018 年1 月—2019 年12 月于笔者医院接受治疗的90 例中重度宫腔粘连患者作为研究对象。 纳入标准:(1)符合《妇产科学》中有关中重度宫腔粘连的诊断标准[4];(2)年龄≥18 岁;(3)思维正常,能配合接受治疗;(4)近期未使用激素类治疗药物;(5) 患者签署知情同意书。 排除标准:(1)合并认知、精神、凝血功能障碍者;(2)对该研究药物过敏者;(3)合并子宫内膜息肉、子宫肌瘤等其他子宫类疾病者;(4)合并自身免疫缺陷病、内分泌疾病、恶性肿瘤者;(5)生殖道畸形或缺陷者;(6)合并肾、肝、心、脑等多其器官损伤者;(7)临床资料不全者。 所有患者按照随机数字表法分为对照组(n=45)和观察组(n=45)。观察组:年龄21~40 岁,平均(28.95±3.48)岁;孕次0~5 次,平均(2.05±0.31)次;粘连部位:周围型16 例,中央型20 例,混合型9例;粘连程度:中度26 例,重度19 例。 对照组:年龄22~38 岁,平均(28.27±3.19)岁;孕次0~5 次,平均(2.22±0.37)次;粘连部位:周围型15 例,中央型19例,混合型11 例;粘连程度:中度28 例,重度17例。 2 组临床资料的比较, 差异无统计学意义(P>0.05)。
1.2 方法2 组均接受宫腔粘连分离术。 对照组术后使用生理盐水宫腔灌注:患者阴道出血干净后3 d、5 d、7 d,阴道环境良好,常规消毒后,沿子宫曲度将宫腔注射管插入宫腔,触至宫腔底部时,后退2 cm,通过宫腔注射管将10 ml 生理盐水(厂家:四川科伦药业股份有限公司,国药准字H20056626)在无阻力情况下注入宫腔,宫腔灌注时间10 min。 观察组使用地塞米松宫腔灌注:患者阴道出血干净后3 d、5 d、7 d,阴道环境良好,常规消毒后,沿子宫曲度将宫腔注射管插入宫腔,触至宫腔底部时,后退2 cm,通过宫腔注射管将10 ml 生理盐水和5 mg 地塞米松(生产厂家:天津天药药业股份有限公司,国药准字H20033553)在无阻力情况下注入宫腔,宫腔灌注时间10 min。 2 组术后连续3 个月在月经周期的7 d、10 d、13 d,即子宫内膜增生期和分泌早期,进行宫腔灌注。
1.3 观察指标(1)比较2 组临床疗效。疗效判定[5]:①显效:宫腔形态正常,不存在粘连,双侧输卵管开口正常;②有效:宫腔形态基本正常,粘连范围缩小,单侧或双侧输卵管开口正常;③无效:宫腔形态未恢复正常,粘连与治疗前无变化。 临床治疗总有效率=(有效+显效)/总例数×100%。(2)在治疗前后,于排卵日(成熟卵泡消失)使用彩色多普勒超声仪检测子宫动脉血流阻力指数(RI)、搏动指数(PI)及子宫内膜厚度。 (3) 在治疗前后于清晨空腹抽取2组外周静脉血4 ml,经离心后,取上清液,使用美国贝克曼库尔特公司生产的AU680 全自动生化分析仪, 采用酶联免疫吸附法检测2 组白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)、白细胞介素-8(IL-8)、结缔组织生长因子(CTGF)、血管内皮生长因子(VEGF)、转化生长因子-β1(TGF-β1)。
1.4 统计学方法应用SPSS 21.0 软件进行数据分析。计数资料用[n(%)]表示,组间比较采用χ2检验;计量资料采用()表示,2 组间比较采用t 检验。 以P<0.05 为差异具有统计学意义。
2 结 果
2.1 2 组临床疗效的比较观察组临床治疗总有效 率95.56%高 于 对 照 组82.22%(χ2=4.050,P <0.05)。 见表1。

表1 2 组临床疗效的比较[例(%)]
2.2 2 组治疗前后子宫动脉血流参数及子宫内膜厚度的比较2 组治疗前RI、PI、 子宫内膜厚度的比较,差异无统计学意义(P>0.05)。 2 组治疗后RI、PI 较治疗前均降低, 且观察组低于对照组 (P<0.05)。 2 组治疗后子宫内膜厚度较治疗前均升高,且观察组高于对照组(P<0.05)。 见表2。
2.3 2 组治疗前后炎症因子水平的比较2 组治疗前IL-6、TNF-α、IL-8 水平的比较,差异无统计学意义(P>0.05)。 2 组治疗后IL-6、TNF-α、IL-8 水平较治疗前均降低,且观察组低于对照组(P<0.05)。见表3。
2.4 2 组治疗前后血清学指标的比较2 组治疗前CTGF、VEGF、TGF-β1 水平的比较, 差异无统计学意义 (P>0.05)。 2 组治疗后CTGF、VEGF、TGF-β1水平较治疗前均降低, 且观察组低于对照组 (P<0.05)。 见表4。
3 讨 论
宫腔放置节育器是预防宫腔粘连的常用物理方式,但其具有一定的局限性,可能提升感染的风险[6]。 此外,术后放置水囊管也可以预防粘连,子宫内膜沿球囊表面修复, 但极易引发局部内膜受压,造成缺血性损伤[7]。因此,现阶段药物预防逐渐成为临床常用的治疗措施。
表2 2 组治疗前后子宫动脉血流参数及子宫内膜厚度的比较

表2 2 组治疗前后子宫动脉血流参数及子宫内膜厚度的比较
注:与同组治疗前比较,*P<0.05。
组别 n RI PI 子宫内膜厚度(mm)治疗前 治疗前 治疗前 治疗后观察组 45 1.24±0.20 1.72±0.24 7.49±1.03 8.87±0.98*对照组 45 1.21±0.22 1.68±0.27 7.42±1.12 8.31±1.05*t 值 - 0.677 0.743 0.309 2.616 P 值 - 0.500 0.460 0.758 0.011治疗后0.94±0.15*1.08±0.18*4.008 0.000治疗后1.42±0.19*1.59±0.21*4.027 0.000
表3 2 组治疗前后炎症因子水平的比较,ng/mL)

表3 2 组治疗前后炎症因子水平的比较,ng/mL)
注:与同组治疗前比较,*P<0.05。
组别 n IL-6 TNF-α IL-8治疗前 治疗前 治疗前 治疗后观察组 45 120.35±16.96 96.21±13.24 114.36±15.61 93.56±9.21*对照组 45 119.87±17.42 95.89±13.67 112.96±15.18 99.56±11.29*t 值 - 0.132 0.113 0.431 2.762 P 值 - 0.895 0.910 0.667 0.007治疗后90.21±10.72*104.23±11.84*5.888 0.000治疗后75.96±7.86*87.52±10.43*5.938 0.000
表4 2 组治疗前后血清学指标的比较ng/L)
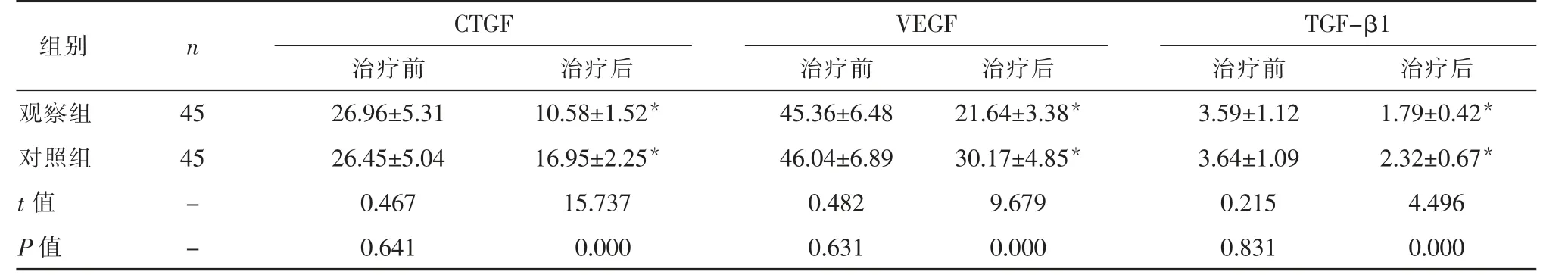
表4 2 组治疗前后血清学指标的比较ng/L)
注:与同组治疗前比较,*P<0.05。
组别 n CTGF VEGF TGF-β1治疗前 治疗前 治疗前 治疗后观察组 45 26.96±5.31 45.36±6.48 3.59±1.12 1.79±0.42*对照组 45 26.45±5.04 46.04±6.89 3.64±1.09 2.32±0.67*t 值 - 0.467 0.482 0.215 4.496 P 值 - 0.641 0.631 0.831 0.000治疗后10.58±1.52*16.95±2.25*15.737 0.000治疗后21.64±3.38*30.17±4.85*9.679 0.000
地塞米松是具有良好免疫抑制及抗炎作用的新型糖皮质激素,可以发挥抗变态反应,抑制巨噬细胞对抗原的吞噬,还能够对炎性因子的分泌及聚集产生抑制[8,9]。该研究中观察组临床治疗总有效率高于对照组,提示地塞米松宫腔灌注能够提升中重度宫腔粘连的临床治疗效果。 子宫内膜容受性受子宫内膜下血管的丰富程度及血流灌注量的影响,宫腔粘连患者的子宫内膜容易出现血流异常[10]。 临床常对子宫内膜血流参数、 子宫内膜厚度进行监测,进而判断子宫内膜下血流及子宫内膜情况,有利于医师更好地评估患者宫腔粘连恢复情况,指导后续治疗。 该研究中观察组治疗后RI、PI 低于对照组,子宫内膜厚度高于对照组,提示地塞米松宫腔灌注能够改善子宫内膜血流动力学,有利于子宫内膜增生,这是因为,地塞米松宫腔灌注可以促进组织重塑及血管生成,有利于基底动脉的再生,使子宫内膜得到养分,最终帮助子宫内膜增生。
炎症反应对宫腔粘连的形成有着重大的影响,子宫内膜受到损伤,发生感染时,机体出现炎症反应,使炎症因子水平显著提升[11]。 子宫内膜在炎症因子的相互作用下发生纤维化,最终加快宫腔粘连的形成。 IL-6 可以对机体炎症及免疫反应进行介导,使子宫内膜免疫功能出现异常,引发纤维化和粘连,加重患者病情[12]。 TNF-α 可以促进成纤维细胞及血管内皮细胞释放巨噬细胞集落刺激因子,引发组织炎症损伤。 中性粒细胞、单核细胞、巨噬细胞等趋化性细胞因子能分泌IL-8,激活、吸引嗜中性粒细胞,进而调节免疫反应、促进炎症反应[13]。 该研究中观察组治疗后IL-6、TNF-α、IL-8 低于对照组,表明地塞米松宫腔灌注能调节中重度宫腔粘连患者的炎症因子水平,这可能是因为,地塞米松可以抑制炎症部位白细胞、 巨噬细胞等炎症细胞的集聚,还可以抑制炎症因子的合成和释放、溶酶体酶的释放,最终缓解机体炎症反应。
宫腔粘连与纤维细胞过度增生密切相关,上皮细胞和间质细胞因为受损的子宫内膜基底层而不易再生,不利于新生血管的生成,进而出现细胞外基质过度沉积[14]。 此外,纤维细胞过度增生也会使纤维结缔组织发生增生,引发宫腔粘连。 CTGF 有利于细胞外基质沉积和结缔组织形成。 子宫内膜受损和感染会导致内膜局部缺氧、 缺血, 刺激VEGF 表达。 此外,患者的炎症反应也会释放大量的胰岛素样生长因子、炎症因子,提升VEGF 水平。TGF-β1 能够影响宫腔粘连的形成,使其保持结缔组织形态,引发子宫内膜病理性纤维化,影响宫腔粘连的发展[15]。 该研究中观察组治疗后CTGF、VEGF、TGF-β1 水平低于对照组, 表明地塞米松可以通过调节CTGF、VEGF、TGF-β1 水平抑制宫腔粘连。 分析原因为,地塞米松作为糖皮质激素类药物,能够使糖皮质激素受体与VEGF 竞争A-PI 受体结合, 对VEGF 蛋白合成进行抑制, 最终降低VEGF水平。 此外,地塞米松有抗纤维化的作用,可以降低TGF-β1 水平。
综上所述,地塞米松宫腔灌注能够提升中重度宫腔粘连患者的临床治疗效果,改善子宫动脉血流及子宫内膜厚度, 缓解炎症反应, 减少CTGF、VEGF、TGF-β1 的表达。
