双参数MRI 影像组学模型对前列腺良性增生结节和前列腺癌的鉴别价值*
2021-03-01邢朋毅阳青松陆建平
邢朋毅,马 超,阳青松,陆建平
前列腺癌是世界范围内老年男性常见的恶性肿瘤之一,其发病率居美国男性肿瘤首位,病死率居男性肿瘤第二位[1],近年来我国前列腺癌的发病率亦不断增加[2]。直肠指检(directeral rectun examination,DRE)和前列腺特异性抗原(prostate specific antigen,PSA)筛查已成为前列腺癌诊断的公认方法。 但DRE 并不是前列腺早期病变的敏感工具,且需要长期的随访检测,异常则多提示晚期癌症[3]。 尽管PSA 筛查降低了前列腺癌患者的病死率,但筛查效率较低并存在局限性,假阳性率高,且随后要进行不必要的前列腺活检[4-6]。 此外,患有良性前列腺增生的患者也可以检测到较高的PSA 水平[7,8]。
随着多参数磁共振的应用推广,越来越多的局灶性前列腺癌被检出,该技术能够精确定位,使得前列腺癌的早期精准治疗成为可能[9]。 影像组学将传统的影像图像转换为可挖掘的数据信息,并对之进行高通量定量分析,突破了基于形态学及半定量分析的传统影像医学模式, 融合了数字影像信息、统计学、机器学习等方法,充分深入挖掘和分析隐含在图像中的额外信息,最高效地利用影像学检查结果[10]。 当前影像组学在前列腺良恶性病变的鉴别、预后评价等方面的应用愈加广泛。 笔者利用前列腺癌MRI 影像组学方法探讨其对良性前列腺增生结节和前列腺癌的鉴别价值。
1 资料与方法
1.1 一般资料搜集2015 年3 月—2017 年6 月笔者医院经手术病理证实的前列腺结节157 例作为研究对象,其中良性结节92 例,恶性结节65 例,年龄37~86 岁,平均(67±8)岁,血清前列腺特异抗原水平1.13~120.25 ng/ml,平均(24.17±21.24) ng/ml。纳入标准:(1)术前接受MRI 平扫+增强检查,且检查时间与手术时间间隔<7 d;(2)术前经第二版前列腺影像报告和数据系统(Prostate Imaging Reporting and Data System version 2,PI-RADS v2)评分为≥2 分;(3)病灶直径>5 mm;(4)在MRI 检查之前未进行前列腺活检、手术、放射治疗或内分泌疗法,且未见骨及其他远处转移灶。
1.2 检查设备与方法采用3T MR 系统(MAGNETOM Skyra,Siemens Healthcare,Erlangen,Germany) 使用标准的18 通道相控阵体部线圈和32 通道集成脊柱线圈。 患者检查前一天进食少渣食物,检查前禁食4~6 h,检查时尽量排空肠道及膀胱。 检查时用绑带对线圈进行固定,并用沙袋加压,以减少患者呼吸运动产生的伪影。 横轴位DWI 的主要参数:重复时间/回波时间(TR/TE)=5100/89 ms,视野(FOV)=224×280 mm2,矩阵=120×150,层数=20,层厚=4 mm, 层间距=0 mm,b 值=0,1500 s/mm2,采集时间=7m59s。 前列腺行横轴面、矢状面、冠状面三方位2DT2WI 快速自旋回波序列扫描, 横轴位T2WI 扫描参数为TR/TE=5460/104 ms,FOV=180×180 mm2,矩阵=384×384,层数=24,层厚=4 mm,层间距=0 mm,回波链长度=18,采集时间=3m49s。 横轴位DWI 扫描在定位时尽量保证和T2WI 序列层面一致。
1.3 前列腺病理结果所有患者均经MR 引导下行前列腺靶向穿刺活检或前列腺根治全切术(RP)。病理标本经HE 染色及免疫组织化学分析,由一名具有18 年经验的泌尿病理专家观察组织学切片,并确定病灶所在位置和边界,诊断为癌者,则进行病灶的Gleason 评分, 选取具有最高Gleason 评分的临床显著癌病灶(体积≥0.5 cm3)进行分析,评分依照国际泌尿外科病理学会(ISUP)2014 年共识会议制定的前列腺癌分级指南[11]。 诊断为前列腺良性结节的患者, 选取直径最大的结节进行病灶分析。
1.4 前列腺结节病灶分割及影像组学分析
1.4.1 病灶分割 由具有前列腺诊断经验的8 年资质的放射科医师使用ITK-SNAP 软件绘制前列腺结节病灶的2D ROI。 使用T2WI 图像来分割感兴趣区域(ROI),并将参照DWI(b=1500 s/mm2)图像进一步确定病灶范围, 并与ADC 图的ROI 进行匹配。 在符合纳入标准的靶病灶上,于具有最大结节半径的轴位层面圈划ROI,并仔细排除周围的非病灶结构。 为了验证分割的效果,笔者在队列中随机选择了30 张图像, 并且该放射科医师在间隔2 周后再次绘制ROI。采用R 软件(http://www.Rrproject.org,Version:3.4.4)对数据进行一致性检验,计算2次圈划的ROI 所提取的特征之间的组内相关系数(intraclass correlation coefficient,ICC), 保 留2 次ICC 均>0.75 的特征。
1.4.2 特征提取 利用影像组学软件包提取影像组学特征。 在特征计算之前,首先对图像进行预处理,主要包括体素重采样、灰度离散化和图像强度归一化三个步骤。 将图像重采样到[1,1,1]体素大小,以确保体素各向同性,并且其特征是旋转不变的。 灰度离散化有助于减少计算量,应用箱宽20 来离散灰度级, 利用μ±3σ 法进行强度归一化以扩大类别之间的差异, 然后提取特征并对其进行分类,共提取影像组学特征396 个,42 个直方图特征,180个RLM 特征,9 个形态特征,11 个GLSZM 特征,10个haralick 特征,144 个GLCM 特征。
1.4.3 特征选择与模型构建 受试者按7∶3 的比例分为训练队列和验证队列。 采用双特征选择的方法对特征进行过滤。首先使用mRMR 方法排除了大部分特征,只保留了30 个特征之间的冗余度最小、与目标标签相关性最大的特征。 然后,通过选择优化的超参数λ 来选择预测偏差最小并且最具预测性的特征子集 (图1)。 最后利用剩余的特征用多元Logistic 回归建立模型,并计算每个受试者的影像组学特征,通过特征乘以其相应的系数来计算影像组学标签(图2、3)。

图1 双参数MR 联合模型影像组学特征的选择
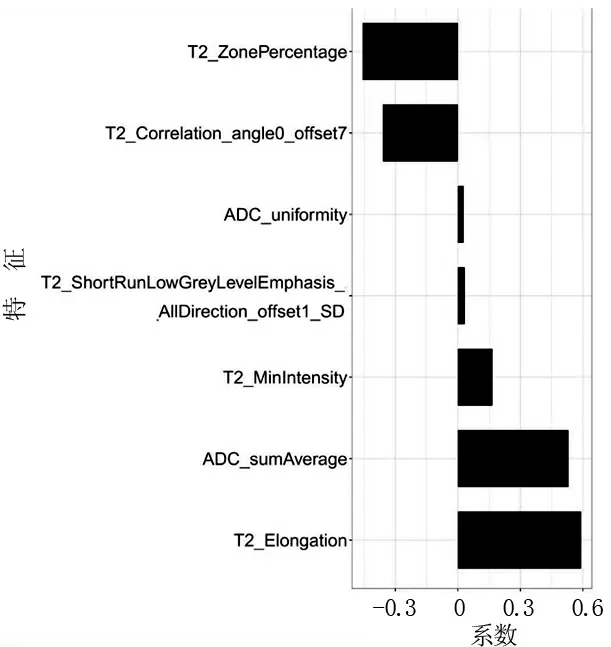
图2 双参数MR 联合模型筛选出的影像组学特征

图3 双参数MR 模型训练组与测试组影像组学评分的比较
1.4.4 模型验证 使用ROC 分析来验证不同模型的性能,基于T2WI 和ADC 图在训练队列和验证队列中的表现。 为了得到更稳健的结果,笔者进行了100 次LGOCV(留组交叉验证法),得到100 条ROC曲线的平均AUC,然后用Mann-Whitney U 检验比较不同模型之间的差异。 用DeLong 测试来比较不同模型的诊断效能,即曲线下面积(AUC)的对比,得到不同模型ROC 曲线的P 值,P<0.05 为差异具有统计学意义,最后用决策曲线比较每个模型的临床实用性。
1.5 统计学分析采用R 软件进行统计学分析。以受试者操作特征(receiver operating characteristic,ROC)曲线评价预测模型的影像组学评分在训练组和测试组中鉴别前列腺良性增生结节和前列腺癌的效能,获得灵敏度、特异度、准确率、阴性预测值(NPV)、阳性预测值(PPV)及ROC 曲线下面积(area under curve,AUC)。 校准曲线用于评测影像组学评分的预测结果与病理结果的一致性。采用χ2检验比较2 组患者年龄、病灶大小及PSA 值分布,采用独立样本t 检验 (方差齐) 或Mann Whitney U 检验(方差不齐) 比较训练组和测试组患者年龄及PSA值的差异。 P<0.05 为差异有统计学意义。
2 结 果
3 种影像组学模型对前列腺良性增生结节和前列腺癌的诊断效能比较见表1。 表1 列出了3 种模型的AUC、准确性、敏感性和特异性,图4 显示了这3 种模型的ROC 曲线。训练组及测试组中3 种组学模型预测前列腺结节良恶性的校准曲线(图5),提示预测结果与病理结果一致性较好。ADC 影像组学模型、T2WI 影像组学模型和双参数影像组学组合模型的决策曲线如图6 显示,无论是单参数影像组学还是双参数组合模型对前列腺良性增生结节和前列腺癌都有一定的预测效能。

图4 基于MR 的3 种影像组学模型诊断良恶性前列腺结节的受试者操作特征(ROC)曲线

图5 3 种影像组学模型预测前列腺结节良恶性的结果与病理结果一致性的校准曲线

图6 决策曲线评价3 种影像组学模型的临床应用价值
3 讨 论
前列腺特异抗原(PSA)水平升高或直肠指诊异常的前列腺癌疑似患者,要进行标准的经直肠超声引导下穿刺活检, 这种方法会出现高级别的前列腺癌检测不足和低级别的肿瘤过度检出[12],多数患者进行了过度的治疗以及随访检测, 增加了患者和医疗保健部门的成本[13,14]。 随着前列腺影像报告和数据系统(PI-RADS)的提出以及基于大数据、人工智能的影像组学蓬勃发展, 多参数磁共振成像(mp-MRI)成为前列腺疾病影像学检查的最佳选择,在前列腺癌早期诊断、治疗方案选择、疗效评估及预后评价等方面具有重要价值。研究表明,bp-MRI(包括T2WI+DWI) 与mp-MRI (包括T2WI+DWI+DCEMRI) 的诊断效能和准确性相当,bp-MRI 的阅片者间一致性良好,图像采集和解读时间较mp-MRI 明显缩短,且无须使用对比剂[15]。而DCE-MRI 的钆剂不良反应、额外的扫描时间和成本、阅片者间一致性较差等不足可能抵消其有限的辅助价值[16,17]。 基于双参数MR 诊断筛查前列腺癌的卫生经济学评价,笔者建立bp-MRI(包括T2WI+DWI)影像组学模型对前列腺良性增生病灶和前列腺癌进行鉴别。
术前经第二版前列腺影像报告和数据系统(PI-RADS v2.1)评分为3 分的前列腺结节病变,仅仅依靠单纯的影像学鉴别比较困难。 医学图像中的宏观异质性可能反映组织病理学水平上的微观异质性[18,19],从 前 列腺MR 的T2WI 和ADC 图中 提 取的影像组学特征可以作为鉴别良性前列腺增生结节和前列腺癌的潜在生物标志物。 虽然这是一个初步的工作,但基于MR 双参数影像组学模型可能为评估前列腺癌的生物学特性和异质性提供一种无创的工具。 在病理学层面,良性前列腺增生结节和前列腺癌的内部细胞成分、液体含量、胶原水平和纤维肌肉间质特征存在差异, 前列腺癌分化较差,细胞密度高,细胞外间隙减少。 大量研究表明,这些组织病理学特征的差异可以通过定量分析和影像组学方法反映出来,影像组学模型所提取的纹理参数可用于前列腺癌的诊断和风险分类。Wibmer 等[20]使用T2WI 和ADC 图, 证明Haralick 纹理分析的5个参数(能量、熵、相关性、均匀性和惯性)对评估前列腺癌和,Gleason 评分是有利的,特别是GS≤3+4和≥4+3 癌的能量和熵的ADC 图有显著差异。Sidhu 等[21]的研究结果表明,ADC 峰度和T1熵的纹理特征可以区分显著的移行带的前列腺癌,这两个参数组合的AUC 值为0.86。 Nketiah 等[22]的研究显示,结合T2WI 纹理特征[角二次力矩(ASM)、对比度、相关性和熵]比使用基于MRI 的生理参数[ADC和DCE 药动学参数(Ktrans和Ve)]联合使用(AUC:0.75)产生更高的分类性能(AUC:0.82)。 这些研究纳入的患者数量相对较少,研究方法只侧重于几个有限的纹理特征的提取以及前列腺癌的恶性风险分级。 该研究扩展提取图像纹理特征类型,建立基于MR 双参数图像的影像组学模型研究对良性前列腺增生结节和前列腺癌进行鉴别,对前列腺疾病的早期筛查和前列腺癌的诊治有较高的临床应用价值。

表1 3 种影像组学模型对前列腺良恶性结节的鉴别
该研究具有一定的局限性,首先,这是一项在单一机构进行的回顾性研究,虽然从这一组患者中提取了部分数据作为测试集来验证模型,但只有进行大样本量的多中心验证才能获得更好的临床应用证据。 该研究病理结果的取得是通过穿刺或前列腺全切,依据穿刺结果圈划的感兴趣区可能偏差较大, 病理和MRI 对癌灶匹配具有一定的局限性,一些在MRI 上难以观察到的病变,笔者根据病理结果和易于识别的MR 成像序列绘制病灶轮廓,部分病灶可能未包括在内,该研究的病理金标准应该是根治性前列腺切除术后标本的病理大切片, 并非TRUS 前列腺系统活检, 穿刺病理可能降低了前列腺癌评估的准确性,不能准确反映前列腺真实的病理状态,因此,下一步针对具有前列腺癌根治术病理大切片的患者,要加大研究样本量。 目前,进行影像组学分析前的病灶识别与放射科医师的诊断水平具有较大相关性。 计算机辅助分析技术有助于解决诊断标准化的问题,用计算机基于活体MRI 制备三维模型来指导切片,以获得MRI 与病理切片的精确匹配,将有助于提高影像组学分析结果对前列腺MR 图像解释的可重复性。
虽然该研究建立的影像组学模型是定量的、相对客观的,取得了较好的效果,但影像组学特征需与年龄、PSA 值、PI-RADS 评分等临床指标进行联合验证比较,才能更准确地反映患者客观的临床状态。
