蔗糖转化酶SUC2分泌表达系统的改造
2021-03-01郑聪聪周海龙赵晶晶李宪臻
郑聪聪,周海龙,赵晶晶,李宪臻,杨 帆
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.中国生物发酵产业协会,北京 100833)
0 引 言
菊糖是一种可以生产燃料乙醇的优质能源生物质。然而,自然界中只有极少数微生物可以直接转化菊糖为乙醇[1-2]。酿酒酵母(Saccharomycescerevisiae)能够高效转化生物质生产乙醇,且易于培养、遗传操作平台成熟[3]。然而,绝大多数酿酒酵母菌株不能直接水解菊糖为可发酵糖[4-5]。有文献表明,蔗糖转化酶SUC2是酿酒酵母水解菊糖的关键酶,它的表达水平直接影响酿酒酵母水解菊糖产乙醇的能力[6]。目前,天然酿酒酵母菌株中SUC2的表达水平非常低,严重阻碍了菊糖基乙醇的工业化生产进程[7-8]。
酿酒酵母α交配因子(αF)是一种肽激素效应物,仅由α型单倍体细胞分泌,指引该细胞与相反配型的单倍体细胞进行接合[9]。α交配因子的前体进入细胞的分泌系统,并在分泌后期被胞内外蛋白质水解酶加工为成熟的αF[10]。国内外已有多项研究利用α交配因子的分泌信号肽融合目标蛋白以提高其分泌表达水平,如来自马克斯克鲁维酵母的菊糖酶和羧肽酶等,均取得了较好的效果[11-13]。
目前,还没有文献报告利用融合分泌信号肽有效提高酿酒酵母SUC2分泌水平。本实验克隆获得α交配因子的分泌信号肽编码基因,并将其与SUC2编码基因上游进行融合,随后转化至酿酒酵母进行分泌表达,旨在为理性改造酿酒酵母使其高效转化菊糖产乙醇提供理论基础。
1 材料与方法
1.1 材料与仪器
酿酒酵母S.cerevisiaeBY4741、EscherichiacoliDH10B,获赠于大连化学物理研究所赵宗保研究员课题组。质粒pYC230-Suc2,中国科学院青岛生物能源与过程研究所赠予。酿酒酵母重组菌BY-BS,本实验室前期构建并保藏。PrimeSTAR HS DNA 聚合酶,250 bp DNA Marker,大连宝生物有限公司;DpnI,NEB公司。
酵母发酵液体YPD培养基:葡萄糖20.0 g/L,酵母浸粉10.0 g/L,蛋白胨20.0 g/L,pH 6.0;固体YPD培养基:琼脂粉15.0 g/L其余同YPD液体培养基,根据需要补加200 μg/mL G418。LB液体培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L,pH 7.0;LB固体培养基:琼脂粉15.0 g/L其余同LB液体培养基,根据需要补加100 μg/mL氨苄西林。
Eppendorf AG22331电击融合仪、梯度PCR仪,德国艾本德股份有限公司;MD spectramax paradigm酶标仪,美谷分子仪器(上海)有限公司;DYY-11型电泳仪,北京市六一仪器厂。
1.2 方 法
1.2.1 引物设计
α交配因子的分泌信号编码基因的克隆及基因融合表达载体的构建、鉴定所用引物均合成于大连宝生物有限公司。所使用的引物序列及功能如表1所示。

表1 引物序列及功能Tab.1 Sequences and functions of primers
1.2.2 α交配因子的分泌信号编码基因的克隆
将αF分泌信号肽与部分Suc2基因融合片段共303 bp送往上海生工生物技术有限公司进行全基因合成,合成的片段被亚克隆至pUC57,构成pUC57-αF-Suc2。
1.2.3 融合有αF分泌信号肽的pYC-mSuc2分泌表达载体的构建
采用RF克隆策略[19]将酿酒酵母表达载体pYC230-Suc2上的Suc2天然分泌信号肽编码序列替换为全基因合成的αF分泌信号肽基因片段(αFSP)。RF Ⅰ反应所用引物为pSF和pSR,以质粒pYC230-Suc2为模板,反应条件:94 ℃ 5 min,94 ℃ 30 s,53 ℃ 45 s,72 ℃ 30 s,30个循环,72 ℃ 10 min,4 ℃结束反应。采用凝胶回收试剂盒对RF Ⅰ扩增产物进行回收。RF Ⅱ反应体系:100 ng pYC230-Suc2,280 ng RF Ⅰ回收产物,5 μL 5×PrimerSTAR buffer,2.5 mol/L dNTPs,1.25 U PrimeSTAR HS DNA聚合酶,加水至总体积为25 μL。RF Ⅱ反应条件:94 ℃ 5 min,94℃ 30 s,65 ℃ 1 min,68 ℃ 9 min,15个循环(每个循环退火温度降低1 ℃),之后,94 ℃ 30 s,55 ℃ 1 min,68 ℃ 9 min,20个循环,68 ℃ 15 min,4 ℃结束反应。
取9 μL RF Ⅱ反应产物,加入1 μLDpnI (10 U/μL),37 ℃消化5 h降解甲基化模板质粒。取2.5 μL消化产物电击转化至E.coliDH10B中,转化菌液涂布于含终质量浓度为100 μg/mL氨苄西林的LB平板,挑选阳性克隆进行酶切验证。酶切体系:0.5 μg质粒DNA,0.5 μLSalⅠ和0.5 μLSacⅠ(双酶切)或0.5 μLPstⅠ(单酶切),1 μL 10×buffer,加水至体积为10 μL,37 ℃温育2 h,1%琼脂糖凝胶电泳对酶切产物鉴定。测序正确的质粒命名为pYC-mSuc2,如图1所示。
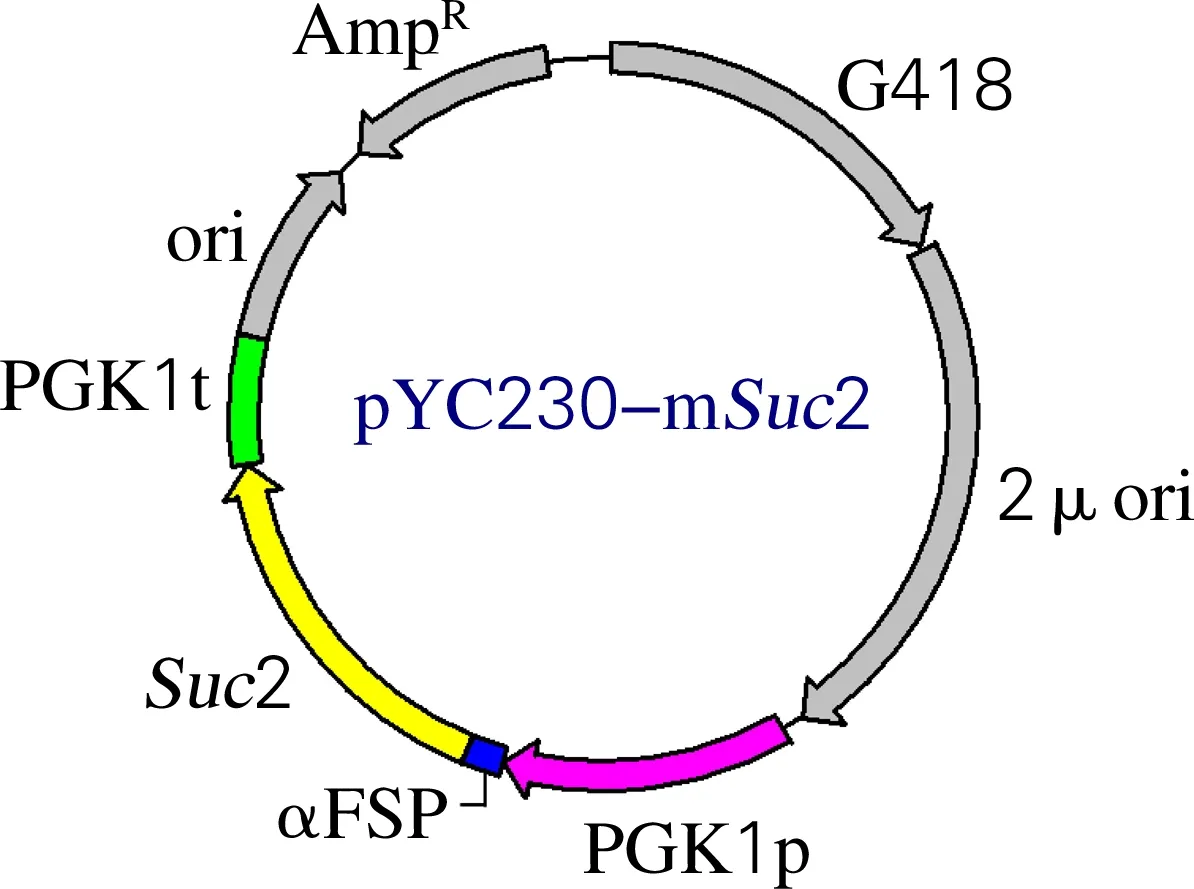
图1 质粒pYC-mSuc2示意图Fig.1 The map of plasmid pYC-mSuc2
1.2.4 分泌表达Suc2的重组酿酒酵母的构建
将鉴定正确表达的质粒pYC-mSuc2电击转化至S.cerevisiaeBY4741感受态细胞中,电压为1 500 V。电击结束后转化菌液加入增加1 mol/L 山梨醇1 mL,于30 ℃温育2 h后将转化菌液涂布于含有200 μg/mL G418抗性筛选平板上,30 ℃培养至转化子出现。挑取阳性转化子提取质粒DNA并进行PCR鉴定。鉴定正确的重组酿酒酵母命名为BY-mS。
1.2.5 分泌表达SUC2的酿酒酵母重组菌株酶活测定
将鉴定正确的重组酵母单菌落接种于10 mL的YPD种子液中,以30 ℃、200 r/min的培养条件培养24 h。种子液按照体积比1∶100接种于YPD液体培养基,于30 ℃、200 r/min摇床培养48 h。发酵培养结束后测定菌体浓度,并将发酵液稀释至OD600为4。1 mL稀释后的发酵菌液5 000g、4 ℃离心10 min得到已稀释后的发酵液上清,收集菌体重悬于1 mL 0.1 mol/L PBS缓冲溶液(pH 6.8)。
酶活测定方法:取50 μL重悬菌液或稀释后的发酵液上清与450 μL菊糖或蔗糖底物(20 g/L,pH 5.0)混匀,50 ℃水浴反应15 min。沸水浴10 min 终止反应。采用DNS法测定反应释放的还原糖[15]。
酶活定义:每分钟水解菊糖或蔗糖释放1 μmol 葡萄糖所需的酶量为1 U。
2 结果与讨论
2.1 酿酒酵母α交配因子分泌信号肽编码基因的全基因合成
由上海生工合成酿酒酵母α交配因子分泌信号肽编码基因与Suc2部分编码基因融合DNA片段被亚克隆至pUC57。构建的重组载体pUC57-αF-Suc2送TaKaRa大连宝生物公司测序,利用软件DNAStar中的MegAlign程序将测序结果与Genebank提交的αF信号肽编码序列和Suc2核苷酸序列进行比对,如图2所示。比对结果表明,全基因合成的核苷酸序列完全正确。DNA序列长度为303 bp,其中α交配因子分泌信号肽编码基因长度为60 bp。

图2 全基因合成αF-Suc2基因融合片段与数据库序列比对结果Fig.2 Sequence alignment of synthesized αF-Suc2 DNA compared with the gene data from Genebank
2.2 Suc2分泌表达载体及菌株的构建
以pUC57-αF-Suc2为模板,PCR扩增融合α交配因子分泌信号肽编码基因与Suc2部分编码基因融合片段αF-Suc2,琼脂糖凝胶电泳结果如图3所示。在300 bp附近扩增出一条特异性条带,大小与αF-Suc2目的基因片段一致。将回收的PCR产物送至上海生工测序,测序结果经NCBI数据库比对证明为αF-Suc2序列。

M,DNA marker;1,目的条带图3 PCR扩增融合片段αF-Suc2的电泳验证结果Fig.3 Agarose gel electrophoresis results of αF-Suc2 fragment
为了构建酿酒酵母蔗糖转化酶编码基因Suc2的分泌表达载体,利用RF克隆策略将Suc2自身的分泌信号肽替换为α交配因子分泌信号肽。将RF克隆产物转化至E.coliDH10B感受态细胞中,挑取阳性克隆进行质粒提取。对提取的质粒进行SalⅠ/SacⅠ双酶切以及PstⅠ单酶切验证。电泳结果如图4所示,重组质粒经SalⅠ/SacⅠ双酶切后显示有大小为3 901和5 690 bp两条特异性条带,PstⅠ单酶切后显示有大小为1 791和7 800 bp的两条特异性条带,与预测正确重组质粒的酶切结果基本一致。将酶切鉴定正确的质粒送上海生工测序,结果表明成功构建了蔗糖转化酶分泌表达载体pYC-mSuc2。
将表达载体pYC-mSuc2转化至S.cerevisiaeBY4741感受态细胞中,30 ℃静置培养,挑取阳性克隆提取重组质粒并进行PCR鉴定,琼脂糖凝胶电泳结果如图5所示。扩增产生大小为300 bp的特异性条带,与理论PCR验证DNA产物大小基本一致。该结果表明成功构建了分泌表达蔗糖转化酶的重组酿酒酵母BY-mS。
2.3 分泌表达SUC2的酿酒酵母重组菌株酶活力
将重组酿酒酵母BY-mS分泌表达SUC2的能力与未替换分泌信号肽的对照菌株BY-BS进行比较,结果如图6和图7所示。在发酵48 h条件下,BY-mS重组菌全细胞菊糖酶活力为2.6 U/mL、发酵液上清菊糖酶活力为3.4 U/mL,均显著高于对照菌株BY-BS。BY-mS重组菌全细胞蔗糖酶活力为34.5 U/mL,显著高于对照菌株BY-BS;而该菌株发酵液上清蔗糖酶酶活力为9.7 U/mL,与对照菌株无显著性差异。结果表明,相对于SUC2自身的天然分泌信号肽,α交配因子分泌信号肽的融合能够有效地提高SUC2在酿酒酵母中的分泌水平。

M,DNA marker;1,双酶切结果;2,单酶切结果图4 重组质粒pYC-mSuc2的Sal Ⅰ/Sac Ⅰ双酶切以及 Pst Ⅰ单酶切验证电泳图Fig.4 Electrophoresis results of the recombinant plasmid pYC-mSuc2 digested by Sal Ⅰ/Sac Ⅰ and Pst Ⅰ

M,DNA marker;1~6,PCR鉴定结果图5 转化有pYC-mSuc2的酿酒酵母重组菌株鉴定结果Fig.5 PCR identification results of the recombinant strain transformed with plasmid pYC-mSuc2

图6 重组酿酒酵母BY-mS和BY-BS全细胞及发酵液上清菊糖酶活力比较Fig.6 Comparison of inulinase activities in the whole cells and fermentation supernatant of the recombinant strain BY-mS and BY-BS
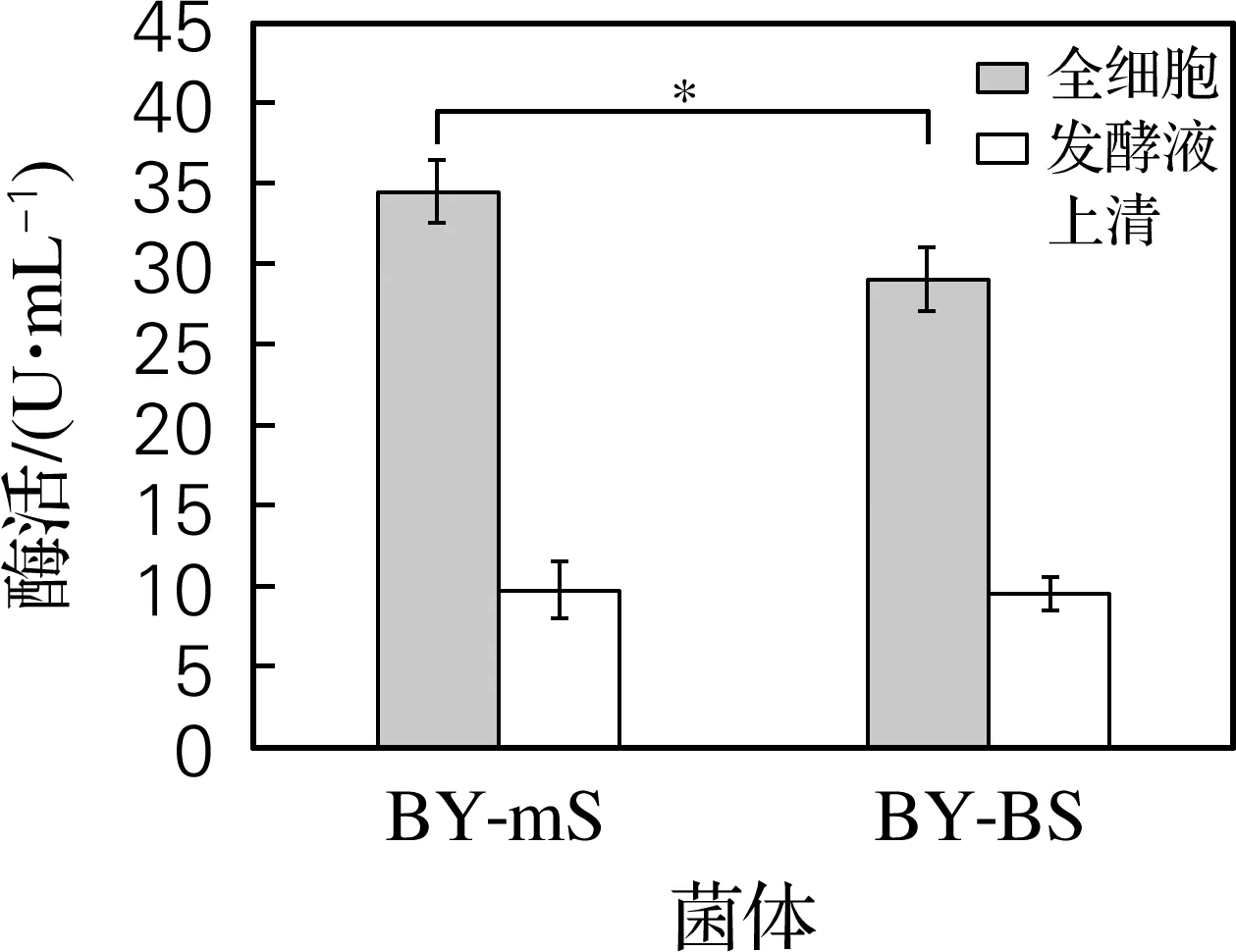
图7 重组酿酒酵母BY-mS和BY-BS全细胞及发酵液上清蔗糖酶活力比较Fig.7 Comparison of sucrase activities in the whole cells and fermentation supernatant of the recombinant strain BY-mS and BY-BS
此外,从全细胞和发酵液上清的酶活力数据可以看出,SUC2在酿酒酵母细胞中表达后,能够分泌到细胞壁和发酵液上清中。从不同分泌场所中的酶活差异可以推测出,SUC2分泌定位于细胞壁表面时的构象更加利于蔗糖酶活力的展示,而当SUC2分泌至发酵液上清中时,结构的变化导致菊糖酶活力更高。
3 结 论
全基因合成获得酿酒酵母α交配因子分泌信号肽编码基因,并将其融合至蔗糖转化酶Suc2编码基因的上游,实现了酿酒酵母中SUC2的分泌表达。当重组菌在发酵48 h时,相较于含有天然分泌信号肽的SUC2,α交配因子分泌信号肽能够有效提高SUC2在酿酒酵母中的分泌表达水平,使得重组菌株展现出更高的蔗糖酶活力及菊糖酶活力。此时,SUC2分别分泌在细胞壁和发酵液上清两个部位。当SUC2分泌在细胞壁时的构象,更加有利于展现蔗糖酶活力;而当SUC2分泌在发酵液上清时,更加有利于展现菊糖酶活力。
