18F-FDG PET/CT最大标准摄取值与局部晚期乳腺癌临床病理特征及预后的相关性
2021-02-27陈晓良
曹 林,陈晓良,李 倩
0 引 言
局部晚期乳腺癌(local advanced breast cancer,LABC)是指原发灶直径超过5 cm或存在皮肤和胸壁粘连固定、合并淋区域转移但未见远处转移的乳腺癌[1]。近十余年来,我国女性乳腺癌发病率逐年上升,其发病率位居女性恶性肿瘤首位,死亡率居女性恶性肿瘤第六位[2]。在发展中国家,LABC约占乳腺癌的60%~80%[3],LABC具有进展快、预后差的特点,部分患者治疗后短期内即可出现局部复发或远处转移,生活质量面临严重威胁,因此,治疗初期预测患者预后质量,对于指导治疗策略意义重大[4]。18F-脱氧葡萄糖(18F-fluorodeoxy glucose,18F-FDG)正电子发射计算机断层扫描(positron emission tomograpgy/computed tomography,PET/CT)能够提供解剖信息与肿瘤能量代谢信息,近年来在恶性肿瘤诊治中备受关注[5]。本研究选取18F-FDG PET/CT的最大标准摄取值(maximum standardized uptake value,SUVmax)参数,就其与LABC患者临床病理特征及预后的相关性进行研究,现报道如下。
1 资料与方法
1.1 研究对象选取2017年7月至2019年10月重庆大学附属肿瘤医院收治的154例LABC患者。纳入标准:①经粗针穿刺活检明确乳腺癌诊断,符合LABC诊断标准[6];②初诊初治患者,初诊时行18F-FDG PET/CT检查未见远处转移;③拟于我院接受序贯新辅助化疗治疗;④本地居民,能够配合长期随访要求。排除标准:①合并肿瘤胸肌浸润或为炎性乳腺癌、双侧乳腺癌;②合并其他部位恶性肿瘤。所有入组患者均为女性,年龄28~71岁,平均(48.92±6.37)岁,美国癌症联合委员会第八版乳腺癌TNM分期[7]:ⅢA期106例,ⅢB期19例,ⅢC期29例。本研究经医院伦理委员会批准(批准号:XU17025A9),所有患者均签署知情同意书。
1.2 治疗方案患者均于我院接受2~8周期的序贯新辅助化疗,其中28例接受环磷酰胺+表柔比星+氟脲苷(Cyclophosphamide + Epirubicin + Fluorouridine,CEF)方案:环磷酰胺600 mg/m2静脉滴注,d1;表柔比星90 mg/m2静脉滴注,d1;氟脲苷600 mg/m2静脉滴注,d1。67例接受多西他赛+表柔比星+环磷酰胺(Taxotere + Epirubicin + Cyclophosphamide,TEC)方案:多西他赛75 mg/m2静脉滴注,持续1 h,d1;表柔比星80 mg/m2静脉滴注,d1;环磷酰胺500 mg/m2静脉滴注,d1。49例接受多西他赛+环磷酰胺(Taxotere + Cyclophosphamide,TC)方案:多西他赛75 mg/m2静脉滴注,持续1 h,d1;环磷酰胺600 mg/m2静脉滴注,d1。其余10例接受多西他赛+卡铂(Taxotere + Carboplatin,TP)方案:多西他赛75 mg/m2静脉滴注,持续1 h,d1;卡铂200~400 mg/m2静脉滴注,d1。多西他赛给药前1 d均给予地塞米松片口服,每日1次,每次16 mg,持续3 d;多西他赛给药前5 min给予50 mg苯海拉明肌肉注射。化疗每周期为21 d。化疗结束后2周行病灶手术切除,术后根据病理结果、分子亚型开展内分泌治疗、靶向治疗或放疗。
1.3 观察指标
1.3.1 SUVmax计算患者均于化疗开始前接受18F-FDG PET/CT检查,使用GEMINI型PET/CT显像仪(荷兰Phillips公司),18F-FDG由中国原子能科学研究院广州市同位素中心提供(防化纯度95%)。患者禁食6 h,肘静脉注射18F-FDG,平静休息60 min后行PET/CT显像,自头颅至股骨上段开展扫描,数据经Ramla3D法获取衰减校正图像。由2名核医学科主任医师双盲阅片,根据PET/CT融合图像勾画乳腺病灶、腋窝淋巴结感兴趣区,由工作站自动计算SUVmax。
1.3.2 相关性分析比较不同临床病理特征、化疗疗效LABC患者SUVmax的差异,其中,化疗疗效判断标准[8]:根据化疗后肿瘤细胞消退情况分为5级,1级为浸润癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级为浸润癌细胞减少<30%;3级为浸润癌细胞减少30%~90%;4级为浸润癌细胞减少>90%;5级为原肿瘤瘤床部位已无胞或单个癌细胞。1~2级为无效,3~5级为有效;5级且区域淋巴结阴性为完全缓解,3~4级判定为未完全缓解。此外,计算所有患者SUVmax均值,将患者分别纳入≥均值组和<均值组,比较2组无事件生存时间和无事件生存率,分析SUVmax与患者预后的相关性。无事件生存:未发生局部复发或远处转移;无事件生存时间:自手术结束后首次出现局部复发或远处转移、死亡或随访终止的时间。分析影响患者预后的相关因素。
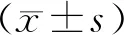
2 结 果
2.1 不同病理特征患者SUVmax检测结果肿瘤最大径≥3 cm、组织学分级低分化、T分期T3~T4、Ki-67≥14%、淋巴结转移者,其SUVmax高于肿瘤最大径<3 cm、组织学分级中高分化、T分期T1~T2、Ki-67<14%、无淋巴结转移者(P<0.05)。见表1。
2.2 不同化疗效果患者SUVmax检测结果化疗效果无效者73例、有效者81例,无效者SUVmax(4.13±0.95)低于有效者(5.54±1.34),差异有统计学意义(P<0.05)。未完全缓解者113例、完全缓解者41例,未完全缓解者SUVmax(4.57±1.12)亦低于完全缓解者(5.70±1.39),差异有统计学意义(P<0.05)。
2.3 不同SUVmax患者无事件生存率154例LABC患者SUVmax均值为4.87,SUVmax≥4.87者(n=77)较SUVmax<4.87者(n=77)无事件生存率显著降低(P<0.05),见图1。
2.4 影响患者预后的Cox回归分析Cox回归分析示,肿瘤最大径≥3 cm、组织学分级低分化、T分期T3~T4、Ki-67≥14%、淋巴结转移、SUVmax≥4.87是影响LABC患者预后的危险因素(P<0.05)。见表2。
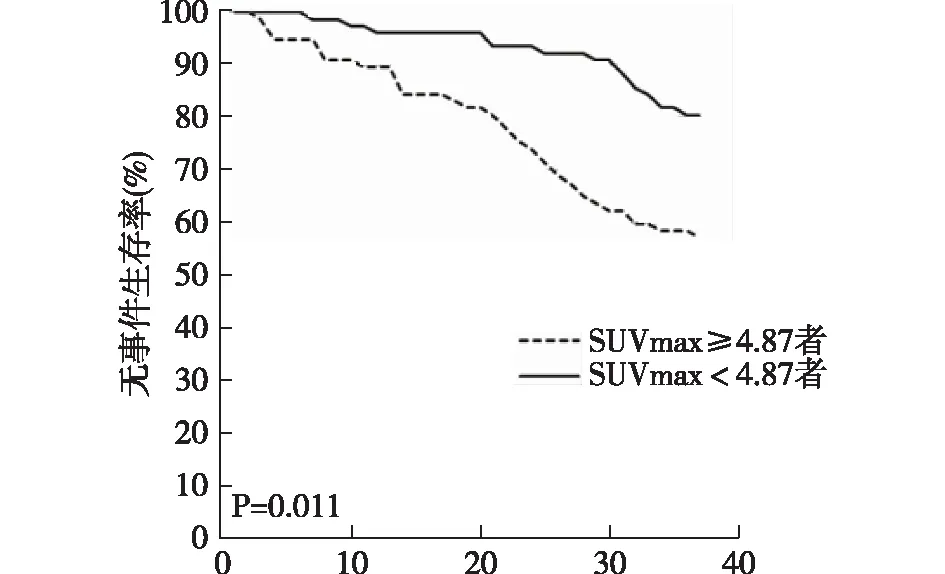
图1 不同SUVmax患者无事件生存时间及生存率
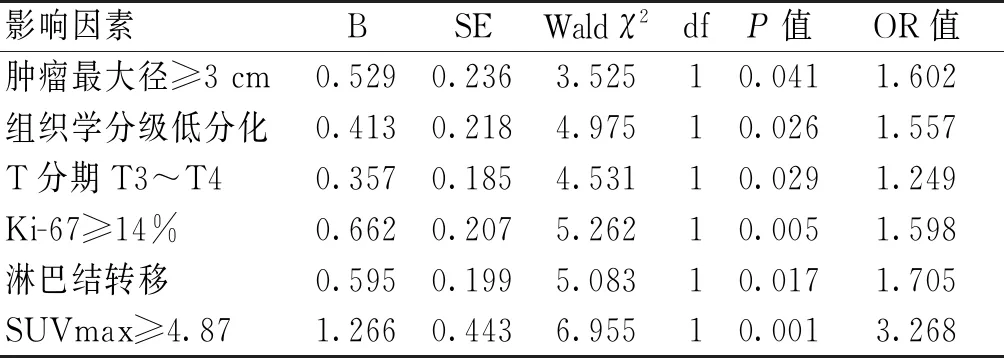
表2 影响LABC患者预后的Cox回归分析结果
3 讨 论
乳腺癌好发于40~60岁、绝经前后女性,在我国,相当一部分乳腺癌患者确诊时已进展至LABC,其切除率低、预后差且复发转移风险高,因此,准确预测LABC患者预后并积极开展个体化治疗是改善患者预后质量与生活质量的关键。
18F-FDG PET/CT显像能够自分子水平检测肿瘤代谢,通过观察病灶对18F-FDG的摄取率,能够了解病灶的葡萄糖代谢水平,从而了解肿瘤的组织细胞功能及能量代谢状态。近年来,18F-FDG PET/CT显像在乳腺癌的诊断与治疗中已得到广泛应用[9]。且有研究发现,由于18F-FDG的摄取与肿瘤细胞的增殖活性、存活肿瘤细胞数量、分化程度及微血管密度等参数均有密切关联,故能够反映肿瘤的生物学侵袭性及预后[10-11]。
SUVmax是目前18F-FDG PET/CT最常用的半定量分析指标,徐巧玲等[12]发现,原发乳腺癌的SUVmax与肿瘤大小相关,亦有研究发现,原发病灶的组织学分级、有无区域淋巴结转移也可影响肿瘤对18F-FDG的摄取[13]。本研究选取154例LABC患者,就其SUVmax进行了测量,结果显示,肿瘤最大径≥3 cm者,其SUVmax显著升高,有学者认为,SUVmax可反映恶性肿瘤细胞的数量[14],与本研究结果一致。同时,低分化肿瘤、高分期肿瘤往往具有更高的SUVmax,考虑与肿瘤恶性程度升高伴随的18F-FDG摄取能力增强有关。同时,Ki-67≥14%者,其SUVmax显著高于Ki-67<14%者,其原因考虑为:Ki-67是反映肿瘤细胞增殖活性的指标[15],其表达水平的升高意味着肿瘤增殖速度加快,故肿瘤组织对18F-FDG的摄取增加,即表现为SUVmax上升。此外,出现淋巴结转移的患者,其SUVmax亦大幅上升,说明淋巴结转移的出现也意味着肿瘤恶性程度的升高,并表现为SUVmax的增加。
在化疗效果的对比中,化疗效果有效者、完全缓解者,其SUVmax较化疗无效者、未完全缓解者更高,该结果表明恶性程度较高的肿瘤组织对化疗更为敏感,但不同分子分型LABC对化疗的敏感性不一,如HER-2过表达型、Basal-like型乳腺癌患者SUVmax普遍较高,且对化疗更敏感。总体而言,对于SUVmax较高的LABC患者,积极开展新辅助化疗有望使患者获益。而在无事件生存时间的对比中,可以发现,SUVmax较高者无事件生存率更低,考虑与肿瘤恶性程度高、淋巴结转移有关;由于新辅助化疗病理完全缓解是延长无病生存期的重要指标,因此对于SUVmax较高且新辅助化疗无效、未完全缓解的患者而言,应高度重视其复发、转移风险,缩短随访周期并探索其他可能有效的治疗方案。本研究Cox分析结果也印证了上述结论。
综上所述,18F-FDG PET/CT SUVmax与LABC肿瘤最大径、组织学分级、T分期、Ki-67及淋巴结转移有关,随着SUVmax的升高,患者对化疗的反应增强,但术后无事件生存期更短,应根据患者SUVmax评估其预后质量,并结合临床病理特征积极开展个体化治疗。
