儿童眶底及上颌窦前壁原始神经外胚层肿瘤/尤文氏肉瘤的临床分析
2021-02-27焦红叶汪小霞
焦红叶,潘 晗,施 涛,汪小霞,周 玫,陈 伟,张 勇
0 引 言
原始神经外胚层肿瘤(primitive neurotodermal tumour, PNETs)和尤文氏肉瘤(Ewing sarcoma,ES)是起源于神经外胚层细胞的小圆细胞肿瘤,它们通常在儿童时期被诊断,起源于骨骼、神经系统和软组织[1]。从病理学和遗传学角度看,PNETs与ES关系密切,长期以来认为PNETs来源于间充质干细胞。最近,电子显微镜和免疫组织化学技术的研究发现了ES细胞的神经上皮来源,两者的临床特点、免疫组化表型、超微结构、治疗及临床预后有很多共同点,因此它目前被认为是PNETs的一员[2]。与ES相比,PNETs表现出更好的神经分化,包括中央PNETs和外周PNETs。外周PNETs(pPNETs)主要发生于胸肺区、骨盆和下肢的软组织。ES和pPNET均表现出相同的染色体易位,如t(11;22)(q24;q12),被WHO(2002)纳入同一类ES肿瘤家族(Ewing sarcoma family tumors,ESFTs)。ESFTs发病率很低,发生于头颈部者更鲜有报道。我院曾于2018年10月收治1例儿童眶底及上颌窦前壁ESFTs患者,手术后予以放化疗,目前随访结果表明治疗效果良好。现结合该例患者的临床资料并回顾文献资料,报告1例罕见的儿童眶底及上颌窦前壁ESFTs患者的预后,引导临床医师更好地认识这一罕见疾病。
1 资料与方法
患儿,男性,8岁,以“发现右侧鼻旁肿物伴右眼溢泪1月余”于2018-10-16日收入我科,患者于入院前1个月偶然发现右侧鼻翼旁下眼睑下缘肿物,约鹌鹑蛋大小,无痛,伴右眼溢泪,无明显压痛,病史中无明显鼻塞、流涕,无明显鼻痒、打喷嚏,无面颊部麻木、复视,无鼻腔异味,嗅觉可。初起症状较轻,患者未予重视。其后右眼溢泪症状反复出现,在当地医院检查后诊断为右侧上颌骨肿物。专科检查:右面眶下区可触及一大小约1.5 cm×2 cm的软组织肿块,质地硬,边界欠清,活动度差,无按压痛,表面皮肤无红肿,无破溃。CT检查示右侧上颌骨体内缘浸润性骨质破坏,并右侧上颌骨额突旁见类圆形软组织密度影,大小约18 mm×23 mm,边界欠清,肿块向上突入右眼眶,右侧上颌窦粘膜局部增厚,见图1。右侧上颌骨额突旁骨质破坏并软组织肿块,考虑恶性肿瘤性病变,骨肉瘤可能。初步诊断:右侧眶底及上颌窦前壁肿瘤。2018年10月25日在我院行右侧上颌肿瘤扩大切除+右眼及眶内容物扩大切除术,术中见肿瘤位于右侧鼻翼旁下眼睑下缘,肿瘤侵犯上颌窦及右侧眶底,骨质破坏,血供极为丰富,自左侧睑缘作切口,切开皮肤,自皮下将组织瓣翻起,显露肿瘤,肿瘤外观呈鱼肉状,质地较韧。术后病理结果:光镜下由核质比高的小圆细胞组成,弥漫性生长,大小相对一致,核大深染,核仁较小,细胞富含糖原,胞质稀少透亮;可见坏死和核分裂象;见图2。免疫组化染色结果示:肿瘤细胞CD99(3+),S-100(1+),SOX10(-),desmin(-),MyoD1(-),CgA(-),Syn(-),CD56(灶+),CKpan(-),CD20(-),CD3(-),Ki-67(+),见图3。术后病理结果:高度恶性小圆细胞肿瘤,结合免疫组织化学标记结果,考虑为ESFTs。眼球和视神经未见肿瘤组织侵犯,睑板腺及其周围组织慢性炎。
2 结 果
术后患者于当地医院予以局部放疗和药物化疗,局部放疗总剂量60 Gy/30次。化疗方案为依托泊苷(VP-16)0.1 g d1-3+异环磷酰胺1.0 g d1-3化疗6个疗程。术后1年复查MRI示右眼眶肿瘤术后改变,见图4。2020-01-20行PET-CT示右眼眶ES术后,术区软组织影,未见异常高代谢,考虑术后改变。术后随访21个月未出现肿瘤复发以及及远处转移征象,目前继续跟踪随访。
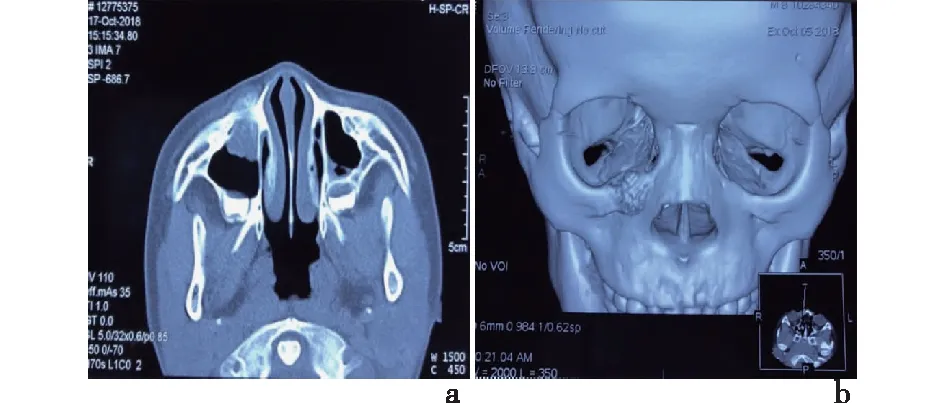
a:图示右侧上颌骨额突旁见类圆形软组织密度;b:图示肿块向上突入右眼眶图1 ESFTs患儿CT扫描表现
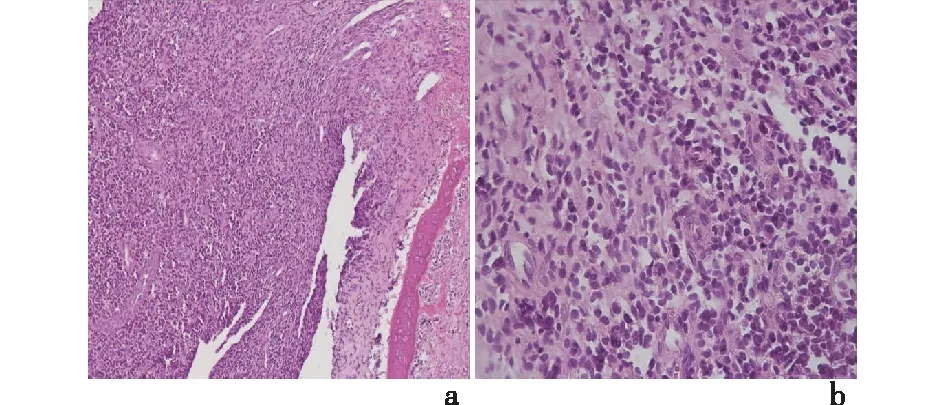
a:肿瘤细胞弥漫浸润,片状密集分布(HE ×100);b:肿瘤细胞核圆,胞质稀少、核深染(HE ×400)图2 ESFTs患儿肿瘤组织的光镜表现

a:(×100);b:(×200)图示肿瘤细胞CD99蛋白表达弥漫性阳性图3 ESFTs患儿肿瘤组织的免疫组织化学染色结果

图4 ESFTs患儿术后1年复查MRI示右眼眶肿瘤术后改变
3 讨 论
从组织学、遗传学和临床角度来看,ES和PNETs相似,因为它们的特征是小而圆的蓝色细胞,重要的是由于它们的转移潜能,临床表现不佳,预期寿命较低。由于中央PNET具有不同的遗传异常特征,因此只有Ewing肉瘤和pPNET属于同一个肿瘤家族,称为ESFTs[3]。
3.1 临床特征ESFTs有浸润性,主要是儿童和青少年恶性肿瘤,容易出现局部复发及远处转移,ESFT肉瘤有潜在的血行转移,最常见的转移部位包括肺、骨和骨髓。该病发病的高峰年龄大集中在20岁以下,男性略高于女性[4]。本例患者年龄8岁,为ESFTs的高发年龄阶段,符合这一年龄分布特点。大多数ESFTs原发于四肢长骨的近端骨骺、骨干处及骨盆区,原发于眶底及上颌窦前壁者则极为罕见。临床表现与发生的部位、肿块的大小以及有无远处转移密切相关。临床表现主要为病程短、生长迅速、局部疼痛、肿块以及肿块所引起的压迫症状,病情进展快,早期即可发生远处转移。但本例患儿病变部位为眶底及上颌窦前壁,仅表现为右侧鼻翼旁下眼睑下缘肿物伴右眼溢泪,无鼻塞、流涕及涕中带血等症状,鼻腔检查正常,并无局部疼痛表现,临床极少见,容易被误诊误治。
3.2 影像学表现ESFTs的影像学常为溶骨性骨质破坏和肿块影。该患者的影像学结果没有特征性,与其他恶性肿瘤相似,使得该疾病的诊断较困难,误诊率较高。因此,当发生于上颌骨骨体骨质破坏并软组织肿块,应考虑恶性肿瘤可能,但确诊仍要结合免疫组化及病理学结果。影像学检查对判断病灶的可切除性和拟定手术方案,评估肿瘤复发和转移情况有很大价值[5]。
3.3 病理组织学、免疫组织化学检查特点ESFTs的诊断主要依靠免疫组化以及病理学结果。根据现有病例总结,ESFTs的病理学特点主要为:光镜下由核质比高的小圆细胞组成,弥漫性生长,大小相对一致,核大深染,核仁较小,细胞富含糖原,胞质稀少透亮,可见坏死及核分裂象。大多数患者的免疫组化结果显示CD99在其细胞膜上呈强阳性表达,这足以说明CD99对ESFTs的诊断有重要意义。本文报道病例中,其镜下形态表现及CD99染色为阳性与多数文献报道的ESFTs表现极为相符,进一步明确了ESFTs的诊断。此外,检测肿瘤细胞的增殖活性的指标Ki67(细胞核增殖相关抗原)的高低决定了肿瘤恶性程度的高低,在本病例中,Ki67的表达阳性,提示该患者的预后较差。此外,融合基因编码的异常转录基因是促使肿瘤发生的基础,特异性染色体异位及其融合基因检测对ESFTs的原发诊断以及检测肿瘤是否存在转移或残留病变具有重要意义[6]。
3.4 鉴别诊断仅靠光镜很难将ESFTs与其他小圆细胞肿瘤区分开,免疫组化染色有助于鉴别ESFTs和这些小圆细胞恶性肿瘤。CD99是一种由MIC2基因编码的跨膜糖蛋白,大部分的ESFTs肿瘤胞膜上几乎均表达CD99,而其他小圆细胞恶性肿瘤的胞膜上CD99几乎不表达,并且程度不一的表达NSE、Syn、S-100蛋白等[7]。本例患者的确诊主要基于免疫组化的结果:CD99的高表达排除了神经母细胞瘤的诊断;MyoD1及结蛋白Des的阴性表达可排除肌源性肿瘤;Syn的阴性表达可排除神经内分泌肿瘤的诊断。因此,特异性染色体异位和CD99表达阳性的同时存在有助于ESFTs与其它小圆细胞恶性肿瘤相鉴别。
3.5 治疗及预后由于ESFTs极具浸润性,生长迅速,发病率低,流行病学资料缺乏[8]。外科手术是ESFTs的主要治疗手段[9],应尽可能地进行。ESFTs的治疗方法包括新辅助化疗获得的根除微转移性疾病以促进有效的局部控制,增加术后获得病理阴性边缘的可能性;确定的放射疗法或外科疗法,以消除所有可见的疾病,以及以化疗或放疗为基础的辅助治疗。重要的是,新辅助化疗不仅可以改善手术后的预后,还可以提供有关疾病化疗敏感性的信息[10]。但由于这种疾病的罕见性,对于最佳的化疗时间和使用的方案仍缺乏共识[11]。在疾病进展的情况下,没有标准化的二线治疗计划,需要根据疾病复发的部位和之前的治疗来考虑,长春新碱/伊立替康/替莫唑胺等化疗联合用药似乎是有效的选择[12]。放疗一般在术后进行,效果比较肯定,我们给予60 Gy,未出现并发症。本例患者病程短,发展快,影像学结果提示骨质破坏且侵犯眼眶,该例患者接受手术彻底切除肿瘤,术后结合放化疗,目前随访21个月未见肿瘤复发和远处转移。该结果主要是因为肿瘤发生于体表,易于早期发现,治疗及时,并予以手术彻底切除。ESFTs在指南中尚无明确靶向药物推荐,鉴于一些独特的遗传特征,如染色体易位(11;22)导致嵌合蛋白(EWS-FLI1)的异常产生,能够促进细胞周期、血管生成和转移。目前,胰岛素样生长因子1受体(IGF-1R)途径和多聚ADP-核糖体-聚合酶(PARP)途径正在研究潜在的靶向治疗,IGF-1R是酪氨酸激酶受体的一员,与细胞内的通路相连,能够促进细胞存活和生长。结论是IGF-1R诱导可以抑制EWS-FLI1诱导的细胞生长。由于IGF-1与ESFTs生长相关,针对这一潜在靶点的单克隆抗体已在6个不同的Ⅱ期试验中进行评估,共对291例ES患者进行了试验,观察到2例(1%)完全应答(CR),32例(11%)部分应答(PR),其中一些是持久的,61例(21%)是稳定的疾病(SD)[13]。最近,有研究者对上述数据进行了解释,认为IGF-1R通路是ES的一个有趣的靶点,应该进行进一步的探索[14-15]。因此,ESFTs的药物靶向治疗前景十分值得期待。
ESFTs是一种极其罕见的高度恶性肿瘤,表现出不同程度的神经分化,但也有共同的细胞遗传学和分子特征。常见的治疗方案为手术以及放化疗。头颈部区域肿瘤的解剖结构相对复杂,目前头颈部ESFTs缺乏具体的治疗建议,如果患者全身状态能耐受手术,完整手术切除病灶应是肿瘤治疗的第一步,术后配合放疗和化疗,已经成为ESFTs有效的治疗方案,可明显改善患者的预后,有望能延长存活时间,但最佳治疗策略还需要在临床实践中进一步探索研究。
