红细胞分布宽度对老年心力衰竭患者全因死亡的预测价值
2021-02-27王晓旭
王晓旭,葛 平
(重庆医科大学附属第一医院第一分院心内科,重庆 400015)
心力衰竭是多种原因导致心脏结构和(或)功能异常改变,使心室充盈和(或)射血功能受损,心排血量不能满足机体组织代谢需要,以肺循环、体循环淤血,器官、组织血液灌注不足为临床表现的一组临床综合征,临床表现为呼吸困难、疲乏、液体潴留等[1]。心力衰竭是各种心脏疾病的严重表现或晚期阶段,流行病学调查发现在发达国家心力衰竭患病率为1%~2%,但随年龄增长、70岁以上老年人心力衰竭患病率大于或等于10%[2]。目前我国人口老龄化加剧,截至2015年底,我国大于60岁的老年人口已达2.22亿,并且高血压、冠心病(CHD)等疾病发病率逐年升高,我国心力衰竭患病率呈上升趋势,其中80岁以上的人群心力衰竭患病率近12%,其病死率居高不下,其死亡原因依次为左心衰竭、心律失常、心源性猝死等[3]。目前临床中广泛使用B型利钠肽(BNP)或N末端B型利钠肽原(NT-proBNP)作为生物标志物对心力衰竭患者进行筛查、诊断,病情严重程度及预后的评估[4]。
红细胞分布宽度(RDW)是全血细胞计数分析时的常规检测项目,是血常规报告中的常规检测指标。RDW反映红细胞体积的异质性,多数仪器用所测红细胞体积大小的变异系数,即RDW-CV表示。临床主要用于贫血形态学分类、缺铁性贫血的诊断及鉴别诊断。而近年发现除血液系统疾病外,RDW的升高还与心血管疾病,如心力衰竭[5]、心肌梗死[6]及脑卒中[7]等疾病密切相关的。并且研究发现在慢性心力衰竭患者中RDW升高与其不良临床预后、全因死亡率密切相关[8-9]。虽然研究报道RDW对心力衰竭患者死亡率的预测价值并不如NT-proBNP[10],但RDW具有检测便利、检测费用低、临床易获得等优势,且其与NT-proBNP联合时有利于提高对心力衰竭患者的全因死亡率的预测能力[11],因此本研究将评估在老年心力衰竭患者中RDW对其全因死亡的预测价值,以及进一步探索与NT-proBNP相比及联合时对心力衰竭患者全因死亡率的预测价值。
1 资料与方法
1.1一般资料 选取2018年1—12月在本院住院治疗确诊为心力衰竭的178例老年患者。纳入标准:(1)年龄均大于65岁;(2)心力衰竭诊断均符合2018《中国心力衰竭诊断和治疗指南》;(3)临床资料齐全,入院当天及第2天完成血常规等生化检查。排除标准:(1)合并严重感染;(2)存在严重肝、肾功能不全;(3)存在恶性肿瘤、自身免疫性疾病、血液系统疾病。
1.2方法
1.2.1临床资料收集 收集入选患者的一般资料,包括性别、年龄、体重、身高、血压、吸烟史、既往病史等。入院当天及第2天完善包括血常规、NT-proBNP、电解质、肝功能、肾功能、血脂、空腹血糖、糖化血红蛋白等实验室检查。入院3 d内由专业超声科医生利用彩超心动图测量左心室舒张末期内径(LVEDD)、左心室射血分数(LVEF)。继续随访患者1、3、6个月及1年的临床资料,若患者已出院则电话随访出院后的病情变化,终点事件为上述随访期内患者的全因死亡。
1.2.2分组方法 收集患者入院 24 h 内血常规及RDW的检验结果,随访其1年内全因死亡情况。再利用受试者工作特征(ROC)曲线分析,获得RDW预测慢性心力衰竭患者死亡的最佳截断值。再根据RDW的截断值将上述患者分为高RDW组、低RDW组。

2 结 果
2.1RDW与心力衰竭患者分组 在随访1年时间内,178例患者中28例患者死亡,总死亡率为15.73%。以RDW值来预测心力衰竭患者死亡的ROC曲线分析,其AUC为0.790(P<0.001),RDW预测心力衰竭患者死亡的最佳临床截断值为14.55%,其敏感度为0.679、特异性为0.800。见图1。再将178例心力衰竭患者分为2组,分别为低RDW组(<14.55%)129例、高RDW组(≥14.55%)49例。
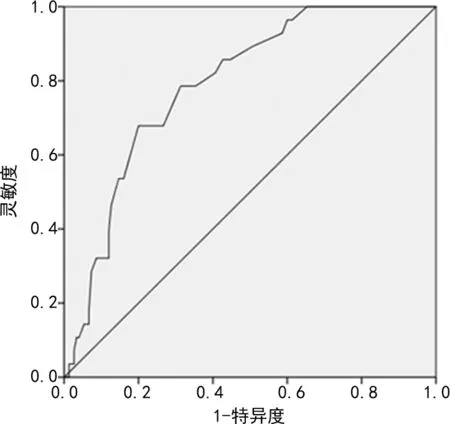
图1 RDW预测心力衰竭患者死亡的ROC曲线图
2.2低RDW组与高RDW组临床基线资料比较 2组患者年龄、性别、吸烟、高血压、糖尿病、血压、体重指数,以及实验室检查中糖化血红蛋白、血肌酐、尿酸、血脂、电解质等均无明显差异(P>0.05)。但与低RDW组相比:高RDW组心力衰竭患者中合并CHD、慢性阻塞性肺疾病(COPD)、心房颤动(AF)的比例均显著升高(P<0.05)。心力衰竭相关的指标中与低RDW组相比:高RDW组患者NYHA心功能分级中Ⅲ~Ⅳ级所占比例、NT-proBNP水平及心脏彩超所示LVEDD均显著升高,而LVEF显著降低(P<0.05)。实验室检查中与低RDW组相比:高RDW组患者空腹血糖水平升高,而血清清蛋白水平降低,差异均有统计学意义(P<0.05)。见表1。
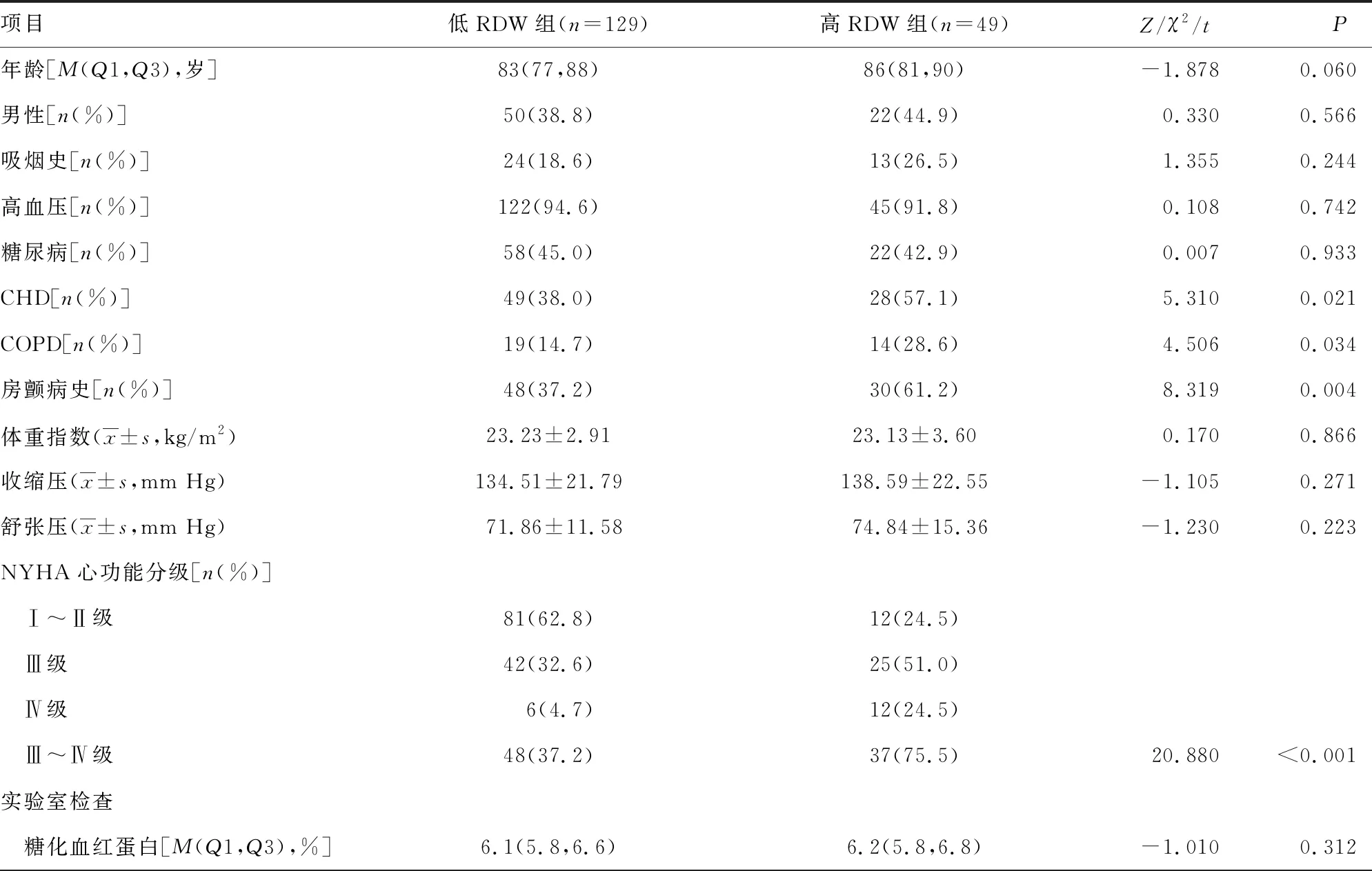
表1 低RDW组与高RDW组临床基线资料比较

续表1 低RDW组与高RDW组临床基线资料比较
2.3RDW与心力衰竭患者近远期全因死亡率 在随访1年时间内,178例患者中28例患者死亡,其中高RDW组死亡19例、低RDW组死亡9例。高RDW组在近期(1、3个月)和远期(6个月、1年)的死亡率均高于低RDW组,差异有统计学意义(P<0.05)。同时心力衰竭患者中高RDW组在随访第1个月死亡风险最高,其相对危险度(RR)是低RDW组的 7.898倍[95%可信区间(95%CI)1.694~37.816]。见表2。Kaplan-Meier生存分析结果显示,高RDW组在1年内的累积生存率明显低于低RDW组,log-rank检验显示2组间比较,差异有统计学意义(P<0.001),提示心力衰竭患者中高RDW组患者预后更差,见图2。以所有心力衰竭患者1 年内的存活情况为因变量(死亡=1,存活=0),以高RDW组与低RDW组患者临床特征中有显著统计学差异的指标为自变量(包括患CHD、COPD、AF等基础病史,NYHA心功能分级,空腹血糖,清蛋白,LVEDD,LVEF,NT-proBNP),其中定义高RDW组=1、低RDW组=0,定义患CHD、COPD、AF均等于1、未患上述3种疾病=0,定义心功能Ⅲ~Ⅳ级=1、心功能Ⅰ~Ⅱ级=0,其余自变量取各自的具体数值,采用 Cox 比例风险模型进行多变量统计分析,结果显示逐步校正患者病史、心功能分级、LVEDD、LVEF等相关因素后,与慢性心力衰竭患者1年内的全因死亡相关的危险因素有RDW、NT-proBNP(P<0.05),见表3,故RDW、NT-proBNP是心力衰竭患者全因死亡的独立危险因素。

表2 低RDW组与高RDW组近远期全因死亡率比较[n(%)]

图2 低RDW组与高RDW组1年内的累积生存曲线
2.4对比RDW、NT-proBNP对心力衰竭患者死亡的预测价值 RDW的AUC为0.790(P<0.001),而NT-proBNP的AUC为0.928(P<0.001),其最佳临床截断值点为2 229 ng/mL,其敏感度为1.000、特异性为0.793。NT-proBNP对心力衰竭患者1年内全因死亡的预测价值优于RDW。见图3、表4。
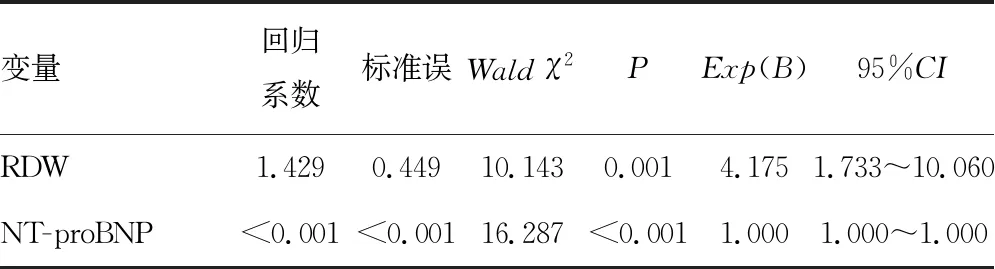
表3 慢性心力衰竭患者全因死亡的Cox比例风险模型多变量分析

图3 各指标预测心力衰竭患者死亡的ROC曲线图

表4 预测心力衰竭患者死亡的ROC曲线分析
2.5联合RDW、NT-proBNP评估心力衰竭患者的预后 当联合RDW、NT-proBNP对心力衰竭患者1年内全因死亡进行ROC曲线分析时,发现联合RDW与NT-proBNP的AUC最大为0.933,提示两者联合的预测价值略高于单独NT-proBNP。根据NT-proBNP的截断值从本研究178例心力衰竭患者中筛选出NT-proBNP大于2 229 ng/L的61例患者设为高NT-proBNP组,再将高NT-proBNP组分为高NT-proBNP/高RDW组(≥14.55%)、高NT-proBNP组/低RDW组(<14.55%)。高NT-proBNP/高RDW组与高NT-proBNP/低RDW组对比显示,2组近期(1、3个月)死亡率无显著差异,但远期(6个月、1年)死亡率前者明显高于后者,差异有统计学意义(P<0.05)。见表5。Kaplan-Meier 生存分析结果显示,高NT-proBNP/高RDW组在1年内的累积生存率明显低于高NT-proBNP/低RDW组,log-rank检验显示2组间差异有统计学意义(P=0.043),提示心力衰竭患者中同时具较高水平NT-proBNP、RDW的预后更差。见图4。
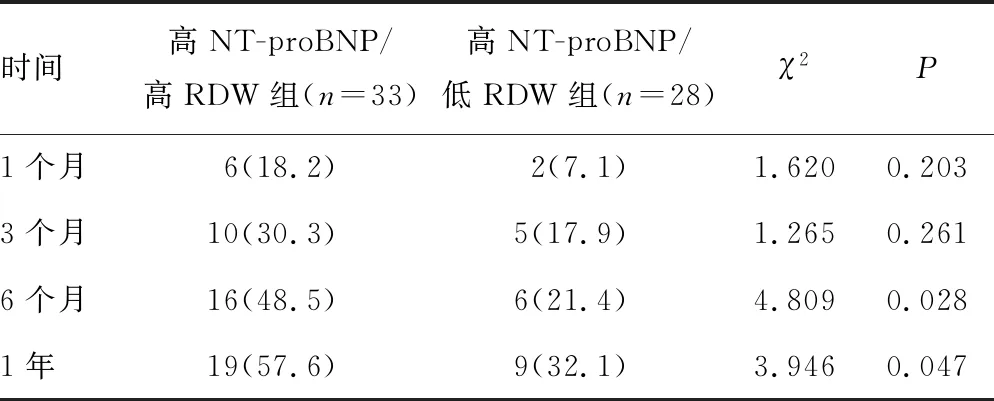
表5 高NT-proBNP/低RDW组与高NT-proBNP/高RDW组近远期全因死亡率比较[n(%)]

图4 高NT-proBNP/低RDW组与高NT-proBNP/高RDW组1年内的累积生存曲线
3 讨 论
正常成熟红细胞通常大小较一致,而病理状态下可出现小红细胞、大红细胞、巨红细胞的红细胞体积异常。本研究中RDW使用RDW-CV表示,RDW指标升高反映的是红细胞大小不均。除血液系统疾病以外,能引起RDW发生改变的临床因素包括炎症、年龄增长、机体营养失衡、肾功能异常等[5]。当机体发生炎性反应时氧化应激增强导致红细胞膜易碎性增加、红细胞破坏增多、存活红细胞减少,且炎症还能抑制促红细胞生成素(EPO)生成,均使外周存在更多未成熟的红细胞、导致RDW升高[12]。本研究发现高RDW(≥14.55%)组患者NYHA心功能分级Ⅲ~Ⅳ级的比例增加,且心脏彩超显示其LVEDD增大、LVEF降低,提示RDW的升高与心功能减退、恶化相关,心力衰竭伴随慢性炎症状态,循环中细胞炎症因子如肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)、IL-6增加,它们可抑制EPO的生成、降低红细胞祖细胞对EPO的敏感性并减少铁元素在红细胞生成中的利用率,从而影响红细胞生成[13]。尤其在老年人中,常伴随肾功能损害,也可引起EPO生成减少。另外,当机体营养失衡如出现铁缺乏[14]时也会使RDW值升高,而在慢性心力衰竭患者中易发生铁缺乏[15]。故老年心力衰竭患者存在上述原因均可导致红细胞不均一性增加而使RDW升高。本研究通过ROC曲线获得RDW预测心力衰竭患者全因死亡的截断值为14.55%,再将178例随访患者分为高RDW组、低RDW组,发现高RDW组患者近远期全因死亡率明显增加,根据Cox比例风险模型分析结果也说明RDW是预测心力衰竭患者全因死亡的独立危险因素。同时本研究发现高水平NT-proBNP(>2 229 ng/L)中高RDW组患者的1年累积生存率较低RDW组明显降低,说明NT-proBNP、RDW同时处于较高水平时心力衰竭患者的预后更差。CHD是心力衰竭最常见的病因,本研究发现高RDW组的心力衰竭患者中合并CHD较低RDW组比例显著升高,近年研究证实高水平RDW与冠状动脉疾病密切相关,如急性冠状动脉综合征、急性ST段抬高型心肌梗死[16-18]。此时RDW的升高可能与CHD患者体内炎性反应、氧化应激增强有关[19]。AF是心力衰竭患者最常合并的心律失常,常同时存在、相互促进,二者合并时死亡风险更高[20]。AF患者也存在炎性反应及氧化应激增强[21],而本研究中高RDW组中合并AF比例也显著升高,有文献报道RDW升高与AF发病率密切相关[22],而且RDW升高还能预测AF患者不良临床结局[23]。另外,COPD也是心力衰竭常见并发症,心力衰竭与COPD共存的现象常在老年人中出现,其心肺功能相互负性影响可增加死亡率[24],本研究还发现高RDW组心力衰竭患者中合并COPD比例也显著升高,并且RDW水平升高还与COPD患者不良临床预后相关[25]。故高RDW组患者中合并CHD、AF、COPD比例明显增高,且RDW被发现与上述疾病发病率及其不良预后密切相关,上述心力衰竭并发症可加速慢性心力衰竭进程,使不良临床结局风险增加。
另外,血清清蛋白水平反映机体营养状态,本研究中高RDW组患者血清清蛋白水平较低RDW组显著下降,研究也发现心力衰竭合并低蛋白血症的患者,其死亡风险较正常蛋白组增高[26]。如前所述,RDW升高提示红细胞大小不均一性的增加,其中红细胞可变形性、携氧能力下降,进而减少包括心肌细胞在内的外周组织及细胞的氧供;同时异常的红细胞可通过促进炎性反应及心肌细胞应激、凋亡,进而参与心肌纤维化病理进程,故RDW升高、红细胞不均一性增加本身可使心力衰竭加重、恶化[27]。
综上所述,RDW具备检测费用低、临床易获得的优势,其值升高反映的是红细胞不均一性增加,是老年心力衰竭患者全因死亡的独立危险因素,与CHD、COPD、AF心力衰竭并发症发病率密切相关,并且具高水平NT-proBNP伴RDW升高的患者全因死亡率增高,而联合NT-proBNP、RDW对心力衰竭患者全因死亡预测价值又优于单独NT-proBNP。故联合RDW、NT-proBNP有助于提高对老年心力衰竭患者全因死亡的预测价值,但本研究存在不足之处,包括研究的样本量偏小且收集的患者平均年龄在80岁以上,未来研究需要扩大样本量、增加年龄范围,从而获得RDW预测老年心力衰竭患者的参数标准,使之能一定程度上指导临床。
