人工髋关节组合界面微动腐蚀研究进展*
2021-02-27吴东升张亚丽张小刚张国贤靳忠民
吴东升 张亚丽 张小刚 崔 文 张国贤 靳忠民
(1.西南交通大学机械工程学院,摩擦学研究所 四川成都 610036;2.西南交通大学材料先进技术教育部重点实验室 四川成都 610036)
生命在于运动,而运动的基本保障是健康灵活的关节。关节疾病导致的运动受限极大地降低了生活质量。人工关节置换术是治疗关节疾病和创伤最成功的治疗手段之一,通过手术提高了患者髋部运动范围和活动能力,减轻了患者的病痛。然而,目前人工关节的寿命大约为10~15年,显然不能满足现代生活节奏和老龄化的社会需求,其功能远远达不到临床要求,约有20%的患者尚不满意。人工关节置换术后仍然存在如无菌性松动、关节假体脱位、骨溶解、术后感染和假体断裂等失效问题。其中由磨屑导致的无菌性松动是影响人工关节使用寿命和远期疗效最常见的并发症,也是导致假体失败的最常见原因(如图1所示)。

图1 人工髋关节置换后常见的临床问题(a)磨粒反应[1];(b)无菌性松动[2];(c)假体脱位[1];(d)骨溶解[1]
很多学者在滑动面设计优化和固定面改进方面都做了大量研究,新的研究成果使得关节滑动面的磨损降低了约50%,但是仍然存在很多人工关节失效的临床问题,其主要原因在于关节组合部件结合面之间微动腐蚀。在典型生理活动中,髋关节组合界面受到微动与腐蚀2种机制的共同作用:在外界交变载荷作用下产生微米级(典型如0~38 μm)的相对运动[3-4],这种运动导致金属表面钝化层的剥落与再钝化,同时伴随在生理环境下表面氧化膜的生成和破坏[5],如此循环往复导致植入物的失效(如图2所示[1])。

图2 人工髋关节组合面微动腐蚀机制[1]
人工关节产品大部分采用组合式连接,如图3所示。研究者们普遍认为:在全髋关节中球头与股骨柄锥形连接处产生微动腐蚀,直接影响假体寿命。一方面,由于人体环境的复杂性,人工关节滑动面同时承受三维动态运动和力,而滑动面的摩擦通过组合件界面进行传递,从而导致组合件之间产生微动,并在体液作用下承受复杂的微动腐蚀,如不同金属材料的配副在组合界面处,伴随着电偶腐蚀、大直径球头和较小的颈干角增加了组合界面的力矩、炎症因子等,体液环境的变化会在组合部位产生芬顿反应加速腐蚀;另一方面,手术操作过程中医生的装配力和装配角度决定了组合界面间的连接强度,装配过程中血液和骨屑的污染会增加腐蚀倾向,病人的活动度和身体质量指数等则对组合界面处的力学环境影响较大,这些因素都将直接影响组合界面的微动腐蚀,进而影响假体的寿命。
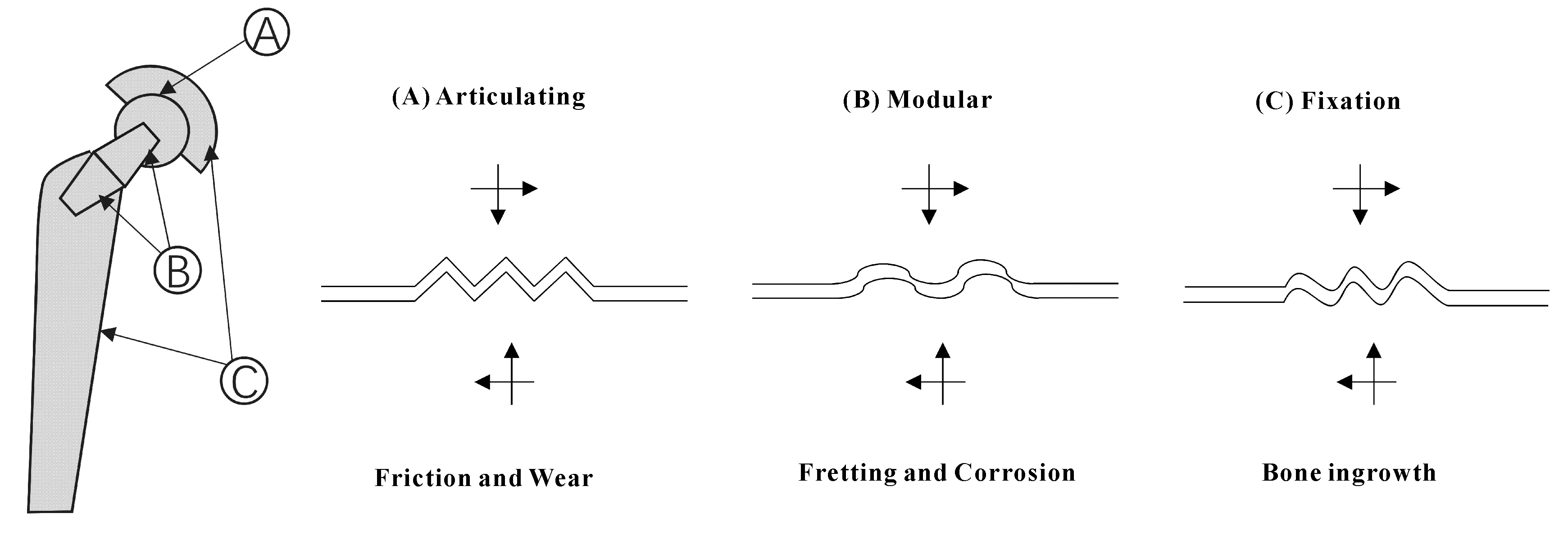
图3 人工髋关节各接触面的损伤模式
综上可知:由于服役环境的复杂性、手术操作的规范性,以及每个患者的个体差异等多因素的影响,使得人工关节组合式部件之间的微动腐蚀机制非常复杂,单因素的微动腐蚀行为研究很难揭示复杂生理环境下人工髋关节的微动腐蚀损伤机制,从而导致无法解决人工关节寿命不足的临床问题。因此,本文作者从假体组合方式、组合界面材料、设计参数、手术操作及患者和生理因素等5个方面对人工髋关节植入物组合界面微动腐蚀性能的研究成果进行综述,提出人工髋关节组合界面微动腐蚀性能的研究方向,为新一代髋关节的优化设计及临床研究提供一定的参考和指导。
1 微动腐蚀的影响因素
1.1 假体组合方式
髋关节球头滑动承载面主要分为4种形式:金属对金属(MoM)、金属对聚乙烯(MoP)、陶瓷对陶瓷(CoC)和陶瓷对聚乙烯(CoP)。对临床取出物的研究表明:在以上4种组合方式的组合界面附近的组织中,都不同程度地存在着微动腐蚀产生的金属磨屑[6-10],而股骨头和髋臼杯间关节支承面上的摩擦转矩是影响微动腐蚀程度的重要因素之一。MoM型承载面,特别是具有大直径且在恶劣条件下的金属表面可以产生更高的摩擦扭矩,并将扭矩传递至组合界面,导致在锥形界面处产生严重的微动腐蚀行为。LANTING等[11]分别对MoM和MoP型假体取出物的磨损量进行了测量,结果表明:MoP型假体在头颈部位的磨损量仅为MoM型假体的1/6(如图4所示)。SENTUERK等[12]研究表明:与其他承载方式相比,CoC承载方式具有更好的润滑性能、较低的摩擦因数和优异的化学稳定性。而HERNIGOU等[13-15]研究发现:使用CoC型承载方式后,假体发生磨损和骨溶解、累积的长期脱位风险、肌肉萎缩和头颈部腐蚀等现象都有所减少;与CoC相比,在使用CoP的160对髋臼中,100%的髋臼和股骨均有溶骨性损伤,且头颈部位的微动现象更严重。

图4 MoP和MoM型假体头颈部位材料磨损量[11]
近年来,双动球头由于能够提高患者术后的活动度而得到了广泛应用。但是,双动球头增加了滑动面的摩擦力矩,高摩擦力矩传递至头颈组合部位,从而增加了头颈组合部位的微动腐蚀程度[6,16-18]。DANIEL等[18]利用GOLDBERG评级法[19]对头颈部位的微动腐蚀进行分级后发现:单动球头和双动球头的头颈部位微动腐蚀得分分别为6.86和7.20,即采用双动球头会加剧头颈部位的微动腐蚀。另外,为便于翻修、调整下肢不等长、修复患者髋臼旋转中心等,模块化股骨柄设计得到了广泛采用。但是,组合式股骨柄设计在载荷承载区域引入了头颈(Head-neck)和颈茎(Neck-stem)2个结合面(如图3中B处),增加了微动腐蚀风险[20-21]。与头颈部位结合面相比,颈茎结合界面存在着不完全接触区,所承受力矩更大,在外界交变载荷作用下产生的微动幅值更大,因而该组合界面的微动腐蚀现象更为严重[22-25]。MIKKELSEN等[26]随访了33例采用模块化股骨柄和30例采用非模块化股骨柄的患者,发现前者假瘤发病率是后者的2倍。DUWELIUS等[27]研究对比了594例模块化股骨柄和284例非模块化股骨柄植入物患者,发现采用模块化股骨柄并没有减轻各类失效问题,反而加剧了结合部位的腐蚀、三体磨损和微动磨损等问题。
目前,关于假体组合方式的研究主要是通过对临床取出物材料表面的磨损和腐蚀的程度进行定性研究,缺乏对不同假体组合方式下微动腐蚀产生机制的认识,而未来的研究应该更多地关注于在保留模块化设计的基础上,进行全髋试验和仿真计算研究,探索不同假体组合方式下组合面微动腐蚀的产生机制。
1.2 组合界面材料
人工关节材料主要包括金属材料、陶瓷材料和有机高分子材料。临床取出物研究表明:在髋关节组合界面处的腐蚀现象与配副材料关系密切,不同金属材料的配副由于电势差异使得其结合部位可能产生电偶腐蚀[28-30]。COLLIER等[28]发现同种金属配副下腐蚀程度很小,而钛合金和钴铬合金配副下则出现了明显的电偶腐蚀痕迹。但是,也有学者得出了不同的结论。耿浩[31]对钴铬钼合金和钛合金进行电偶腐蚀试验,研究表明,在牛血清中2种合金出现了类似于协同保护作用机制。取出物和体外试验研究均表明,头颈部位钴铬钼合金球头与钛合金颈的配副微动腐蚀损伤的程度比钴铬钼与钴铬钼配副更低[32-34],电偶腐蚀并不是关节失效的主要因素。其次,颈部材料的疲劳强度对模块化股骨柄的微动腐蚀影响也较大。THOMAS等[35]发现由于钴铬钼合金的疲劳强度更高,颈部材料采用钴铬钼合金其耐微动腐蚀性能较钛合金提高了3倍以上。这和大部分临床取出物和体外试验结果是一致的[36-37]。另外,合金钝化作用形成的钝化膜可增强其耐腐蚀性能。研究表明:钛合金与钛合金配副具有更好的钝化作用,击穿电位更快,形成钝化膜的速度更快,电化学性能表现优异[38]。但是,SWAMINATHAN等[34]通过销盘试验发现:与钛合金/钴铬钼配副相比,钛合金/钛合金配副的摩擦因数更高、微动电流和耗散能更大,在微动过程中钝化膜更容易破坏,因此微动腐蚀会更严重。
陶瓷材料具有生物惰性、耐磨性好等优点,陶瓷材料进行各种改性和增韧后具有良好的耐腐蚀、耐磨损性能和优良的化学稳定性[39]。对陶瓷材料的取出物和体外试验研究均发现:陶瓷球头能够显著降低组合界面微动腐蚀,减少金属离子的释放和假体周围的不良组织反应[39-45]。KYOMOTO等[39]通过体外试验研究了氧化锆增韧氧化铝(ZTA)球头和钴铬钼合金球头的腐蚀情况,发现ZTA球头比钴铬钼球头在头颈部位的微动腐蚀程度更低。KOCAGOZ等[41]通过对临床取出物研究发现,与钴铬钼球头组相比,陶瓷球头组由微动腐蚀导致的头颈材料损失减少了一个数量级。
材料表面涂层处理可用于显著改善材料的腐蚀性能,同时保持良好的机械性能[46-47]。氮化钛、氮化锆等涂层具有高硬度、良好的生物相容性和耐腐蚀性,类金刚石(DLC)薄膜兼具了石墨和金刚石优异的自润滑、高电阻和高硬度等性能,因此,这些涂层材料都被用于关节植入物表明的改性。DING等[48]通过在Ti6Al4V基体表面制备DLC后发现:镀膜增强了基体表层的硬度和弹性模量,使得其摩擦因数更低,微动腐蚀程度明显降低。HENDRY和PILLIAR[49]通过物理气相沉积在基体表面镀上氮化钛和氮化锆涂层,使得其具有更高的硬度和更低的摩擦因数,表现出更好的抗微动腐蚀性能。大量研究认为这些涂层用于关节材料都可以降低组合界面的微动腐蚀[48-52]。
上述对于假体材料微动腐蚀的研究通常采用单一模式进行测试,研究范围有限,且忽略了多运动模式的耦合效应的影响,无法对设计、制造提供精准的指导。另外,大量微动与腐蚀行为的研究都是独立进行的,微动腐蚀的耦合作用机制尚不清楚。
1.3 设计参数
人工髋关节在设计制造中的很多参数,诸如球头直径、粗糙度、失配角、颈干角、锥形设计、颈部长度、偏心距等都将对组合界面的微动腐蚀产生影响[53-54]。目前,球头直径对微动腐蚀的影响还存在争议:大直径球头在头颈结合部位产生更大的力矩会使头颈部位微动腐蚀加剧[55-56],但SILJANDER等[57]对92例26、28、32、36、40 mm直径球头取出物研究发现,大直径球头在头颈结合面具有更低的微动腐蚀程度,28 mm球头在头颈结合面的微动腐蚀最为严重。其次,不同厂家为了使头颈结合面在装配中配合良好,锥体表面粗糙度和形貌设计有很大差异。为了增强装配效果,有些产品设计时常增加粗糙度及引入滚花螺纹形貌,这样纹理之间便形成了微小间隙,从而使得体液在其中积聚形成腐蚀环境,并与机械作用一起增加了微动腐蚀的风险[58]。另外,增加失配角可以在装配过程中产生更大的锁紧力从而降低植入后的微动腐蚀程度,但却增加了手术装配难度。而颈干角小于135°会增加组合界面处的力矩[35],导致微动腐蚀更严重。常见锥形设计主要有Type1、11/13、12/14、14/16等,主要是远端直径、锥度角和接触长度不同,其中Type1远端直径最小,14/16最大,锥部厚度也是如此。NASSIF等[59]研究了Type1、11/13、12/14三种锥形设计,发现锥体越厚其接触长度越长,同时其微动腐蚀程度也越大。TAN等[60]研究了44例采用不同锥形设计的植入物,发现11/13锥形设计微动腐蚀程度更严重。BROWN等[61]发现较长的颈部由于在颈部界面增加了不稳定性从而使结合部位的微动腐蚀程度增加,体外全髋试验研究也验证了这一点[62-64]。而引入不同股骨偏心距虽然增加了患者活动度,但会直接影响其弯曲刚度,导致组合界面的微动腐蚀倾向增加[65]。
关于假体参数设计的研究大大改善了假体的服役性能,但是髋关节假体尺寸主要是依据欧美人群的生理结构进行设计的,针对东方人特别是国人解剖结构的设计较少,且设计参数未能满足病人个性化的需求。因此根据国人的解剖结构设计参数,利用大数据对影响微动的主要参数进行特征筛选,同时针对病人进行个性化精准化设计,将是未来提高病人术后满意度和减小微动腐蚀的重要方向。
1.4 手术操作及患者
外科医生在装配过程中采用的力的大小不一,敲击方式从手到锤击的方式不一,造成手术效果参差不齐。研究表明:医生在手术过程中的敲击力在160 N~6 kN之间[66]。在手术过程中采用较大的装配力可以增加组合界面间的强度,减小微动腐蚀程度[54,63,66-71],但装配力过大可能会导致部件损伤。姚歌[72]通过有限元研究发现随着装配力增大,界面间的累计滑移量减少,当装配力小于2 kN时,过盈量将在短时间损耗,使过盈配合失效,从而引起界面累计滑移量的骤增,加重微动腐蚀。ENGLISH[66]等通过体外试验和有限元研究表明4 kN和6 kN的装配力能达到较好的装配效果,但是,对不同材料配副的关节组合如何确定最佳的装配力还需要进一步研究。除了装配力之外,研究发现在手术过程中锥体表面受到血液和骨屑的污染会增加微动腐蚀风险[67],这可能是由于锥部被污染后降低了其结合强度,同时增加了腐蚀性介质。因此,在手术操作中,必须保持装配环境的干燥清洁。同时医生在术中对装配偏移量的选取也对微动有重要影响,GILBERT等[73]研究了0和6 mm(偏移量为0意味着上颈部位置位于股骨头部的几何中心,而6 mm偏移则是沿着颈部轴线将颈部顶部向头部中心远端移动6 mm)2种偏移量下的微动腐蚀行为,发现偏移量为0时产生的运动类似于活塞运动,而6 mm偏移量下则产生了扭转和活塞运动的耦合,造成微动腐蚀更为严重。
另外,患者性别、身体质量指数(BMI)和步态等也可能会对组合界面微动腐蚀产生的金属离子产生影响[74-75]。KASPAREK等[76]在对一组组合式股骨柄进行分析时发现:女性患者被确定为关节失效的高风险因素,这可能是因为女性患者中植入物的尺寸较小所导致。POUR等[65]指出BMI指数增加和头颈部位失效呈正相关。另一方面,体外试验表明随着频率(步态)增加,金属材料表面氧化膜的钝化速率比破坏速率低,导致基体不断被磨损,从而会加剧微动腐蚀风险[77-78]。
对于手术操作和患者因素的研究主要采用有限元计算的方法模拟装配过程和步态等,所用模型较为简化,通过简单的力学输入进行趋势分析。而对于模拟在体服役环境下的微动特性理论的基础研究相对较少,尤其是针对微动腐蚀影响最大的服役环境,其力学环境及其对微动腐蚀的影响机制尚不清楚。因此,同时考虑基于骨肌系统的髋关节生物力学、关节滑动面的摩擦学和组合界面的接触力学等耦合作用下的微动损伤机制研究十分重要。
1.5 生理因素
髋关节植入物的服役环境充满着体液。不同年龄、性别、体质患者的生理环境存在显著差异,其中电位、pH、蛋白浓度和离子等因素影响着髋关节组合界面的微动腐蚀[78-81]。
植入物表面氧化膜的化学和结构性能均受到电位的影响,从而表现出不同的微动腐蚀行为。SWAMINATHAN和GILBERT[78]研究发现电位增加会导致氧化膜厚度增加,产生的氧化磨屑增多,从而导致摩擦因数升高。ROYHMAN等[81]研究发现,pH值为4.5时在钴铬钼合金表面形成了更强的钝化膜,且具有更低的腐蚀电位下降和材料损失;而在pH为7.6时则表现为黏着磨损,腐蚀电位下降和金属损失更多。DUISABEAU等[82]研究发现,氯离子存在会导致接触区局部腐蚀,使得难溶的铬离子和钛离子从接触区析出,因此降低了接触区附近pH值,进而增加了接触区离子溶解速率,改变了接触区的化学性质和第三体流变学,最终导致接触区位移调节机制发生改变,由滑移区向混合区转变,大大减小了滑动对钝化膜的损伤。
一旦生物材料被植入患者体内,其表面发生的第一个反应就是对蛋白质、氨基酸等生物分子的吸附。对于承载表面,一些吸附蛋白被相对运动(摩擦学)去除,而另一些吸附蛋白在摩擦化学反应下变性。有研究认为蛋白质的存在为金属提供了润滑和保护作用,GERINGER等[79]发现随着蛋白质浓度升高,316L的磨损量显著降低,可能是由于蛋白质与有机物在金属表面形成了石墨层[83],降低了摩擦力。YAN[84]利用开尔文探针扫描力显微镜和原子力显微镜研究了血清蛋白在钴铬钼合金上的腐蚀行为,认为血清蛋白吸附在合金表面,诱导自由电子从表面逃逸从而增加了腐蚀速率;但在摩擦条件下血清蛋白能在合金表面形成复杂的薄膜,从而保护基体避免进一步的摩擦腐蚀。OCRAN等[85]发现磷酸盐离子在溶液中的存在加快了钴铬钼合金的腐蚀速率,但溶液中的蛋白质和有机配合物吸附在钝化膜表面,第三体粒子可以和这些吸附有机配合物混合形成表面润滑剂降低微动腐蚀程度。
2 总结与展望
(1)在影响因素研究方面,人工髋关节组合界面的微动腐蚀涉及复杂多因素、多物理的复杂作用,是诸多因素的协同耦合作用结果,根据上述文献梳理出了如图5所示的作用机制。其中,诸多外部影响因素主要归结为力学与生理两方面的因素。其中假体组合方式、组合界面材料、设计参数、手术操作为主要的力学影响因素,患者体质中的pH、电位、蛋白浓度和离子为生理因素。未来可进一步考虑利用大数据建立针对亚洲人特别是国人的关节解剖数据库,对影响微动腐蚀的力学和生理因素进行筛选,找到针对个体的最优化参数,同时应对生理体液中微动腐蚀造成的金属化合物性质及其如何与体液环境进行反应进行深入研究。

图5 人工髋关节组合界面微动腐蚀影响因素
(2)在试验研究方面,目前主要集中在临床取出物和单一简单的体外销(球)盘试验研究或全髋模拟试验。取出物分析虽然能直接观察与分析体内微动腐蚀后的材料界面,但是难以推演微动腐蚀在体内的演化过程与机制。体外试验虽然对微动腐蚀的产生机制有更为清晰的认识,但是对复杂生理环境和生理活动难以模拟。因此,未来建立人工髋关节多尺度模型,考虑多因素耦合作用,利用计算机仿真计算方法以及在体外进行多模式下的复合微动腐蚀试验研究,从而有助于对髋关节组合界面微动腐蚀损伤机制的进一步认识。
