苯酚-硫酸法测定紫山药多糖含量的条件优化
2021-02-26王彦平娄芳慧陈月英杨会会赵峥嵘贾彦杰孙瑞琳
王彦平,娄芳慧,陈月英,杨会会,赵峥嵘,贾彦杰,孙瑞琳
(河南农业职业学院食品工程学院,河南 郑州 451450)
紫山药(Dioscorea alata)又名参薯、紫淮山、长芋等,为薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)多年生草质缠绕藤本植物,以其肥大的掌状块根或圆柱状根供食用,肉质紫红色,口感脆嫩,主要在浙江、湖南、广西、广东、江西、福建、云南等地种植[1]。紫山药含有丰富的淀粉、膳食纤维、维生素、矿物元素和多糖、尿囊素、花青素、薯蓣皂苷等生物活性物质。紫山药多糖作为紫山药中主要功能成分之一,具有增强机体免疫功能[2]、抗氧化[3]、抗衰老[4]、降糖[5]、耐缺氧[6]等生物活性。因此,准确测定紫山药中多糖含量,对今后紫山药在食品、医药等领域开发应用具有深远意义。
多糖是自然界生物体中重要的组成成分和生物活性物质,广泛存在于动物、植物和微生物的体内和细胞壁中[3],常用的多糖检测定量方法有苯酚-硫酸法、蒽酮-硫酸法、地衣酚-硫酸法和高锰酸钾滴定法等[7-10],其中苯酚-硫酸法具有操作简便、灵敏和不需要使用大型仪器等优点,被广泛应用在食品开发领域。苯酚-硫酸法是利用多糖被浓硫酸水合产生的高温水解成单糖,单糖迅速脱水生成的糖醛衍生物与苯酚发生显色反应,生成橙黄色衍生物,再以紫外可见分光光度计法测定,该衍生物在490 nm波长附近呈现最大吸收峰[11]。苯酚-硫酸法是一种广泛用于测定食品中多糖含量的方法,可用于多聚糖、戊糖和甲基化糖的测定。大量研究认为,与蒽酮-硫酸法、地衣酚-硫酸法等方法相比较而言,该方法具有操作简便、准确度高、精密度高、稳定性好、重现性好等优点[12-16]。
由于显色反应时所用浓硫酸和苯酚用量与多糖的组成成分有关,过量浓硫酸可造成显色物质分解,从而影响测定结果[17],因此有必要对苯酚-硫酸法用于紫山药多糖的测定条件进行优化。目前尚未查到有关紫山药多糖检测方法建立方面的报道,故本试验以紫山药为原料,采用苯酚-硫酸法,使用紫外分光光度计法测定紫山药中多糖含量,优化最大吸收波长、显色温度、显色时间、苯酚用量、浓硫酸用量5个试验条件,并对精密度、加标回收率等进行考察,旨在建立紫山药中多糖含量测定的最佳方法。
1 材料与方法
1.1 材料
新鲜紫山药:广西南宁;葡萄糖、浓硫酸、无水乙醇、苯酚、乙醚、正丁醇、三氯甲烷均为分析纯:科密欧化学试剂有限公司。
1.2 仪器
SHA-C水浴恒温振荡器:江苏杰瑞尔电器有限公司;VORTEX 21K离心机:湖南湘仪离心机仪器有限公司;UV1901PCS双光束紫外可见光分光光度计:北京普析通用仪器有限责任公司;DK-98-II恒温水浴锅:天津泰斯特仪器有限公司;BSA423S-CW分析天平:德国赛多利斯集团;202-3AB电热恒温鼓风干燥箱:上海乔跃电子科技有限公司。
1.3 方法
1.3.1 试验溶液的配制
苯酚溶液:精密称取6.0 g重蒸苯酚[18],置于棕色容量瓶中,用蒸馏水定容至100 mL,配制成6%的苯酚溶液,置于棕色试剂瓶中,备用。
Sevag试剂[19]:将三氯甲烷和正丁醇以体积比4:1混合,配制成Sevag试剂。
葡萄糖标准溶液:精密称取0.1 g烘干至恒重的无水葡萄糖,置于棕色容量瓶中,用蒸馏水溶解并定容至100 mL,配制成1 mg/mL的葡萄糖标准品溶液。再分别取该溶液0.6、1.8、3.0、4.2、5.4mL,置于 100mL 容量瓶中,用蒸馏水定容至刻度,摇匀,配制成系列葡萄糖标准溶液。
1.3.2 样品处理
1.3.2.1 紫山药多糖粉末制备
新鲜紫山药经洗净、去皮、切片后,放置鼓风干燥箱内,于60℃烘干24 h,粉碎后过50目筛。称取一定量的紫山药粉添加到乙醚中,在90℃水浴中回流脱脂2 h,抽滤后,烘干紫山药粉至恒重。称取5 g脱脂紫山药粉末按料液比1∶25(g/mL),在温度60℃,功率200W条件下超声辅助提取20min,于4000r/min离心15min。将上清液置于250 mL具塞三角瓶中,加入1/4体积的Sevag试剂,置于振荡器中振荡混匀30 min后置于分液漏斗中静置,分层后弃下层胶状变性蛋白质层,取上面水层于8 000 r/min离心10 min,将沉淀去除,取上清液,此Sevag法除蛋白步骤重复操作5次[7]。合并水层,旋转蒸发浓缩后加入无水乙醇至乙醇终浓度为75%,静置醇沉18 h[19],于4 000 r/min离心10 min后弃上清液,于60℃真空干燥,得紫山药多糖粉末。
1.3.2.2 紫山药多糖溶液配制
精密称取紫山药多糖粉末20 mg,用蒸馏水溶解定容至500 mL,得40 μg/mL的紫山药多糖溶液。
1.3.3 最大吸收波长的考察
移取紫山药多糖溶液2.0 mL于25 mL具塞试管中,加入6%苯酚溶液0.6 mL,混匀后迅速加入5.0 mL浓硫酸,摇匀后沸水浴中显色20 min,取出后置于冰水中冷却10 min,采用紫外可见分光光度计在400 nm~600 nm波长范围内进行扫描,确定其最大吸收波长。
1.3.4 试验条件优化
1.3.4.1 显色温度的考察
移取紫山药多糖溶液2.0 mL于25 mL具塞试管中,加入6%苯酚溶液0.6 mL,混匀后迅速加入5.0 mL浓硫酸,摇匀后分别在40、60、80、100℃的显色温度下,显色20 min,取出后置于冰水中冷却10 min,测定吸光度值。
1.3.4.2 显色时间的考察
移取紫山药多糖溶液2.0 mL于25 mL具塞试管中,加入6%苯酚溶液0.6 mL,混匀后迅速加入5.0 mL浓硫酸,摇匀后在80℃水浴中分别显色10、15、20、25、30、35、40 min,取出后置于冰水中冷却 10 min,测定吸光度值。
1.3.4.3 浓硫酸用量的考察
移取紫山药多糖溶液2.0 mL于25 mL具塞试管中,加入6%苯酚溶液0.6 mL,混匀后分别迅速加入4.0、4.5、5.0、5.5、6.0 mL 浓硫酸,摇匀后在 80 ℃水浴中分别显色20 min,取出后置于冰水中冷却10 min,测定吸光度值。
1.3.4.4 苯酚用量的考察
移取紫山药多糖溶液2.0 mL于25 mL具塞试管中,分别加入 6%苯酚溶液 0.4、0.5、0.6、0.7、0.8、0.9、1.0mL,混匀后分别迅速加入5.0 mL浓硫酸,摇匀后在80℃水浴中显色20 min,取出后置于冰水中冷却10 min,测定吸光度值。
1.3.5 方法准确度及精密度测定
1.3.5.1 标准曲线的绘制
分别精确移取2.0mL系列葡萄糖标准溶液至25mL具塞试管中,加入0.7 mL 6%苯酚溶液,摇匀,迅速加入6.0 mL浓硫酸,摇匀后置80℃水浴中显色20 min,取出后置于冰水中冷却10 min,在488 nm处测定其吸光度。空白对照用2.0 mL蒸馏水代替葡萄糖溶液。以葡萄糖浓度(μg/mL)为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.5.2 精密度的考察
精密移取5份2.0 mL紫山药多糖溶液,按1.3.5.1检测方法平行测定其吸光度值,计算相对标准偏差(relative standard deviation,RSD)。
1.3.5.3 加标回收率的考察
精密移取3份2.0 mL紫山药多糖溶液,按1.3.5.1检测方法测定其吸光度值,并计算得紫山药多糖含量(以葡萄糖计)。另取3份2.0 mL紫山药多糖溶液,分别加入2.0 mL的0.01 mg/mL的葡萄糖标准溶液,按1.3.5.1检测方法测定吸光度值,计算加标回收率[20]。
1.4 数据处理
本试验数据采用Excel软件进行处理及绘图。
2 结果与分析
2.1 最大吸收波长的确定
在400 nm~600 nm波长区域的扫描结果见图1。
由图1可知,紫山药多糖溶液的最大吸收波长在488 nm处。

图1 紫山药多糖吸收光谱Fig.1 Absorption spectrum of polysaccharides in purple yam
2.2 试验条件的优化
2.2.1 显色温度的确定
显色温度对吸光度的影响见图2。
由图2可知,吸光度随着显色温度升高呈现先升后降低的趋势。在80℃时,吸光度值最高。水浴温度达到100℃时,溶液吸光度值轻微下降,其原因可能是水浴温度过高,使反应底物遭到破坏所致。因此,试验选择的显色温度为80℃。
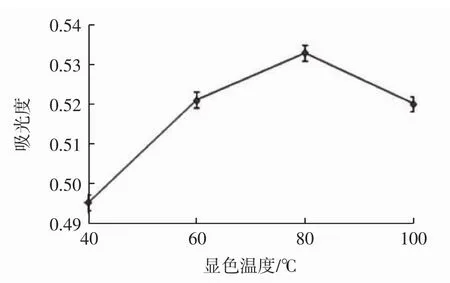
图2 不同显色温度下的溶液吸光度Fig.2 Absorbance of solution at different reaction temperature
2.2.2 显色时间的确定
显色时间对吸光度的影响见图3。
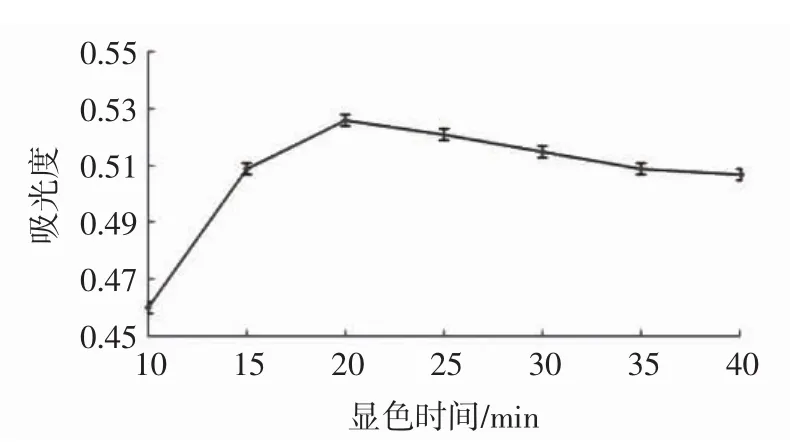
图3 不同显色时间下的溶液吸光度Fig.3 Absorbance of solution at different reaction time
由图3可知,在10 min~20 min时间段内,吸光度值随着显色时间增加而增加,20 min后吸光度会轻微下降,但是下降幅度不大,说明该方法的稳定性较好。但为保证检测准确度,试验选择显色反应20 min冷却后迅速测定其吸光度。
2.2.3 浓硫酸用量的确定
浓硫酸用量对吸光度的影响见图4。
由图4可知,溶液吸光度随着浓硫酸用量的增加呈现出先升高后降低的趋势,浓硫酸用量为5.0 mL时,多糖溶液的吸光度达到最高值。但加入量超过5 mL后,吸光度下降幅度较大,经分析可能是由于浓硫酸浓度过高导致多糖碳化严重所致。因此,试验选择浓硫酸用量为5 mL。

图4 不同浓硫酸用量下的溶液吸光度Fig.4 Absorbance of solution with diferente amounts of sulfuric acid
2.2.4 苯酚用量的确定
苯酚用量对吸光度的影响见图5。

图5 不同苯酚用量下的溶液吸光度Fig.5 Absorbance of solution with diferente amounts of phenol
由图5可知,6%的苯酚加入量在0.4 mL~0.7 mL之间时,溶液吸光度随着苯酚加入量迅速升高,说明此时反应底物随着苯酚用量增加而增多;苯酚加入量超过0.7 mL后,吸光度反而下降,说明苯酚用量适中时才能达到最佳显色效果。因此,试验选择6%苯酚用量为0.7 mL。
2.3 方法准确度和精密度考察
2.3.1 标准曲线的绘制
葡萄糖标准曲线见图6。葡萄糖标准溶液吸光度与浓度之间的线性回归方程为y=0.016 4x+0.013 8,其R2值为0.999。说明葡萄糖在0~54 μg/mL范围之间呈现出良好的线性关系。
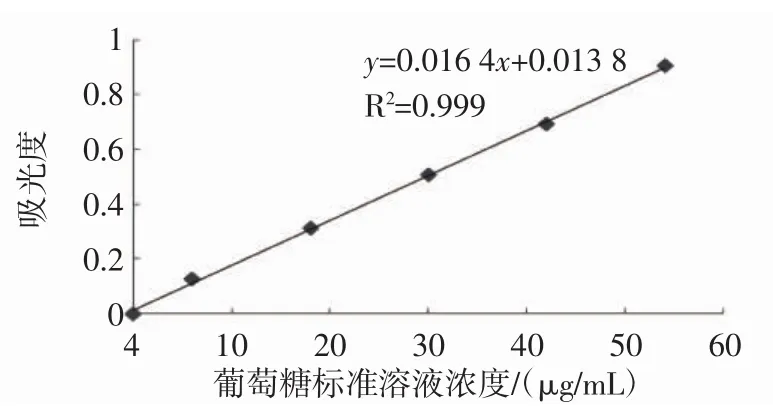
图6 葡萄糖标准曲线Fig.6 Standard curve of glucose
2.3.2 精密度试验
精密度试验结果见表1。
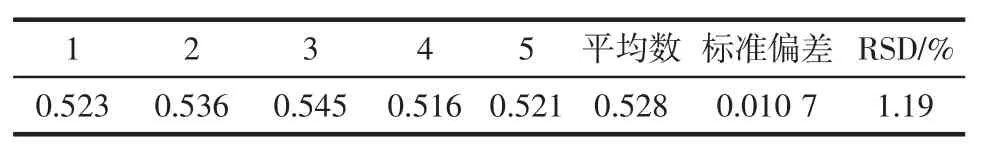
表1 精密度试验结果Table 1 Results of precision test
结果表明,通过5次平行试验测定吸光度,相对标准偏差RSD为1.19%,证明该方法精密度较高,具有良好的重现性。
2.4 加标回收率
加标回收率试验结果见表2。
由表2可知,该方法的加标回收率在97.26%~102.63%之间,RSD为2.90%,说明该方法具有良好的回收率,且试验结果相对稳定。

表2 加标回收率试验结果Table 2 Results of standard addition and recovery test
3 结论
试验通过单因素比较分析,优化了苯酚-硫酸法对紫山药多糖含量的测定条件。结果表明,最优测定条件为在2.0 mL待测液中加入0.7 mL苯酚溶液,缓慢匀速加入5.0 mL浓硫酸,混匀后置于80℃水浴中加热20 min,取出后置于冰水中冷却10 min,在吸收波长为488 nm条件下测定吸光度。该方法在0~54 μg/mL范围内具有良好的线性关系,精密度良好,加标回收率高,可作为紫山药中多糖的测定方法。
