胎盘生长因子荧光免疫层析法检测的临床性能评估
2021-02-26马锦琪黄建荣薛一峰许亚丰王春新
马锦琪,李 鹰,黄建荣,薛一峰,许亚丰,王春新*
1南京医科大学附属无锡人民医院产科,2医学检验科,江苏 无锡 214023
孕妇血清中的胎盘生长因子(placental growth factor,PlGF)是首个经过大规模临床验证的、可用于孕妇子痫前期预测及诊断的生物标志物[1-2],PlGF浓度的变化与孕妇罹患子痫前期的风险密切相关。
目前,PlGF的检测技术有时间分辨荧光免疫分析、微流控、电化学发光法等[3-4],这些技术都存在操作复杂或成本高昂等缺点。基于荧光免疫层析的检测方法操作便捷,成本低廉,可实现在临床门诊随到随诊,方便快速预测子痫前期的风险,具有较高的临床应用价值。
本研究建立了荧光免疫层析的PlGF检测方法,并对其分析性能与临床性能进行评价。
1 材料和方法
1.1 材料
鼠抗人PlGF 单抗(克隆号:P616)和羊抗人PlGF 多抗(货号:CSB⁃DA217)(无锡金泰格生物科技有限公司);重组人PlGF 蛋白(货号:TP723367,OriGene 公司,美国);荧光微球(货号:FCEU002,规格:0.19 μm)(Bangs公司,美国)。对照试剂:胎盘生长因子检测试剂盒(电化学发光法,批号:21906701,Roche公司,德国)。荧光分析仪(广州蓝勃生物科技有限公司,型号:AFS⁃1000);化学发光分析仪(Roche公司,德国)。
1.2 方法
1.2.1 反应体系的建立
1.2.1.1 抗体标记条件
抗体标记按荧光微球说明书进行,每毫克微球标记80~100 μg抗体。将微球与抗体(鼠抗人PlGF单抗)混合于pH为5.0~7.5的5种MES缓冲液(0.1 mol/L)中,放置室温,200 r/min摇床上反应2 h后于13 000 r/min 4 ℃离心30 min,取上清液测定残余抗体的量。
1.2.1.2 标记抗体与包被抗体用量
线性范围预设:20.0~9 000.0 pg/mL,按照表1的棋盘法,设置不同的标记抗体以及包被抗体(羊抗人PlGF 多抗)用量;组装PlGF 检测卡,采用0~10 000.0 pg/mL 的质控品进行检测,确立PlGF 标记抗体与包被抗体的最佳用量。

表1 棋盘法选择最佳的标记抗体与包被抗体用量Table 1 The optimal amounts of conjugated and coated antibody selected by checkerboard method
1.2.1.3 反应时间
在确定上述参数的基础上,采用定值质控品(500.0 pg/mL)摸索反应完成时间。
1.2.2 分析性能评价
参照美国临床实验室标准化委员会(CLSI)EP06、EP15、EP07 文件[7-9]和《WS/T 420⁃2013 临床实验室对商品化定量试剂盒分析性能的验证》[10-11]要求,对本项目建立的PlGF荧光免疫层析检测方法的分析性能进行评价,具体方法如下。
1.2.2.1 空白限
用空白质控品重复测定10次,计算信号值的平均值和标准差,得出平均值+2×标准差所对应的信号值,代入定标曲线方程计算对应的浓度值,即为空白限。
1.2.2.2 灵敏度(检出限)
参照行业标准[11]的方法,具体如下:预设灵敏度(检出限)为10.0 pg/mL,配制5份低值样本(10.0~20.0 pg/mL),每份样本检测5次,对检测结果按照大小进行排序并与空白限进行比较,至少2 份样本的浓度高于空白限,则预设10.0 pg/mL 即为PlGF 检测方法的灵敏度(检出限)。
1.2.2.3 准确度(回收率)
将高浓度的PlGF样品A(11 045.0 pg/mL,10 μL)加入到空白质控品B(100 μL)中;重复测试3 次求平均值,根据以下公式计算回收率:(R)=[C×(V0+V)-C0×V0]/(V×Cs)×100%,式中R 为回收率;V 为样品A 液的体积;V0为样品B 液的体积;C为样品B 液加入A液后的检测浓度;C0为样品B液的浓度;Cs为样品A 液的浓度。参照行业标准[11]的要求,回收率应在85%~115%。
1.2.2.4 线性范围
参照行业标准[11]的方法,确立本项目PlGF荧光免疫层析检测方法的线性范围,具体方法如下:预设线性范围为20.0~9 000.0 pg/mL;将高浓度质控品(9 354.0 pg/mL)稀释至5个浓度,最低浓度应接近线性范围下限(20.0 pg/mL),每个浓度重复检测3次,计算平均值;计算检测浓度的均值与理论值的线性相关性,线性相关系数r应不低于0.990。
1.2.2.5 重复性
浓度分别为500.0、5 000.0 pg/mL 的PlGF 质控品各重复检测10 次,计算10 次测量结果的平均值和标准差,根据以下公式计算变异系数:CV(%)=标准差/平均值×100%。
1.2.2.6 干扰试验
交叉反应(特异性):取重组血管内皮生长因子(VEGF)和重组表皮生长因子(EGF),加入至空白质控品及PlGF 高值血清,终浓度分别为200.0 ng/L 和3.0μg/L,重复测定3次计算均值。
干扰物质:取PlGF 高值血清,分别加入不同浓度的血红蛋白、总胆红素等可能的干扰物质,每个样本分别重复检测3次,计算平均值及干扰率,干扰率(%)=(干扰样本实测浓度-样本理论浓度)/样本理论浓度×100%。
1.2.3 临床性能评价
收集2018 年2—9 月来南京医科大学附属无锡人民医院就诊的136 例孕妇(年龄18~45 岁、孕周20~34+6周)的血清样本(不少于0.5 mL);采集的血清在-20 ℃条件下冷冻保存,1个月内进行检测。每份血清样本均采用荧光免疫层析法与电化学发光试剂法平行检测,考察两种检测方法的相关性。
1.3 统计学方法
用SPSS17.0 和GraphPad Prism 5.0 软件进行数据处理与分析;两种检测方法结果的差异分析采用Bland⁃Altman检验,采用线性回归进行相关性分析,检验水准(α)为0.05。
2 结果
2.1 反应体系的建立
2.1.1 抗体标记的最佳条件
实验结果显示,当pH为6.5~7.0时,残余抗体最少(表2);因此将抗体的标记pH确定为6.5~7.0。

表2 不同pH条件下抗体的标记效率Table 2 Conjugated efficiency of antibody with different pH condition
2.1.2 标记抗体与包被抗体用量
如图1 所示,配方2、配方4、配方5 符合线性范围的要求(即在20.0~9 000.0 pg/mL内,荧光信号值-浓度值的曲线接近于直线);因此确定标记抗体的喷点量为3.5 μL/cm,包被抗体的用量为1.5 μg/μL。
2.1.3 反应时间
取质控品(500.0 pg/mL)80 μL 加入PlGF 检测卡,分别于5、10、15 min检测,重复3次求平均值,结果显示,检测卡在10 min时已完成反应(表3);为确保反应充分,确立反应时间为15 min。
2.2 分析性能评价
2.2.1 空白限

图1 不同配方与信号值的对应关系Figure 1 Relation between different formulas and the sig⁃nal value

表3 不同反应时间后的检测结果Table 3 Test results after different reaction times(pg/mL)
空白质控品重复测定10 次,信号的平均值为0.052 3,标准差为0.002 5,根据均值+2×标准差,代入定标曲线方程计算得到PlGF 检测卡的空白限为6.08 pg/mL。
2.2.2 灵敏度(检测限)
根据实验结果,5 个低值样本的检测结果均高于空白限(6.08 pg/mL),确定PlGF 检测卡的灵敏度(检出限)为10.0 pg/mL(表4)。
2.2.3 准确度(回收率)
根据实验结果,确定PlGF 检测卡的准确度(回收率)为97.98%(表5)。
2.2.4 线性范围
以理论浓度为x轴,以实际检测浓度为y轴,考察相关性。结果显示,PlGF检测卡在16.7~9 000.0 pg/mL的线性相关系数r=0.999>0.990,因此,确定PlGF检测卡的线性范围为20.0~9 000.0 pg/mL(表6、图2)。
2.2.5 重复性
根据实验结果(表7),PlGF浓度在500.00 pg/mL和5 000.0 pg/mL 时,检测卡的重复性(CV)分别为3.14%和2.98%。
2.2.6 干扰试验
交叉反应(特异性)实验结果显示,VEGF、EGF与PlGF 检测卡的交叉反应在-2.48%~3.95%,对检测结果无显著影响(表8)。
血红蛋白等干扰物质对检测结果的干扰率在-7.11%~-0.79%,其中,胆红素、类风湿因子和维生素C的干扰率均超过-5%,需引起重视,可作为本研究PlGF检测方法后继改进的内容之一(表9)。

表4 PlGF检测卡的灵敏度(检出限)Table 4 Sensitivity(limit of detection)of PlGF card (pg/mL)
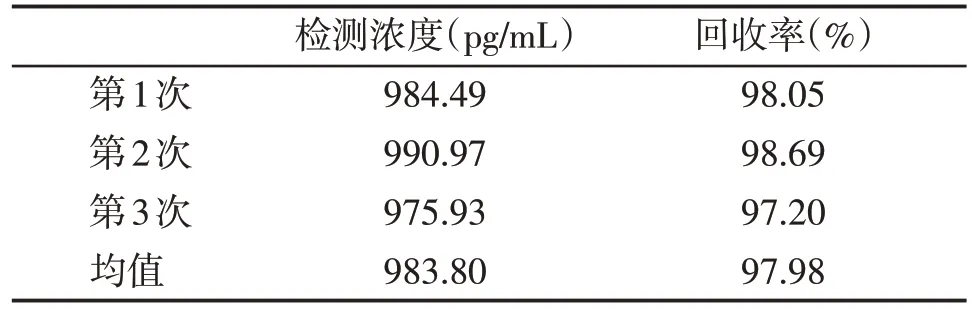
表5 PlGF检测卡的准确度Table 5 Accuracy of PlGF card

表6 PlGF检测卡线性范围Table 6 Linear range of PlGF card

图2 PlGF检测卡的线性相关性Figure 2 Linear correlation of PLGF card
2.3 临床性能评价
2.3.1 两种检测方法的相关性分析
每个临床血清样本经荧光免疫层析法与对照方法平行测定,检测结果进行线性回归分析,结果如图3所示,两种PlGF检测方法具有良好的线性相关性:y=1.032x-5.002(r=0.991>0.950)。

表7 PlGF检测卡重复性研究结果Table 7 Repeatability of PlGF card

表8 交叉反应对检测结果的影响Table 8 Influence of cross reaction on detection
2.3.2 两种检测方法的差异性分析
采用Bland⁃Altman 检验分析两种方法检测结果的差异,结果如图4 所示,荧光免疫层析法(考核系统)检测结果的平均值略高于电化学发光法(参比系统),但是两种检测方法的平均值差值仅为-8.98 pg/mL,差异无统计学意义(P>0.05)。
3 讨论
先兆子痫是一种严重的妊娠并发症,通常发生在怀孕20 周以后。PlGF 浓度异常引起血管内皮功能障碍,是先兆子痫发生的重要原因[12-13];检测血清中PlGF 水平的变化可显著提高先兆子痫诊断的准确性。

表9 干扰物质对检测结果的影响Table 9 Influence of interfering substances on detection

图3 荧光免疫层析法与电化学发光法的相关性Figure 3 Correlation between fluorescence immunochro⁃matography and electrochemiluminescence

图4 荧光免疫层析法与电化学发光法的差异分析Figure 4 Difference analysis of fluorescence immunochro⁃matography and electrochemiluminescence
PlGF现有的检测技术主要包括化学发光法、时间分辨免疫荧光法等;这些检测技术需要反复定标,依赖大型分析仪器,因此,往往是收集样本后集中检测,给临床诊疗带来了极大不便。2012年美国Alere公司推出了一款基于微流控技术的PlGF检测产品(Triage®PLGF),操作简便(滴加血清后15 min即可判读结果),性能优异,是目前临床应用最为广泛的PlGF 检测技术[14]。但微流控检测技术开发难度极大,全球实现量产的产品为数极少。近年来兴起的荧光免疫层析技术是一种快速免疫学检测方法[15-16],具备与微流控相似的分析性能,灵敏度高,操作便捷,无需反复定标,综合成本更低,尤其适合现场检测,提高工作效率。
本研究基于荧光免疫层析技术建立PlGF 检测方法,包括抗体标记、包被、反应时间等关键参数的优化;同时依据CLSI 的EP6⁃A、EP15⁃A、EP7⁃A 等规范性文件,对荧光免疫层析检测方法的分析性能,包括空白限、灵敏度、准确度、线性范围、重复性和干扰试验进行了评价;最后,通过136例临床样本的检测,证实本项目建立的PlGF荧光免疫层析检测方法与电化学发光法具有良好的一致性。
综上所述,本研究应用荧光免疫层析技术,建立了血清中PlGF的检测方法,操作简便、快速,分析性能与临床性能优异。今后,我们将进一步改进这一检测技术,如降低类风湿因子等物质的干扰,通过与自动分析仪的适配研究实现自动化操作,使之更适合应用于临床子痫前期风险的评估。
