基于改进LeNet-5模型的WHO Ⅱ/Ⅲ级脑胶质瘤影像自动分级的临床研究
2021-02-26汪忠李军刘崎范月超
汪忠,李军,刘崎,范月超
脑胶质瘤是最常见的颅内恶性肿瘤,约占颅内肿瘤的45%,是对人类健康造成极大损害的一类肿瘤。其中高级别胶质瘤(WHO Ⅲ-Ⅳ级)患者的病情进展迅速,容易复发和转移,预期寿命较短,术后并发症较多。故术前对胶质瘤恶性程度的预判可以为患者提供精准的治疗方案,采取积极治疗措施改善患者的预后[1-2]。
近年来随着影像学技术的不断发展,影像组学技术在胶质瘤的精准诊疗中得到了应用[3]。影像组学是指通过对肿瘤的特定区域进行定量分析,提供有价值的诊断、预后预测信息,以支持个性化的临床治疗方案选择[4]。其基本的处理流程依次为:影像数据采集、感兴趣区(region of interest,ROI)图像分割、特征提取与量化、建立模型。在处理流程中,利用人工分割和提取存在一些不足,人工提取数据的效率较低,且准确性和特异性都较差[5]。深度学习可以利用计算机模仿人脑操作,从输入数据集产生自动预测,从而代替人工完成影像学数据的提取与处理,提高处理效率。其主要的算法包括递归神经网络、卷积神经网络和深度神经网络[6-8]。但是目前深度学习也存在一些缺点,如深度学习诊断的结果并不稳定,误诊、漏诊的情况仍然经常发生。根据深度学习的特点,误诊的主要原因在于目前未构建出稳定性强的网络模型,实验结果重复率低。因此,如何构建稳定的网络模型,在机器学习的研究过程中至关重要[9-10]。
本研究对徐州医科大学附属医院神经外科2017年1月—2018年12月手术治疗的98例WHO Ⅱ级、Ⅲ级脑胶质瘤患者的MRI图像,用基于改进LeNet-5模型的影像组学方法对WHO Ⅱ级与Ⅲ级脑胶质瘤进行分级;探讨其临床应用价值,为胶质瘤的术前分级、治疗方案制定提供帮助。
1 资料与方法
1.1 一般资料 本组患者中男48例,女50例;年龄6~70岁,平均年50.33岁。纳入标准:(1)术前1个月内行MRI检查,且扫描序列齐全;(2)未接受放化疗;(3)术后病理诊断为WHO Ⅱ级和Ⅲ级脑胶质瘤,且有分级结构。排除标准:MRI图像质量差,达不到后处理要求。根据2016年WHO中枢神经系统肿瘤分类标准,本组患者中WHO Ⅱ级胶质瘤者55例,Ⅲ级胶质瘤43例。
1.2 方法
1.2.1 MRI检查 常规MRI检查采用GE Discovery 750W 3.0 T磁共振机,使用16通道头颅线圈。T1WI扫描参数:TI 800~900 ms,TR 2 000~2 500 ms,TE 20~25 ms。T2WI为快速自旋回波序列(fast spin echo,FSE),扫描参数:TR 4 000~4 500 ms,TE 100~110 ms。T2-FLAIR序列,扫描参数:TI 2 000~2 100 ms,TR 8 000~8 600 ms,TE 150~170 ms。DWI扫描参数:TR 4 300 ms,TE 73 ms,b值 0和1 000 s/mm2。视野(field of view,FOV)240 mm×240 mm,层厚6 mm,层间距2 mm,矩阵256×256。
1.2.2 卷积神经网络 LeNet-5是现代卷积神经网络的奠基之作。原LeNet-5模型对本研究胶质瘤分级效果不理想,实验在网络末尾添加Softmax分类器,可将胶质瘤Ⅱ级、Ⅲ级分开;并通过更改激活函数、加深网络层数、更改卷积核、过滤器尺寸、减小梯度下降学习速率便于模型提取胶质瘤影像的深层特征,进一步提高分级正确率。
采集448张轴位的胶质瘤MRI T2WI图像,将其中380张图像作为训练集,68张图像作为测试集。为扩增实验数据和提高模型泛化能力,使用旋转的方式扩增训练集,将原来380张训练数据扩增一倍,为760张,98例患者扩增为128例(图1)。
A:原始图像; B:旋转后的扩增图像图1 胶质瘤MRI原始图像与旋转扩增图像
将WHO Ⅱ级胶质瘤标记为1类,WHOⅢ级胶质瘤标记为2类。(1)原LeNet-5模型对胶质瘤分级效果并不理想,故实验在网络末尾添加Softmax分类器,可将胶质瘤WHO Ⅱ级和WHOⅢ级分开;(2)通过更改激活函数,原LeNet-5网络使用的是sigmoid激活函数,sigmoid激活函数具有软饱和性,在训练学习过程中容易产生梯度消失的现象,无法完成深层网络的训练。使用sigmoid激活函数对胶质瘤分级效果并不理想,因此,实验更换sigmoid激活函数,分别将tanh激活函数以及ReLU激活函数应用在网络中,根据最终测试结果选择合适的激活函数;(3)加深网络层数、更改卷积核、过滤器尺寸、减小梯度下降学习速率便于模型提取胶质瘤影像的深层特征,进一步提高分级正确率。具体网络结构见图2。
2 结 果
2.1 原始模型及添加Softmax分类器后对胶质瘤的分级 原始模型只能识别出WHO Ⅲ级胶质瘤,并不能将WHO Ⅱ级胶质瘤区分开。模型添加Softmax分类器后,可将WHO Ⅱ级与WHOⅢ级两种级别的胶质瘤区分开(图3)。
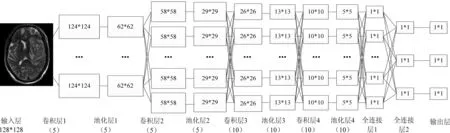
图2 改进后的网络结构
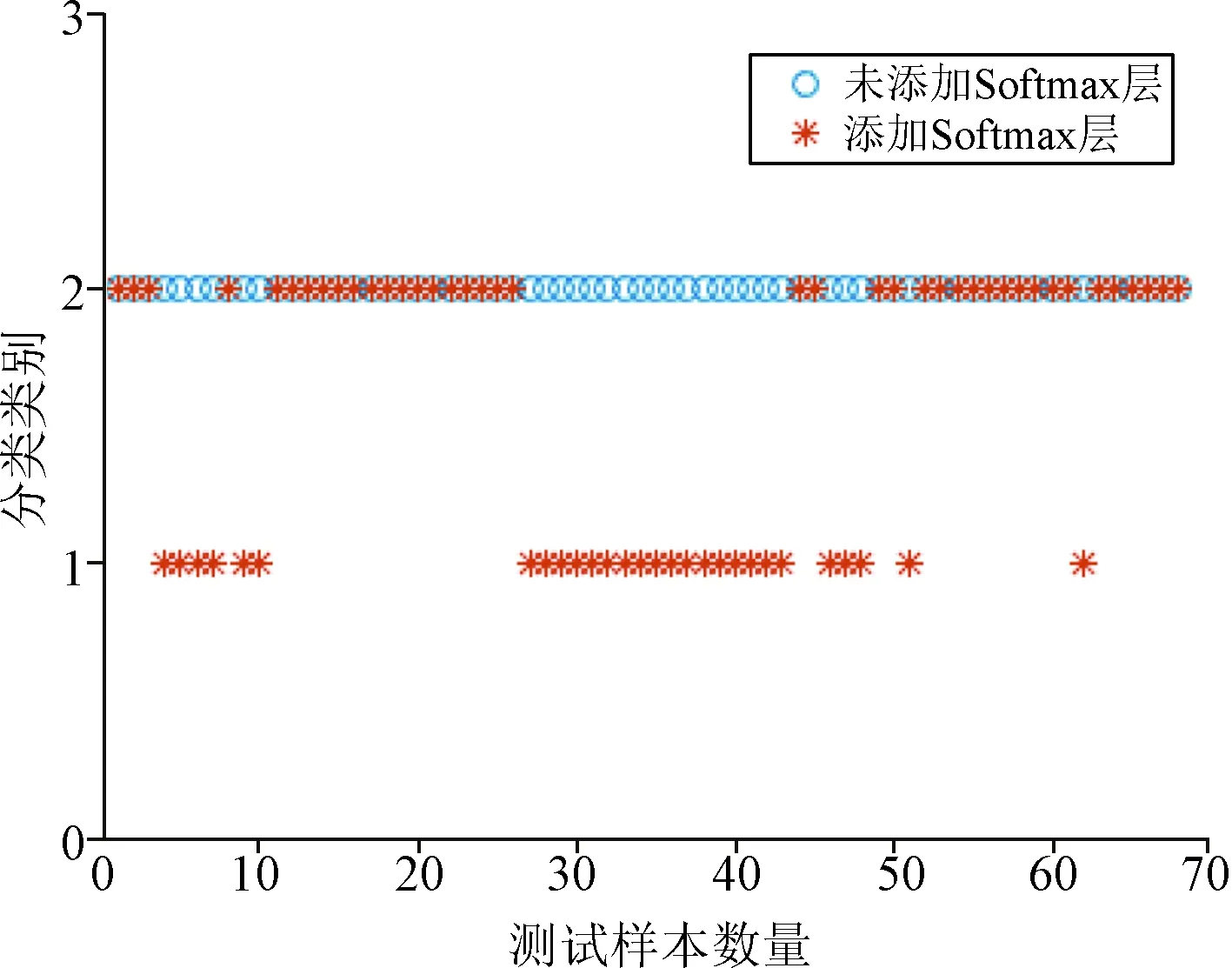
图3 模型添加Softmax分类器后的胶质瘤分级
2.2 不同激活函数对测试结果的影响 见表1。sigmoid激活函数易出现梯度消失现象,导致网络无法进行有效更新。因此,本研究通过对比分析tanh和ReLU常用激活函数,选取最适合该网络的激活函数。在此模型中,ReLU相对于其他两种激活函数更好地解决了梯度消失的问题。网络使用ReLU激活函数时,测试正确率较高,达到82.35%;改进网络的训练准确率比之前的原始网络有明显提高(图4)。改进后的模型测试准确率也较原模型提高,当epoch=45时,正确率达到最高,epoch大于45,趋于不变(图4B)。图5为网络改进前后的Ⅱ级、Ⅲ级胶质瘤错误数对比图,横坐标表示胶质瘤分级的两个类别(1类为WHO Ⅱ级胶质瘤,2类为WHO Ⅲ级胶质瘤),纵坐标代表每类的错误数量。相较于原始网络,改进后网络的1类和2类胶质瘤测试错误个数均减少,总体错误率降低;表明改进后的网络结构对胶质瘤分级的准确率较改进前的原始网络有提高。

表1 不同激活函数对网络测试结果的影响
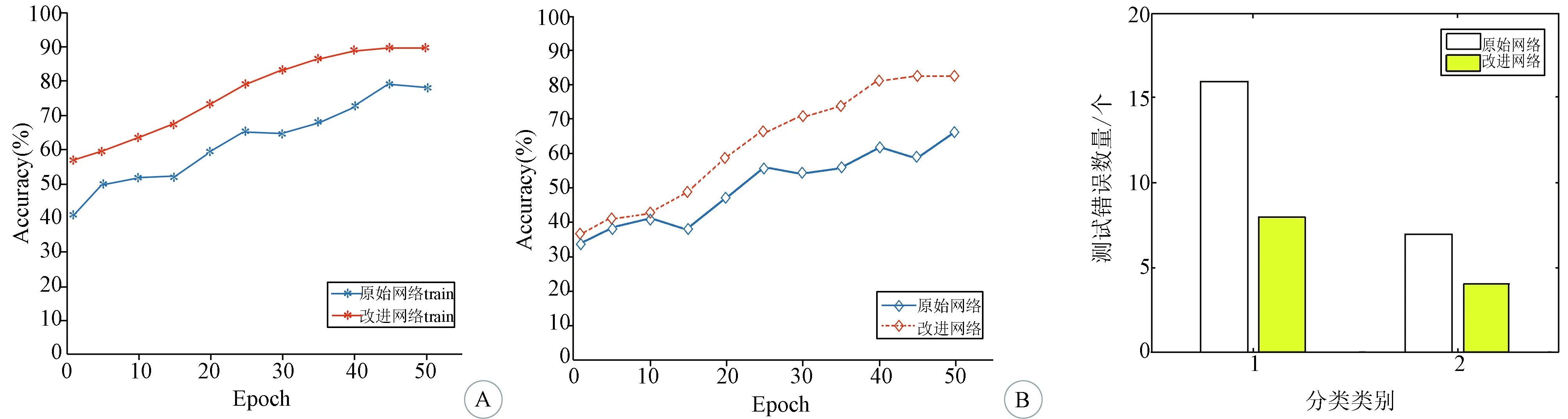
A:训练准确率;B:测试准确率图4 改进网络与原始网络的训练和测试准确率曲线图图5 改进网络与原始网络的错误数对比
3 讨 论
脑胶质瘤的病理级别准确分级对临床治疗方案的选择有重要意义[11-12]。脑胶质瘤的治疗方案差异明显,低级别脑胶质瘤一般采用单纯性手术切除治疗即可,而高级别脑胶质瘤需在手术切除后予以放疗或化疗辅助治疗;目前公认高级别胶质瘤术后放疗可以取得显著的生存获益(1级证据)[13]。因此,术前进行胶质瘤分级,对制订治疗方案有至关重要的作用。尽管MRI常规序列所表现的瘤周水肿、占位效应、出血、坏死等特征有助于临床诊断分级,但WHO Ⅱ级与Ⅲ级脑胶质瘤的影像学表现相似,难以满足临床脑胶质瘤分级评估的需要。因此,寻找一种更为准确、有效的影像学诊断方法对脑胶质瘤分级诊断尤为重要。
近年来通过MRI纹理分析判断胶质瘤级别的方法已取得一些进展[14-15],其主要是通过勾画和分析肿瘤成分特征的数据来区别高低级别胶质瘤[16]。但纹理分析存在人工提取数据工作量大,具有主观性等缺点;且对于某些纹理特征的诊断价值目前仍存在争议。而以机器学习为核心的人工智能技术可以使计算机获得自学习能力,整合分析各种数据,提高疾病的诊断和检出效率[17]。近年来,各种机器学习的网络模型已经越来越多地应用于肿瘤的诊断和鉴别诊断中。Kooi等[18]开发了一种在乳腺X线摄影中区分良性孤立性囊肿和恶性肿块的模型,并取得了满意的效果。Konda等[19]使用SVM学习了肝癌患者超声影像的特征,构建的诊断模型对判别良性肝占位及肝癌、转移性肝癌的准确率分别达到84.4%及87.7%、85.7%。Hussain等[20]通过卷积神经网络从脑胶质瘤患者的MRI图像中识别和分割脑肿瘤组织,结果显示该方法在识别肿瘤核心和肿瘤增强核心方面的特异性均达到了82%以上。Yuehao等[21]使用卷积神经网络对2014BRATS数据库的MRI图像进行分析,结果显示3层结构卷积神经网络在胶质瘤分级系统中的敏感性与特异性皆可达到0.733 3。
LeNet-5是卷积神经网络的一种,在LeNet-5模型中,每层的参数都可以被训练;其操作过程包括卷积层、采样层与全连接层,经过循环、训练得到网络预测模型[22]。为了提高机器学习在胶质瘤分级诊断中的正确率,本研究尝试改进了LeNet-5网络模型,用改进后的模型发掘胶质瘤影像的深层特征。在本研究使用760张胶质瘤影像数据集的训练中,原LeNet-5网络模型的表现并不理想,不能将WHO Ⅱ级与Ⅲ级胶质瘤区分开;但在网络末尾添加Softmax分类器后,分类结果得到了明显改善。Softmax分类器是深度学习中用于解决多分类问题的常用方法。Amin等[23]用深度学习的方法检测颅内肿瘤的研究表明,Softmax分类器在检测脑肿瘤方面可发挥重要作用。为了解决训练学习过程中容易产生梯度消失的现象,本研究用tanh激活函数及ReLU激活函数代替了sigmoid激活函数;经过对比,ReLU相对于其他两种激活函数更好地解决了梯度消失的问题。网络使用ReLU激活函数后,测试正确率较高,达到82.35%。本研究对胶质瘤模型测试显示,当epoch=45时,正确率达到最高,而epoch大于45时,趋于不变。测试结果表明,改进后的LeNet-5模型可以帮助医师对胶质瘤进行术前分级,有助于对患者进行个体化治疗。有研究认为,对于某些WHO Ⅲ级胶质瘤患者,手术中扩大切除胶质瘤,可能会改善患者的预后,提高生存期[24]。
查本研究也存在一些不足之处。由于本研究以改进网络模型为主要目标,纳入的病例数偏少,且只选取了T2WI图像。在本研究结果得到肯定之后,下一步需要使用大样本量数据集进行训练和测试,并尝试增加其他MRI序列,进一步验证网络模型对胶质瘤分级的效果。
综上所述,传统LeNet-5模型对胶质瘤分级诊断的效果并不理想;经添加Softmax分类器和更换ReLU激活函数后的改进LeNet-5网络模型,能较好地识别胶质瘤影像深层特征,测试正确率达到82.35%。相较于较传统网络模型,改进LeNet-5网络模型提高了胶质瘤影像分级的准确率,可为胶质瘤的术前分级、治疗方案制定提供帮助。
