高温胁迫下不同玉米花粉组蛋白Zm-H3基因的克隆及表达分析
2021-02-26徐劲松杨海鹏张红梅刘小红郝耀山
徐劲松,杨海鹏,张红梅,4,刘小红,郝耀山,孙 毅
(1.山西省农业科学院玉米研究所,山西 忻州 034000;2.西华师范大学生命科学学院,四川 南充 637002;3.山西省农业科学院生物技术中心,太原 030031;4.农业部黄土高原作物基因资源和种质创制重点实验室,山西 太原 030031)
温度是影响作物生长发育的重要因素,只有在适宜的温度环境中,作物才能较好地生长,进而实现高产[1-2]。然而进入21世纪以来,地球温室效应的加剧以及全球极端高温天气的频发,对粮食的正常生产已经产生了严重影响[3-4]。在作物生长周期中,营养生长阶段遭遇持续高温胁迫可能导致发育迟缓,植株矮小;但是在生殖生长阶段,尤其是在受精和灌浆早期如果遭遇高温胁迫,则可能会导致配子发育畸形,严重影响受精过程,对产量影响更大[5-7]。
对玉米来说,在生殖生长及受精结实阶段遭遇高温是一个常见的自然现象[8]。高温对雄配子(花粉)发育的影响要大于雌配子[9]。在雌雄穗分化至籽粒成熟阶段如果遭遇持续的高温胁迫,将造成败育小花数量增加、花粉结构破坏、活力下降、雌穗结实率降低,最终导致减产甚至绝收[10]。当然,不同玉米材料耐高温胁迫的能力存在差异[11-12],在国内耐高温玉米资源较少,目前仅有郑单958、中地88等较少的耐高温品种被选育推广。因此,以玉米花粉为对象,研究在高温环境下基因的差异表达具有重要意义。
组蛋白在真核细胞中具有非常重要的生物学功能,与基因组DNA一起构成了染色质,组蛋白帮助染色质折叠使其能装进细胞核的微小空间。组蛋白是含量极其丰富的蛋白质,在真核细胞中与DNA量大致相同。大多数的真核细胞含有5类不同的组蛋白:H 1、H 2 A、H 2 B、H 3和H 4,其中H 3组蛋白在不同物种中相当保守。目前,对组蛋白编码基因及其功能已有较多研究[13-17],包括H 3组蛋白[18-22]。但是关于玉米花粉细胞中组蛋白H 3基因在不同玉米材料中的差异表达研究还未见报道。
基于此,本实验选择了耐高温和不耐高温的2个玉米材料,在高温胁迫条件下,基于转录组测序,克隆了一个玉米花粉细胞中组蛋白H 3基因,并对该基因作了生物信息学和在不同材料中的差异表达分析,为其他基因类似结构和功能的研究提供参考。
1 材料与方法
1.1 材 料
本试验以耐高温胁迫的中地88和不耐高温的先玉335两个玉米品种为试验材料,由山西省农业科学院玉米研究所提供。
1.2 方 法
1.2.1玉米花粉采集
两份玉米材料种植于山西省农业科学院玉米研究所温室大棚,在散粉期于42 ℃高温环境取其花粉,每份材料取4株(作为4个生物学重复),每株取量约300 mg,分别装入1.5 mL灭菌离心管中并做标记,再用锡箔纸包好,迅速投入液氮罐中速冻,保存备用。
1.2.2总RNA的分离纯化
选用天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物总RNA 提取试剂盒(产品编号DP 441)提取总RNA(具体方法参照产品说明书),再对提取的总RNA利用Nanodrop NC 2000设备进行浓度的紫外定量测定及RNA完整性分析,对提取的RNA进一步用1%浓度琼脂糖凝胶进行电泳分析。
1.2.3转录组分析
对总RNA进一步作mRNA纯化、mRNA片段化、cDNA合成、文库片段的PCR富集、文库质检、Illumina平台高通量测序。该项工作在南京派森诺基因科技有限公司完成。
1.2.4玉米组蛋白Zm-H3基因的克隆及DNA序列
从返回的结果文件中,收索到了在2个玉米材料中存在差异表达的Zm-H3基因。先用DNAMAN Version 6软件对Zm-H3基因的DNA序列进行分析,包括脱氧核苷酸组成、序列长度及分子量等。
1.2.5玉米Zm-H3基因的生物信息学分析
1) 开放阅读框分析
通过网络在线软件(https://www.ncbi.nlm.nih.gov/orffinder/)对Zm-H3基因的DNA序列作开放阅读框分析,以寻找基因的编码区。再利用NCBI网站的蛋白质数据,将该基因预测的编码蛋白利用Blast在线软件作同源比对,以预测编码蛋白的生物学功能。
2) 编码蛋白的理化性质
对玉米Zm-H3基因编码蛋白的理化性质通过网络在线软件(https://web.expasy.org/protparam/)分析完成,具体内容包括氨基酸组成、等电点、分子量、分子式和原子构成、消光系数、不稳定指数、脂溶指数。此外,还进一步对该蛋白的亲水/疏水性作在线预测(https://web.expasy.org/protscale/),以确定该蛋白在生理条件下是亲水性蛋白还是疏水性蛋白。
3) 编码蛋白的功能位点
通过网络在线软件(https://prosite.expasy.org/)分析Zm-H3基因编码蛋白的常见功能位点,选择默认参数设置。
4) 编码蛋白的结构
通过网络在线软件(http://bioinf.cs.ucl.ac.uk/psipred/)预测Zm-H3基因编码蛋白的二级结构,分析可能形成的螺旋区域、折叠区域及无规则卷曲区域。通过网络在线软件(https://www.swissmodel.expasy.org/)分析蛋白可能形成的三级结构,基于蛋白质数据库的蛋白结构信息,以进一步确定该蛋白是否属于真核生物组蛋白H 3。
1.2.6玉米Zm-H3基因的差异表达分析
根据2份玉米材料各3次生物学重复的转录组高通量测序结果,分析Zm-H3基因在2份玉米材料间的差异表达情况。包括这2份材料各自均一化后的表达量、差异表达倍数及显著性等。
2 结果与讨论
2.1 总RNA的分离纯化
1) 浓度及完整性分析
第一次提取时,中地88提取了3株(编号为N 1、N 2、N 3)的花粉总RNA,先玉335也提取了3株(编号为BN 1、BN 2、BN 3)的花粉总RNA,浓度及完整性测定结果见表1,RNA总量最高的为N 1,达到了3.94 μg,最低的为BN 3,仅为0.57 μg。在这6个样品中,除BN 3外,其余5个样品的RNA总量、纯度及RIN值都达到了建库要求。对此,又提了1株(编号为BN 4)先玉335的花粉总RNA,浓度及完整性测定数据见表1,提取量达到了1.70 μg,RNA总量、纯度及RIN值都满足建库要求。由此,中地88的3次重复(N 1、N 2、N 3)和先玉335的3次重复(BN 1、BN 2、BN 4)进一步用于建库和差异表达分析。
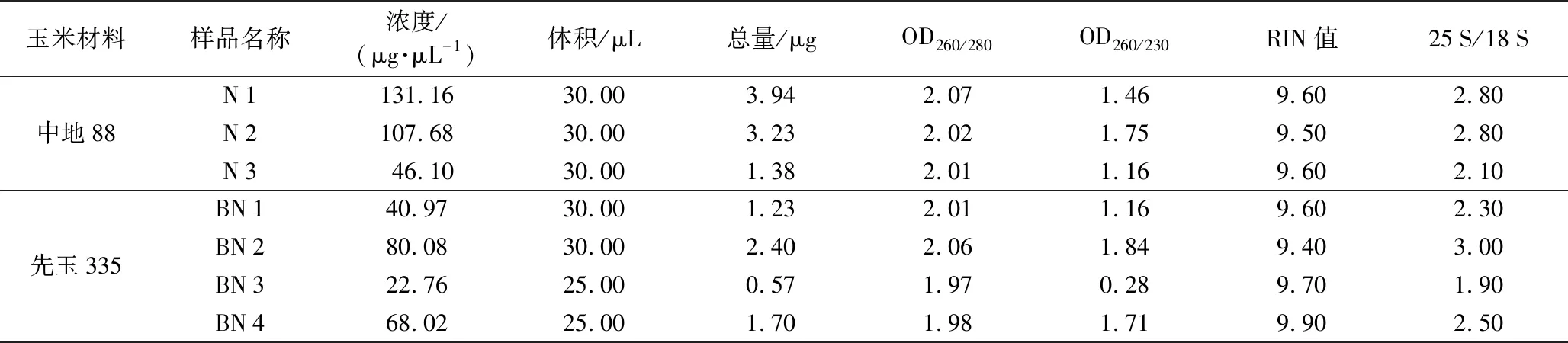
表1 提取总RNA的紫外分光光度计测定Table 1 Total RNA extract and determined by UV spectrophotometer
2) 电泳分析
对N 1、N 2、N 3、BN 1、BN 2、BN 3共6个RNA样品的琼脂糖凝胶电泳分析结果见图1(实际点样量分别为0.15、0.15、0.12、0.10、0.15、0.06 μg)。除编号为6的泳道(BN 3)的条带较模糊外,其余编号为1~5的条带都较清晰,该结果与表1数据中各样品中的RNA浓度测定结果一致。对提取的BN 4样品的RNA也进行了电泳分析,点样量为0.15 μg时显示条带非常清晰(未列出),与表1中同一编号的样品RNA浓度测定结果保持一致。
2.2 玉米Zm-H3基因的克隆
从转录组测序结果文件中分析得到了编码玉米组蛋白Zm-H3基因,ID号为Zm 00001 d 036036,位于玉米第6染色体上(67784534~67785534),该基因的编码链序列全长为904 nt (图2),含有A、C、T、G四种脱氧核苷酸的数目分别为192、259、253、200个,分子量为278.98 kDa。该基因转变成双链DNA后,分子量为557.38 kDa,GC含量为58.1%。
2.3 玉米组蛋白Zm-H3基因的生物信息学分析
1) 开放阅读框
将Zm-H3基因序列作开放阅读框分析,结果共显示了4个编码区,其中正链3个(蛋白长度为136、40、25个氨基酸),负链1个(蛋白长度为31个氨基酸)。因为导入的为DNA编码链序列,所以只考虑正链,再根据氨基酸序列长度及进一步的BLAST蛋白比对,确定Zm-H3基因的编码蛋白为组蛋白H 3,编码蛋白含136个氨基酸(图3),编码区为DNA序列中第98~508位,其中第98~100位和第506~508位分别为起始密码子和终止密码子。
2) 蛋白的理化性质
在线分析结果显示:在Zm-H3基因编码蛋白含有的136个氨基酸中,带负电荷的氨基酸共有11个(Asp+Glu),带正电荷的氨基酸共有31个(Arg+Lys);等电点为11.15,属碱性蛋白;蛋白的分子量为15 406.07,分子式为C679H1144N216O186S3,共由2 228个原子构成;如果所有半胱氨酸残基缩合成胱氨酸,该蛋白的消光系数则为4 470;不稳定指数为38.38,属于稳定蛋白;脂溶指数为83.38。
亲水/疏水预测结果如图4所示,亲水性总平均值为-0.602,最小值为-2.767(第41位的精氨酸),最高值为1.444(第101位的亮氨酸),属亲水性蛋白。
3) 蛋白的功能位点
玉米Zm-H3基因编码蛋白共预测到5个功能位点(表2),包括1个组蛋白H 3信号序列1、1个组蛋白H 3信号序列2、2个cAMP和cGMP依赖性蛋白激酶磷酸化位点、1个蛋白激酶C磷酸化位点。

表2 玉米Zm-H3基因编码蛋白的功能位点Table 2 Functional sites analysis of protein encoded by maize Zm-H3 gene
4) 蛋白的结构
对Zm-H3基因编码蛋白的二级结构作在线预测,结果如图5所示,包括:1) 7个螺旋区,具体位置包括:18-21、23-26、47-55、59-62、68-78、87-115和122-131;2) 10个卷曲区,螺旋区外的其它区域。没有预测到转折区。
利用SWISS-MODEL在线软件对Zm-H3基因编码蛋白的三级结构进行模拟,共有45个模板被显示,与Zm-H3基因编码蛋白的氨基酸序列一致性最高为96.32%,最低为62.14%,均值为71.95%。所有这些蛋白均显示为组蛋白H 3。这一结果也进一步证实本研究克隆的基因的编码产物为玉米组蛋白H 3。
2.4 玉米Zm-H3基因的差异表达分析
转录组测序的结果表明,Zm-H3基因在中地88和先玉335两个玉米材料上表现差异显著(表3),该基因在耐高温材料中地88中呈现高表达,而在不耐高温材料先玉335中呈现低表达,表达差异达2.08倍。

表3 玉米Zm-H3基因在不同玉米材料中的表达Table 3 Expression level of Zm-H3 gene in different maize materials
3 结 论
本实验以耐高温的中地88和不耐高温的先玉335为植物材料,在高温环境下利用转录组测序手段对玉米花粉组蛋白H 3基因进行了克隆及表达分析,得出结论为:
1) 2个材料共提取了7株玉米花粉的总RNA,其中有6株(各3个生物学重复)的RNA在浓度、总量和完整性3个方面均满足建库要求;
2) 克隆了一个组蛋白H 3基因(Zm-H3),该基因位于玉米第6染色体,全长cDNA为904 bp,编码长度为136个氨基酸的蛋白质,对该蛋白的理化性质、功能位点及结构分析也显示该基因为玉米组蛋白Zm-H3基因;
3)Zm-H3基因在42 ℃高温环境下,在中地88和先玉335两个玉米材料中呈现差异表达,在中地88材料中的表达量达到了先玉335的2.08倍。
本实验结果为玉米组蛋白H 3基因的应用奠定分子基础,也为其它基因的克隆及表达分析提供参考。
