原发性肝癌超声造影表现及其分化程度的关系
2021-02-26马小琳谭翔文蔡浦玉陆文婧
马小琳 谭翔文 蔡浦玉 陆文婧
1.上海市长征医院超声科 (上海, 200051) 2.上海市长宁区天山中医医院 3.上海市长宁区天山中医医院
肝细胞癌(HCC)是临床较为常见的恶性上皮细胞性肿瘤,发病原因与病毒感染、肝硬化、化学致癌物、酗酒、遗传突变等有关。根据细胞组织病理学分化程度可分为高、中、低分化类型,高分化型最常见于早期肿瘤,中、低分化主要见于实性生长类型,中晚期居多[1]。早期诊断对提高临床疗效和改善生存结局有重要意义。超声造影(CEUS)可以实时、动态、准确和清晰地显示肿瘤形态、增强和血管灌注等信息,同时造影剂不会渗出到血池外,安全性较高,可对HCC进行定性和定量诊断[2,3]。HCC 的典型 CEUS 特征为动脉期肿瘤内部造影剂迅速填充呈高增强,在门脉期迅速消退呈低增强[4]。研究表明,肿瘤CEUS 特征与肿瘤分化程度相关,而不同分化程度肿瘤的治疗方式、预后等也会有所不同[5]。本研究观察了原发性HCC患者CEUS表现与肿瘤临床病理分化程度间的关系,探讨CEUS在早期辅助HCC临床诊断中的重要意义。
1 资料与方法
1.1 一般资料 2018年6月至2019年8月我院住院治疗的原发性HCC患者92例为研究对象。其中男46例,女46例;年龄45~79岁,平均(57.9±11.1)岁;肿瘤直径2.5~6.9 cm,平均(4.6±0.7)cm。
1.2 纳入及排除标准 纳入标准:①经病理确诊为HCC;②既往无手术、射频消融、放化疗、生物免疫治疗;③顺利完成CEUS检查,图像清晰可比较;④签署同意知情书,临床资料完善。排除标准:①同时合并病毒性肝炎活动期、严重肝硬化;②严重肝肾功能障碍;③肿瘤位置欠佳,或患者过于肥胖导致成像质量不佳。
按照肿瘤病理分化程度分为高、中和低分化组,高分化组患者24例,男13例,女11例;年龄48~77岁,平均(58.3±8.7)岁;肿瘤最大直径2.5~6.5 cm,平均(4.5±1.2)cm。中分化组患者36例,男19例,女17例;年龄45~79岁,平均(57.7±8.2)岁;肿瘤最大直径2.7~6.6 cm,平均(4.6±1.3)cm。低分化组患者32例,男15例,女17例;年龄47~75岁,平均(57.6±7.8)岁;肿瘤最大直径2.7~6.9 cm,平均(4.6±1.4)cm。3组患者的性别、年龄、肿瘤最大直径比较均差异无统计学意义(P>0.05)。
1.3 检查方法 采用德国Siemens Acuson Sequoia 512型彩色多普勒超声诊断仪,凸阵探头,频率为 5~25 MHz,造影剂为意大利Bracco公司的声诺维(SonoVue,59 mg/支)。
患者取仰卧体位、平静呼吸,首先行常规二维多普勒超声检查,发现病灶后记录病灶大小、位置、回声特征及边界等。然后选取直径最大的病灶固定探头,选择造影模式(低机械指数状态,只显示造影剂的谐波信号)进行观察,把超声造影剂SonoVue与0.9%氯化钠溶液混匀稀释,经上肢外周静脉快速团注2.4 ml,速度1.8 mg/ml,同时超声仪计时器计时,分3个时相(动脉相、门脉相及延迟相)实时造影剂灌注观察,最少观察6 min,使用高清硬盘刻录全程。由2名经验丰富超声医师对造影图像逐帧分析,独立判断,观察病灶和周围肝组织各时相的造影增强情况,记录相应数据。
肝脏 CEUS 的时相分为动脉相(8~30 s)、门脉相(31~120 s)和延迟相(121~360 s)。病灶观察包括增强开始时间、增强程度(均匀高强化、均匀等强化、不均匀高强化、不均匀等强化)、增强模式(快进快出、快进同出、快进慢出)。CEUS增强期的定量参数包括始增时间、达峰时间和峰值增强时间。
1.4 统计学方法 采用SPSS20.0统计软件对3组间计量资料作单因素ANOVA分析,两两比较采用LSD-t法检验,计数资料作χ2检验,两两比较采用分割法;P<0.05为差异有统计学意义。
2 结果
2.1 3组患者不同时相的增强强度比较 见表1。不同分化组患者在动脉相主要表现为高增强,门脉相时增强信号逐渐减低,延迟相时主要表现为低增强,不同分化程度HCC CEUS 增强强度差异无统计学意义(P>0.05)。
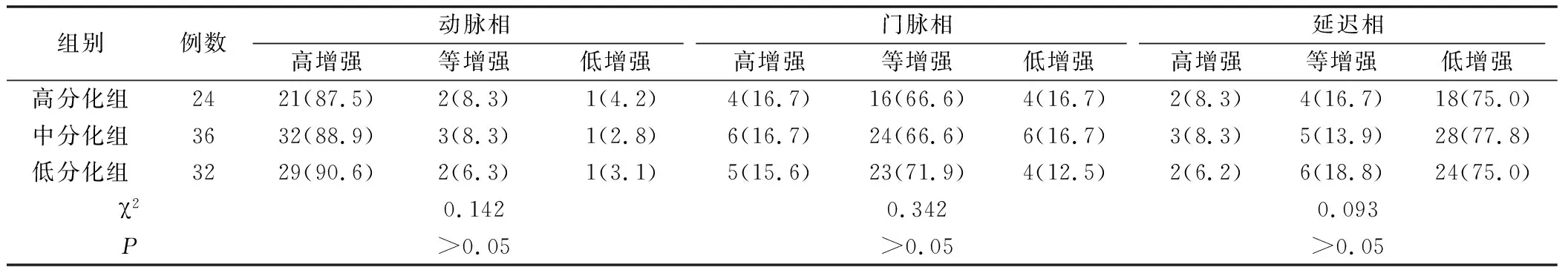
表1 3组不同时相的增强特点 [例(%)]
2.2 3组患者主要增强模式比较 见表2。高分化组以快进快出或快进慢出最多见,而中、低分化组则以快进快出为主,不同分化程度HCC CEUS 增强模式差异有统计学意义(P<0.01)。
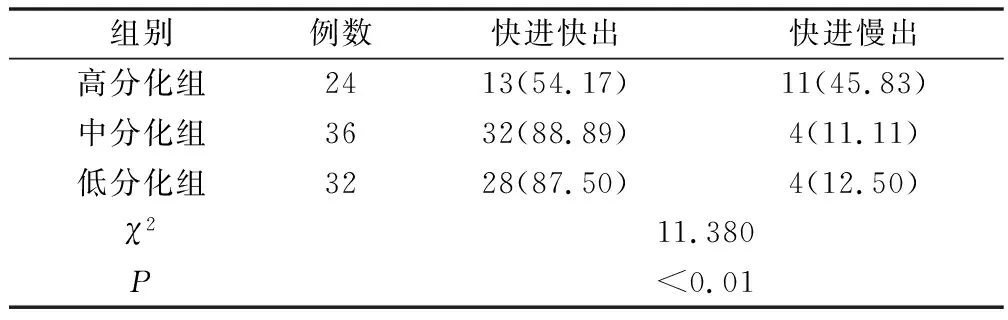
表2 3组主要增强模式的比较 [例(%)]
2.3 3组患者增强期主要时相参数比较 见表3。3组患者达峰时间和峰值增强时间比较,差异有统计学意义(P<0.01)。高分化组患者达峰时间和峰值增强时间明显大于中分化组,低分化组(P<0.05),3组患者始增时间比较,差异无统计学差异(P>0.05)。

表3 3组增强期主要时相参数的比较 (s)
3 讨论
HCC的发生与病毒性肝炎、肝纤维化、肝硬化的逐步进展过程密切相关,在肝硬化结节向HCC转变过程中,肝动脉血供逐渐取代门静脉成为主要滋养血管。不同分化程度 HCC 的治疗方案有所不同,其预后也不尽相同。不同病理分级和病理类型 HCC 具有不同血供,导致肿瘤的生长和浸润方式、转移途径有所不同。因此,提高术前确诊率和准确的术前分期已成为治疗的首要问题。
超声增强检查属于间歇扫描成像,仅在不同时相期的固定时间点进行扫描,由于患者病情不同,增强开始与持续时间有较大差异,固定时间点静态扫描很容易错开短暂的动态变化特征,增加漏诊或误诊风险[6]。CEUS在低机械指数下采用声振方法制备造影剂,使造影微气泡不易破裂能通过肺循环,持续时间较长,可以动态、实时通过谐波成像等技术观察[7]。
CEUS具有以下优点[8-10]:①操作简便,不需对扫描时点进行预先设定,无需团注跟踪,可实时、动态、不间断观察;②安全可靠、重复检查,很少发生过敏反应,造影剂用量小,肝肾毒性小,患者耐受性好;③真正的血池造影,造影剂中含有六氟化锍,稳定性好,在低机械指数下微泡的谐振好不易破裂,获取实时谐波和基波图像,噪声小。据报道,CEUS 诊断肝脏良恶性肿瘤的敏感度可达92%,特异度可达 100%,其诊断水平优于增强 CT和 MR,因此 CEUS 可作为肝脏肿瘤的首选检查方法。众多研究表明,HCC CEUS 增强强度与肿瘤内部的微血管密度密切相关,而 CEUS增强模式则与肿瘤分化程度相关。
本次研究笔者观察了原发性HCC患者的CEUS特征,与肿瘤临床病理分化程度间的关系,结果发现高、中、低分化组患者都具有快进快出的征象,同时高分化组还表现为快进慢出,主要由高分化HCC自身病理特点决定,不仅以肝动脉供血,还以门静脉供血,通过门静脉时造影剂微泡注入较缓慢[11]。高、中、低分化组的达峰时间和峰值增强时间比较,逐渐缩短,而始增时间比较无差异,与其他的研究结果基本一致[12]。分化程度低HCC肿瘤组织血管结构紊乱、管径粗、数量多,血循环增快,在单位体积和时间相同情况下,造影剂进入量相对较多,产生的声学折射、反射和散射程度强烈且稳定,同时肿瘤增强更明显,很容易达到峰值强度,峰值增强时间也越短[13-15]。
但本次研究存在一定的不足,笔者未对患者的更多CEUS特征与免疫指标进行分析,同时未能对患者进行随访,分析各参数与生存的关系。下一步我们打算增加样本量,分析CEUS特征与临床病理参数、预后的关系。
综上所述,HCC患者的超声造影表现分为“快进快出”和“快进慢出”不同征象,超声造影参数与肿瘤分化程度有关,对肝细胞癌的诊断具有重要意义。
