miR-155-5p在肝细胞癌中的表达及其作用机制*
2021-02-26喻茂文黄淑彬陈永刚
喻茂文 黄淑彬 陈永刚
1.四川大学华西医院金堂医院检验科 (四川 成都, 610400) 2.陕西中医药大学附属医院输血科
原发性肝细胞癌(HCC)是一种较为常见、且极具危害性的消化道恶性肿瘤,常被认为是所有恶性肿瘤中第二致命的癌症[1]。近年来随着诊疗水平的不断提高,针对HCC的诊断、治疗技术取得了巨大的进步,但HCC早期诊断率依然较低,晚期患者预后差,患者5年的生存率不足5%[2]。随着近年来肝切除和移植技术取得了巨大进展,HCC患者的死亡率有所下降,但其复发率仍然高达60%[3],且对常规化疗不敏感,导致HCC患者的预后仍然不佳。因此,HCC的早期发现尤为重要。
MicroRNA(miRNA)可通过与靶基因mRNA 的3’端非编码区(3’-UTR)结合调控靶基因的表达,是一种转录后调节基因,广泛参与细胞的分化、增殖和凋亡[4]。最近一项研究揭示了miRNA在HCC起始和进展中的重要性[5],表明miRNA可能会成为肿瘤诊断和治疗的潜在靶标。miRNA 155(miR-155)位于21号染色体上,由B细胞整合簇转录而成[6]。除了参与促炎反应外,最新的证据还表明miR-155在几种实体瘤的癌变过程中具有重要作用,包括结肠癌、乳腺癌和胰腺导管腺癌[7]。Guo等[8]报道miR-155可以作为突变体,且炎症环境可能是miR-155连接炎症和癌症的潜在机制。Xia等[9]使用了一种化学致癌作用的小鼠模型,该研究证明了miR-155表达在疾病进展中逐渐增加且记录了肝细胞的转化,表明miR-155异常表达可能在肝癌的发生发展中发挥了一定作用。有研究通过生物信息学预测miR-155可与转录调节子性别决定区Y框6(SOX6)结合,研究报道SOX6作为一种抗癌基因,在肝癌中也具有抗癌作用[10]。而有关miR-155与SOX6的靶向调节在HCC中的作用及其可能机制的研究目前尚未见报道。因此,本研究通过检测miR-155-5p在HCC中的表达情况并验证其与SOX6的靶向性,初步探讨两者的关系及其可能的作用机制,为HCC的靶向治疗提供新的理论依据。
1 材料与方法
1.1 样本收集及临床资料 收集2017年1月至2019年10月在四川大学华西医院金堂医院胆外科手术切除的HCC组织标本26例,及每例均匀对应的癌旁组织。男性15例,女性11例;年龄42~78岁,平均(56±9.3)岁;术后均经病理结果证实均为 HCC,临床病历资料完整且术前患者均未行化疗、放疗及介入等其他相关辅助治疗。肿瘤的TNM分期标准采用美国癌症联合会(AJCC)第8版标准[11]:其中Ⅰ~Ⅱ期者16例,Ⅲ~Ⅳ期者10例;肿瘤分级标准采用Edmondson分级法:其中Ⅰ~Ⅱ级17例,Ⅲ~Ⅳ级9例。将所有标本放置-80℃冰箱冷冻保存,行实时定量PCR(qRT-PCR)实验检测。研究得到我院伦理委员会批准,所有患者均已签署知情同意书。
1.2 细胞系 将HCC细胞系HepG2,Huh-7和Hep-3B用含10%胎牛血清(FBS)及1%青霉素/链霉素的DMEM完全培养基培养。人肝细胞系HL-7702和HCC细胞系SMMC-7721均置于含1%青链霉素及10% FBS的RPMI-1640培养基中培养。所有细胞系均购自于中国科学院上海典藏细胞库,并置于37℃,5%CO2培养箱中培养,每2~3 d进行常规换液及传代。
1.3 主要仪器与试剂 RPMI-1640培养液购于美国Sigma-Aldrich公司,DMEM培养液、TRIzol试剂盒、Lipofectamine 2000 Reagent试剂盒均购自美国Invitrogen公司;逆转录试剂盒购于中国大连Takara Bio公司;Annexin V/FITC-PI凋亡试剂h盒及CCK-8细胞增殖试剂盒均购于上海碧云天生物有限公司;流式细胞仪FACS Calibur FCM购于美国BD Biosciences公司;倒置显微镜购于美国Nikon公司;SOX6-wt或SOX6-mut的pGL3对照荧光素酶报道基因载体购于美国Promega公司。
1.4 qRT-PCR检测 将收集HCC患者癌组织、癌旁组织及各种肿瘤细胞按照TRIzol试剂盒说明书的提取组织或各种肿瘤细胞的总RNA。使用逆转录试剂盒合成cDNA,并使用SYBR green one进行定量PCR。 PCR反应如下:95℃持续30 s,60℃持续30 s,72℃持续30 s,共40个循环。miR-155-5p正向引物序列为5'-TTAATGCTAATCGTGATAGGGGT-3',反向引物序列为5'-GGAACGCTTCACGAATTTG-3';SOX6正向引物序列为5'- GGAACGCTTCAC GAA TTTG-3',反向引物序列为5'- CCTCTACCTCACCACATAAGC-3'。GAPDH和U6分别用作SOX6和miR-155-5p的内参基因,进行了3次独立的实验。
1.5 细胞转染及分组 取对数生长期的HepG2细胞,用胰酶消化,离心后,调整细胞密度为5×105个/ml接种于6孔板,待其细胞融合度达80%左右时,采用Lipofectamine 2000 Reagent试剂盒进行细胞转染,其操作严格按照其说明书进行。转染48 h后收集各组细胞进行后续试验。将HCC细胞系HepG2分为四组:用模拟物对照转染的细胞是阴性对照组(NC)组,用miR-155-5p模拟物转染的细胞是miR-155-5p模拟物组。与miR-155-5p模拟物和SOX-NC共转染的细胞为miR-155-5p+NC组,而与miR-155-5p模拟物和SOX6共转染的细胞称为miR-155-5p+SOX6组。
1.6 HepG2细胞增殖的检测 将不同处理组的HepG2细胞以1.5×104个/ml接种96孔板细胞培养板内,用完全DMEM培养基于37℃ 5% CO2培养箱内分别常规培养0、24、48、72、96 h,随后采用CCK-8法检测各组细胞活力。即每孔中加入100 μl的CCK-8试剂溶液,于37℃ 5% CO2培养箱内继续培养1.5 h,于450 nm波长处在酶标仪上测定各组细胞的OD值。 细胞的存活率(%)=(实验组OD值/对照组OD值)×100%,实验独立重复3次。
1.7 细胞凋亡检测 取不同处理的对数生长期的HepG2细胞用0.25%胰蛋白酶消化,1 000 g离心3 min,收集各组细胞,并调整各组细胞密度以2×105个/ml接种到6孔培养板,以完全DMEM培养液培养24 h。次日弃去原培养液,胰酶消化并收集各组细胞,并向每个孔中加入200 μl HEPES,5 μl Annexin V/FITC和5 μl PI,于室温下避光孵育15 min。借助FACS Calibur FCM观察其各组细胞的凋亡情况,实验独立重复3次。
1.8 HepG2细胞划痕实验 将处于对数生长期经转染的HepG2细胞以5×104个/ml的密度接种在6孔板中,待其融合度达90%后, p200尖端刮擦细胞,并用无血清培养基一式3份轻轻吹打,以含10%FBS的降低血清的培养基于37℃ 5% CO2培养行中共孵育24 h。分别在0、24和48 h处,借助Nikon显微镜观察细胞在伤口边缘附近迁移情况。通过ImageJ软件测量由细胞迁移引起的刮擦区域大小的变化,检测细胞的伤口愈合能力。
1.9 Transwell法检测HepG2细胞侵袭能力测定 采用涂有Matrigel(BD Bioscience,San Jose,CA,USA)的8 μm孔transwell小室进行Transwell试验分析。首先于下腔室中盛有500 μl含10%FBS的DMEM培养基,随后在每个上腔室中加入100 μl含细胞培养基。于37℃ 5%CO2培养箱中孵育24 h,弃去未侵袭的细胞,并用甲醇固定侵袭的细胞。经500 μl结晶紫染色,通过显微镜观察和计数细胞的侵袭能力。
“待会儿我就告诉何东,我不怕死人。”何北挑衅地看着何西,其实他是嘴硬,他不是不怕死人,死人的事儿谁不怕?他也怕二伯上他爸爸那儿告状,可何东就这么结了婚,他觉得自己太不仗义。
1.10 双荧光素酶报告基因检测 采用Starbase(http://starbase.sysu.edu.cn/)预测HCC的潜在结合位点。借助Lipofectamine 2000试剂盒,其操作按照说明书执行。将含有SOX6-wt或SOX6-mut的pGL3对照荧光素酶报道基因载体与miR-155-5P模拟物共转染或控制进行HepG2细胞转染48 h,依据其试剂盒说明书操作。裂解细胞,采用Dual-Glo荧光素酶测定系统(Promega,美国)测量细胞裂解物中的荧光素酶活性。实验至少重复3次。
1.11 统计学分析 应用SPSS 22.0软件进行统计学分析。符合正态分布且方差齐性检验合格后,采用单因素方差分析,组间比较采用Dunnett法分析;不符合正态分布则用非参数检验进行分析。检验水准α=0.05。
2 结果
2.1 miR-155-5p和SOX6在肿瘤组织中的表达情况 与癌旁组织相比,miR-155-5p在肝癌组织的表达明显升高且差异具有统计学意义(P<0.01);而SOX6的表达量较癌旁组织显著下降(P<0.01)(图1)。

图1 miR-155-5p及SOX6在肝癌组织及癌旁组织中的表达情况
2.2 肝细胞癌细胞系模型筛选 与正常细胞系HL-7702相比较,miR-155-5p在各肿瘤细胞系表达量均有不同程度升高且差异有统计学意义(P<0.01);而SOX6 mRNA在各肿瘤细胞系表达量均出现不同程度下降,且HepG2 SOX6 mRNA相对表达下降最为明显(图2)。
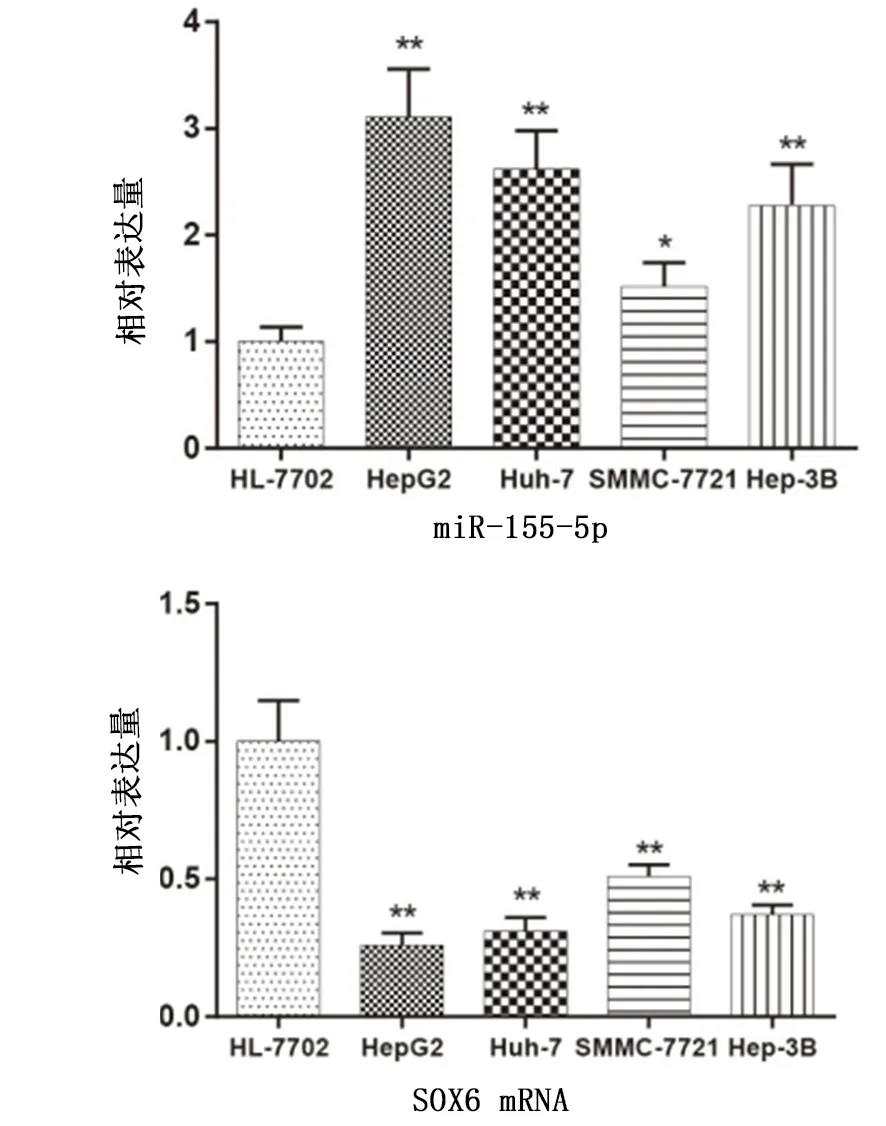
图2 miR-155-5p及SOX6在各细胞系中mRNA的表达情况
2.3 不同处理组对HepG2细胞活力及凋亡的影响 与miR-155-5p+NC组比较,SOX6过表达可有效抑制miR-155-5p促进HepG2肿瘤细胞增殖,且差异有统计学意义(P<0.01)(图3)。与miR-155-5p+NC组比较,miR-155-5p+SOX6组细胞凋亡率出现显著上升且差异有统计学意义(P<0.01)(图4)。
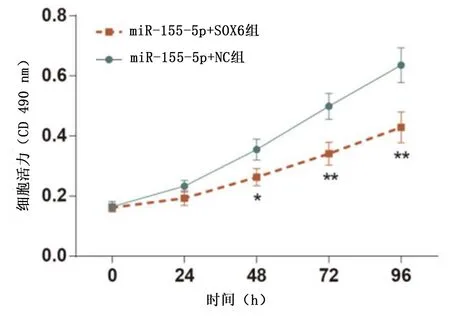
图3 不同处理组HepG2细胞在各时间点增殖情况
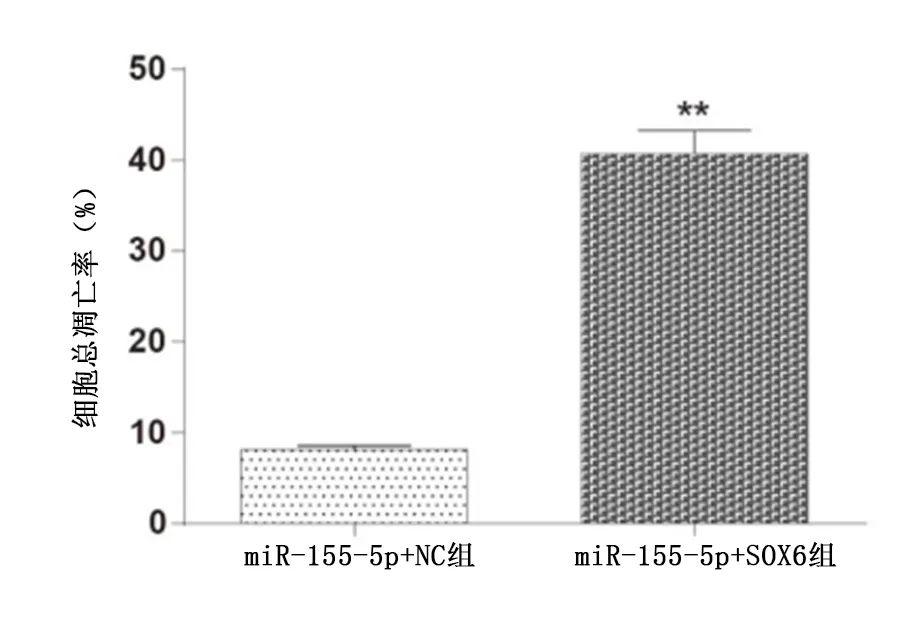
图4 流式细胞术分析不同处理组HepG2细胞的凋亡情况
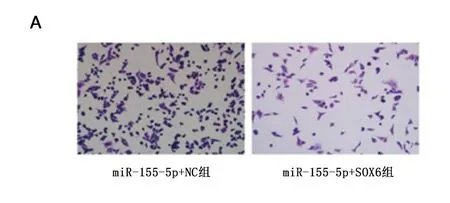
2.4 不同处理组细胞迁移及侵袭能力的分析 与miR-155-5p+NC组相比较, miR + SOX6组HepG2细胞的伤口更宽,侵袭细胞较少,表明SOX6可以减少HCC细胞的迁移和侵袭(P<0.05)(图5,6)。

图5 不同处理组HepG2细胞迁移率情况
2.5 miR-155-5p和SOX6的靶向性验证 miR-155-5p和WT-SOX6-3'UTR共转染可抑制萤光素酶活性(P<0.01),而用Mut-SOX6-3转染的细胞在有或没有miR-155-5p模拟物的情况下,UTR均未表现出荧光素酶活性降低(图7)。


图7 双荧光素酶检测miR-155-5p与SOX6的结合情况
3 讨论
肝癌的发展是一个涉及多个因素的过程。 迄今为止,该肿瘤致病机制的研究热点主要集中在与细胞信号相关的分子变化或基因组变化领域。有文献报道称,miRNA与免疫系统相关的炎性疾病有关[12]。最近也有研究发现miRNA与胰腺癌[11]、淋巴性白血病[12]等多种恶性肿瘤的发病机制密切相关。此外,Guo等[8]报道了人类原发性肝癌组织中miR-155水平的显著增加。然而,据前期文献查询发现围绕miR-155可能在HCC进展中发挥作用的详细机制研究尚未见报道。有学者发现miR-155表达的升高与HBV感染相关的HCC患者有关。与无病肝组织中的水平相比,miR-155的表达水平在HCC肿瘤组织和邻近的无肿瘤组织中均升高,尽管仅肿瘤组织的增加差异有统计学意义(P<0.05)。在观察相邻的肝硬化,无肿瘤组织中miR-155表达水平也升高,这表明HBV相关HCC的前期存在miR-155早期畸变[13]。在某种程度上,该结果与He等[14]报道相似,后者观察到非肿瘤组织中的miR-155表达高于正常肝组织,且与本研究结果相一致。
众所周知,SOX基因通过编码蛋白质转录因子SOX6参与癌细胞生物学过程的调控[15]。而SOX6作为一种抗癌基因,可以抑制多种癌症中的细胞增殖和致瘤性[16]。目前有一些研究表明SOX6在HCC中也起着抗癌作用。例如,有研究揭示了SOX6作为HCC患者的一种新的预后生物标志物,发现SOX6低表达与不良预后之间的紧密联系[17]。本研究通过HepG2细胞增值、凋亡及划痕和Transwell试验证实了SOX6可抑制miR-155-5p对HepG2细胞生物学行为的影响,并且通过双荧光素酶报告验证了miR-155-5p可靶向SOX6基因发挥其抑制肝癌细胞增殖及迁移侵袭的生物学作用。
本研究主要分析了miR-155-5p在肝癌组织及各种肝癌细胞系中的表达情况,并根据生物信息预测结果验证了miR-155-5p与SOX6靶向性,并分析其对HepG2细胞增值及迁移的影响。由研究结果可知:与对应癌旁组织相比较,miR-155-5p的mRNA 在肝癌组织中显著升高(P<0.01),而肝癌组织中SOX6 mRNA的表达量较癌旁组织显著下降(P<0.01)。通过细胞转染miR-155-5p模拟物和SOX6 cDNA分子可获得miR-155-5p和SOX6的过表达的细胞。由RT-qPCR结果显示:SOX6可逆转miR-155-5p对HepG2细胞增值及迁移侵袭。这表明miR-155-5p可抑制肿瘤抑制基因SOX6表达,并促进HepG2细胞的增殖、迁移和侵袭。
综上所述,miR-155-5p在HCC及HepG2细胞中高表达,可促进HepG2的增殖、迁移与侵袭,并可靶向调节SOX6基因的表达,可为HCC的早期治疗提供潜在的靶点。尽管如此,本研究依然存在许多局限性,实验结论可能存在一定的偏差。如临床样本不足,以及miR-155-5p的表达异常是否跟肝癌的临床基本特征存在相关性,因此后续将会扩大样本量、进行多中心对照研究,深入探讨miR-155-5p作为HCC生物标记物的临床应用价值。
