载伊立替康微球经肝动脉栓塞联合全身化疗与单纯全身化疗对不可切除胃癌肝转移的疗效比较
2021-02-25郑瑞
郑瑞
在肿瘤内科临床上,胃癌作为常见的一种消化道疾病,属于恶性肿瘤范畴,近年来其发病率呈现出逐年上升趋势,严重危害患者的机体健康和生命安全[1]。针对早期发病者,可通过手术治疗有效控制病情,获得满意的治疗效果。但是,由于胃癌的发病较为隐匿,早期缺乏典型的症状和体征,大部分患者发病后已发展到了中晚期,针对这类患者则不建议采取手术切除治疗,临床上多采取化疗治疗,以控制病情进展,延长患者的生存周期,提高其生存质量[2]。而针对合并有肝转移的患者,单纯给予全身化疗效果不明显,临床上多采取微球经肝动脉栓塞(DTACE)联治,医院对收治的该类患者积极采取全身化疗联合伊立替康DTACE联治,获得了满意疗效,总结报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年6月1日-2019年6月1日阳新县人民医院肿瘤科临床收治的胃癌不可切除且伴随肝转移患者80例的临床资料,按照不同疗法进行分组分为甲组和乙组,每组40例。甲组男20例,女20例;年龄62~80(66.50±2.50)年;肿瘤大小1~5.80(2.88±0.50)cm;发病部位:胃窦20例,贲门部8例,胃小弯12例。乙组男22例,女18例;年龄60~75(66.55±2.18)年;肿瘤大小1~5.88(2.78±0.48)cm;发病部位:胃窦18例,贲门部10例,胃小弯12例。2组患者一般资料比较差异无统计学意义(P>0.05),可进行比较。
1.2 纳入及排除标准 纳入标准:患者生存时间均>3个月;入院后经MRI或CT检查,均确诊为原发性胃癌,且合并肝转移;患者的造血功能均处于正常状态;本研究经医院医学伦理委员会审核批准,患者家属均知晓研究内容并签署知情同意书;患者的语言能力、理解能力等均正常,且具有较高的治疗依从性。
排除标准:原发性肝癌患者;对本研究所用药物有过敏症状患者;合并严重肝功能障碍患者;存在介入禁忌证患者;精神疾病患者;合并大量腹水患者;中途退出研究者。
1.3 方法 甲组单纯接受替吉奥与伊立替康全身常规化疗治疗,首日给予注射用盐酸伊立替康(江苏恒瑞医药股份有限公司生产,国药准字H20040711)150 mg/m2静脉滴注,时间30~40 min,次日开始口服替吉奥胶囊(江苏恒瑞医药股份有限公司生产,国药准字H20100135),若患者体表面积<1.2 m2,替吉奥用药剂量为40 mg;体表面积为1.2~1.5 m2,剂量为50 mg;体表面积>1.5 m2则剂量为60 mg。每天口服2次,连续1周。
乙组在甲组化疗基础上给予伊立替康DTACE联治:患者取仰卧体位并加强心电监护。按Seldinger法进行穿刺后将插管插至肝总动脉处,经DSA确定肿瘤的数量、大小等信息,再将微导管插至肿瘤靶血管。取100~300 μm的CalliSpheres载药微球,并与20 ml的注射器针头连接,将微球瓶稍加后抽出微球与0.9%氯化钠注射液,并选择三通管连接,设置好经肝动脉栓塞(TACE)治疗装置后,采用5%葡萄糖注射液溶解伊立替康,剂量标准为150 mg/m2,用10 ml的注射器抽出溶解后的药液并连通TACE治疗装置上,将微球内物质与药液充分混合后再加入离子对比剂摇匀。借助微导管并按照每分钟1 ml的速度将微球送至肿瘤动脉,若期间存在停滞或缓慢,可暂停操作5 min再进行;如肿瘤血供较为丰富,可根据实情加用空白微球。术后加压包扎患者的动脉1 d,同时加强止吐、护胃等对症处理。2组疗程均为1年。
1.4 观察指标 (1)治疗前后血清指标变化,采集患者晨起空腹静脉血3 ml,离心留取血清,以免疫法检测血管内皮生长因子(VEGF)水平、以发光法检测胸苷激酶1(TK1)水平。(2)治疗前后免疫指标,包括CD4+、CD8+及CD4+/CD8+。(3)治疗效果。(4)生存质量,参照Karnofsky(KPS)评分标准,改善:患者KPS评分较治疗前增加≥10分;稳定:患者KPS评分较治疗前增加<10分;降低:患者KPS评分较治疗前减少,但减少<10分。(5)不良反应:呕吐、恶心以及腹泻、骨髓抑制等[3-4]。
1.5 疗效评定标准[5-6]治疗效果分为4个等级,即完全缓解、部分缓解、稳定和进展。(1)完全缓解:治疗后患者肿瘤彻底消失,且疾病症状与体征也完全消失,时间维持30 d以上;(2)部分缓解:治疗后患者肿瘤的体积较治疗前显著缩小,且缩小的范围≥50%,疾病症状和体征均显著改善,时间维持30 d以上;(3)稳定:治疗后患者肿瘤体积较治疗前缩小,但缩少范围<50%,或肿瘤体积较治疗前有所增加,但增加范围<25%;(4)进展:治疗后患者的病情无好转或出现恶化,病情显著加重。总有效率=(完全缓解+部分缓解+稳定)/总例数×100%。

2 结 果
2.1 血清指标水平比较 治疗前,2组患者VEGF、TK1水平比较差异无统计学意义(P>0.05);治疗后,2组VEGF、TK1水平均较治疗前降低,且乙组水平低于甲组,差异均有统计学意义(P<0.01)。见表1。

表1 2组患者治疗前后血清指标水平比较
2.2 免疫功能指标比较 治疗前,2组患者CD4+、CD8+、CD4+/CD8+值比较差异无统计学意义(P>0.05);治疗后,2组CD4+、CD4+/CD8+值较治疗前升高,乙组CD4+、CD4+/CD8+值高于甲组,CD8+值低于甲组,差异均有统计学意义(P<0.01)。见表2。

表2 2组患者治疗前后免疫功能指标比较
2.3 治疗效果与生存质量比较 治疗后,乙组患者总有效率为67.50%,高于甲组的45.00%,差异有统计学意义(χ2=4.114,P=0.043);乙组生存质量降低率为25.00%,低于甲组的50.00%,差异有统计学意义(χ2=5.333,P=0.021)。见表3。

表3 2组患者治疗效果与生存质量情况比较 [例(%)]
2.4 不良反应比较 2组不良反应总发生率比较差异无统计学意义(χ2=0.050,P=0.823)。见表4。
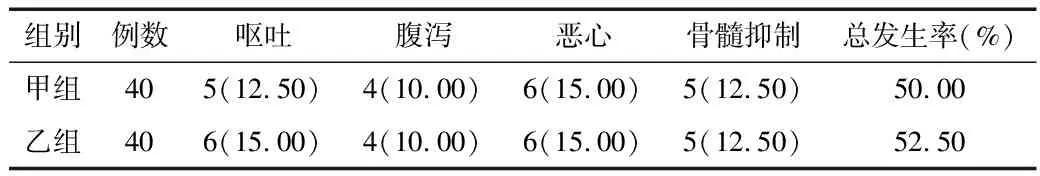
表4 2组患者治疗不良反应发生情况比较 [例(%)]
3 讨 论
近年来,随着胃癌临床患病率逐年增加,使其成为危害人类健康与安全的恶性肿瘤疾病之一,其临床治疗广受关注[7]。针对胃癌患者,需做到早确诊、早治疗,但由于早期发病具有一定的隐匿性,很多患者在确诊时已经发展为中晚期,错过了手术治疗的最佳时机。而针对这类胃癌不可切除患者而言,发生肿瘤转移的风险高,一般以肝转移最常见,而这类合并肝转移的胃癌患者,也意味着其病情进入了晚期阶段,无彻底根治的可能性,临床上多采取姑息化疗,以延长患者的生存周期,改善晚期的生存质量为主要目标[8-9]。
本研究结果显示,2组患者治疗前血清指标水平及免疫功能指标比较差异无统计学意义(P>0.05),治疗后2组VEGF、TK1水平均较治疗前降低,且乙组水平低于甲组(P<0.01);且治疗后,2组CD4+、CD4+/CD8+值较治疗前升高,乙组CD4+、CD4+/CD8+值高于甲组,CD8+值低于甲组(P<0.01)。说明与单纯使用全是化疗治疗相比,对胃癌不可切除且伴随肝转移的患者实施化疗与伊立替康DTACE联治,更能改善免疫功能和血管内皮功能。结果还显示,治疗后,乙组患者总有效率为67.50%,高于甲组的45.00%(P<0.05);乙组生存质量降低率为25.00%,低于甲组的50.00%(P<0.05)。说明对胃癌不可切除且伴随肝转移的患者实施化疗与伊立替康DTACE联治的效果显著,可提高患者的生存质量。分析原因:因为TACE治疗能够使肿瘤细胞缺血而坏死,阻断其供血后达到抑制肿瘤增殖、转移的目的。VEGF在肿瘤细胞血管生成过程中起到重要作用,是导致细胞增殖和转移的重要因子,给予胃癌不可切除且伴随肝转移的患者实施化疗与伊立替康TACE联治后,VEGF水平显著降低,说明病灶血管生成受限[10-11]。此外,伊立替康对肿瘤DNA单链起到阻断作用,可抑制肿瘤DNA的复制,有利于控制病情进一步恶化。而替吉奥则能够干扰肿瘤DNA的不断复制,又能长时间维持药效,给药后药物直接作用于肿瘤处,局部药物浓度高,药效显著。因此在上述2种药物化疗治疗的过程中,再与伊立替康DTACE联治,能够获得更好的治疗效果,改善患者免疫和提高生存质量[12-13]。本研究中,甲组不良反应总发生率为50.00%,乙组为52.50%,2组比较差异无统计学意义(P>0.05)。说明对胃癌不可切除且伴随肝转移的患者实施化疗与伊立替康DTACE联治,不良反应发生率较高,建议治疗过程中临床医务人员需及时对症处理,以降低患者的痛苦[14]。
综上所述,对胃癌不可切除且伴随肝转移的患者给予化疗与伊立替康TACE联治的疗效突出,可改善患者血清指标和免疫功能,治疗总有效率高,提高患者生存质量,建议推广使用此疗法。
