新的/严重的药品不良反应70例报告分析
2021-02-25李颖慧李荣任小贺郝立志
李颖慧,李荣,任小贺,郝立志
2018年《国家药品不良反应监测年度报告》中指新的和严重药品不良反应/事件报告占同期报告总数的33.1%,报告比例持续增加[1]。新的药品不良反应(ADR)由于可预见性差,ADR发生后能及时辨别和处理显得尤为重要。严重的ADR一旦发生可能导致患者住院或者住院时间延长,甚至对人体器官功能造成严重损伤,危及生命安全,应引起足够重视。新的/严重的ADR上报、收集历来是《药品不良反应报告和监测管理办法》[2]实施的重要内容,新的/严重ADR的监测工作对指导临床合理用药、防止药害事件进一步扩大具有重要意义[3]。本文对医院近10年上报的70例新的/严重的ADR进行汇总分析,分析其发生的特点及规律,为医院临床安全用药提供参考。
1 资料与方法
1.1 资料来源 以2009-2019年首都医科大学密云教学医院上报至国家药品不良反应监测中心数据库的ADR报告为资料来源,从中筛选出新的/严重的ADR报告70例。
1.2 判定标准 新的、严重的ADR判定是根据国家药品监督管理局2011年颁布实施的《药品不良反应报告和监测管理办法》规定。
1.3 研究方法 将新的/严重的ADR报告中患者一般资料(包括性别、年龄、原患疾病、既往ADR史、家族ADR史)、合并及怀疑药品信息(包括药品名称、剂型、给药途径、用法用量、用药起止时间、用药原因、合并用药)、ADR名称、ADR发生过程的详细信息(包括发生时间、临床表现、对原患疾病的影响、转归及关联性评价)等导入Excel中进行分析。
2 结 果
新的/严重的ADR报告共70例,其中新的一般ADR 28例(40.00%),严重的ADR 41例(58.57%),新的严重ADR 1例(1.43%)。70例关联性评价结果:很可能34例(48.57%),可能36例(51.43%)。
2.1 患者一般情况 70例患者中男32例(45.71%),女38例(54.29%),男女比例约为0.84∶1;患者年龄16~92(53.38±19.63)岁,其中≥65岁26例,占37.14%。
2.2 患者既往ADR史、家族ADR史 70例患者中14例(20.00%)有既往ADR史,48例(68.57%)否认既往ADR史,8例(11.43%)既往ADR史不详;有家族ADR史的患者仅有1例(1.43%),38例(54.29%)患者否认家族ADR史,31例(44.28%)家族ADR史不详。
2.3 患者的合并用药情况 70例患者中合并用药者共18例(25.71%),其中2种合并用药者3例(4.29%),5种合并用药者2例(2.86%)。
2.4 ADR药品剂型、给药途径分布 70例ADR报告中,涉及药品剂型7种,其中注射剂27例(38.57%),粉针剂18例(25.71%),片剂15例(21.43%),胶囊剂6例(8.57%),散剂、滴丸及丸剂共4例(5.72%)。给药途径以静脉滴注为主,共38例,其次是口服给药,共25例。见表1。

表1 新的/严重的ADR给药途径分布
2.5 ADR涉及药品种类及分布 根据《新编药物学》[4]第17版对药品进行分类,70例ADR报告中主要涉及12类64个药品品种,排名前4位的是抗感染药物、心血管系统药物、中枢神经系统药物和中成药/中药注射剂。ADR所涉及的药品种类及具体药品名称,见表2。

表2 新的/严重的ADR涉及药品种类及名称
2.6 ADR累及系统/器官和主要临床表现 根据《WHO药品不良反应术语集》[5]对ADR/ADE患者的临床表现进行分类统计,70例ADR报告中累及10个系统/器官,其中累及最多的是全身性损害25例(28.41%);其次为皮肤及其附件损害、胃肠系统损害。所有ADR患者的临床表现中,发生频次较高的有过敏性休克、皮疹、恶心等。见表3。
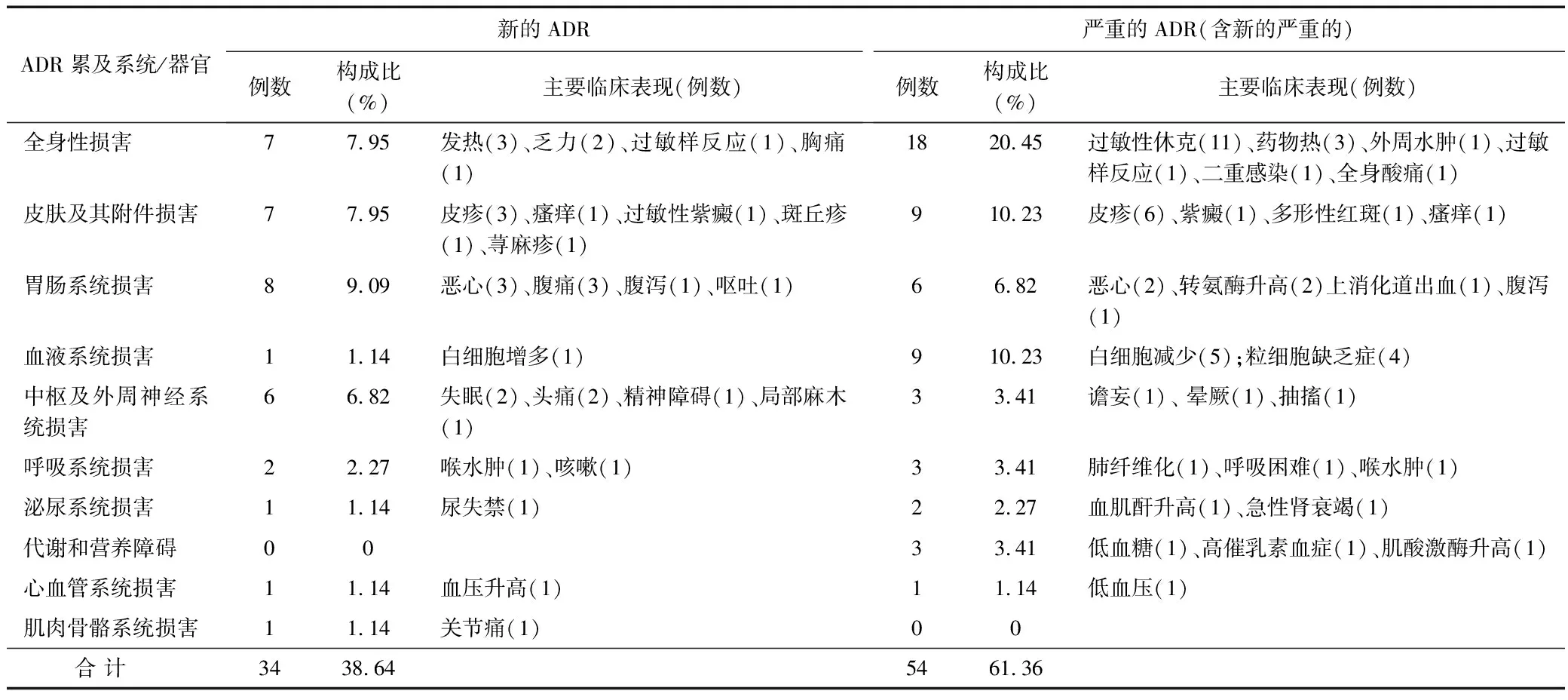
表3 新的/严重的ADR累及系统/器官和主要临床表现
2.7 ADR发生时间分析 用药后发生ADR的时间区间为2 min到半年以上不等。30 min内发生ADR共25例(35.71%),其中5 min内发生ADR有9例,主要为过敏性休克反应,30 min~2 d发生ADR共22例(31.43%),2~20 d发生ADR共20例(28.57%),半年及以上发生ADR有3例,分别是长期间断口服盐酸胺碘酮片引发肺纤维化、口服瑞舒伐他汀钙片引起肌酸激酶异常升高、口服环孢素软胶囊引起血肌酐明显升高。见表4。

表4 新的/严重的ADR发生时间分布
2.8 ADR对原患疾病的影响及转归情况 70例新的/严重的ADR中,56例(80.00%)对原患疾病病程影响不明显,12例(17.14%)使患者病程延长,1例(1.43%)使患者病情加重,1例(1.43%)导致后遗症。发生ADR的患者经停药或治疗处理后,痊愈35例(50.00%)、好转30例(42.85%)、未好转2例(2.86%),不详2例(2.86%)、有后遗症1例(1.43%)。
3 讨 论
3.1 患者年龄、性别及合并用药与ADR的关系 本结果显示,新的/严重ADR女性略多于男性,男女比例约为0.84∶1,与《国家药品不良反应监测年度报告(2018年)》报道的数据一致。其中≥65岁的26例,占37.14%,随着年龄的增长,严重ADR发生率增加。老年人往往患有多种疾病,多药联用,加上肝、肾生理功能减退,药物体内代谢和排泄能力降低,易导致药物在体内蓄积,用药过程中更容易导致新的/严重ADR发生[6-7]。合并用药及其合并用药数量的多少是老年人发生严重ADR的风险因素之一[8]。因此,临床应高度重视老年人合理用药问题,做到个体化给药,并将老年患者列为ADR重点监测对象。
3.2 ADR与给药途径 本结果显示,涉及的怀疑药品给药途径中静脉给药所占比例最高,包括静脉滴注、静脉注射及静脉泵注3种给药途径,共计42例(60.00%)。静脉给药避免了首关效应,药物直接进入血液,血药浓度迅速达峰,药物起效快,但因药物本身性质、制剂特点、配置操作、输注过程控制等诸多因素的影响,静脉给药风险较高,更易发生ADR/ADE[3]。静脉输液存在微粒污染、输液并发症和交叉感染等风险,可能造成人体过敏反应和热原反应的发生,严重者还可能引起休克甚至死亡[9]。临床应遵循“能口服不肌注、能肌注不输液”的给药原则,减少静脉给药带来的风险。
3.3 引起ADR的药品种类 本结果显示,涉及抗感染药物导致新的/严重ADR的占比最高。这与抗感染药物覆盖各临床科室、使用广泛、频率较高及患者个人体质有关。抗感染药物中比例最高的分别是头孢菌素类、氟喹诺酮类和青霉素类。头孢类新的ADR比较轻微,严重的ADR如注射用头孢哌酮钠舒巴坦钠引起过敏性休克,注射用头孢唑肟钠引起严重晕厥或紫癜等,口服头孢克肟片引起严重的白细胞减少;乳酸左氧氟沙星氯化钠注射液引起过敏性休克和盐酸莫西沙星氯化钠注射液引起严重神经系统反应。
文献报道69例抗菌药物致患者严重不良反应的临床表现多样[10],莫西沙星严重不良反应主要以神经系统和全身性损害为主[11]。使用喹诺酮类的ADR报告患者原患疾病均为肺部感染,指南指出对于需要住院的CAP患者,推荐单用β-内酰胺类或联合多西环素、米诺环素/大环内酯类或单用呼吸喹诺酮类[12]。但与联合用药相比,呼吸喹诺酮类单药治疗不良反应少,且不需进行药物过敏皮试,临床应用广泛,尤其针对肺部感染患者。因此,应严格掌握抗菌药物治疗的基本原则,且需要行药物过敏皮试的抗菌药物应严格执行相关规定。
3.4 ADR累及系统/器官、临床表现及发生时间 本结果显示,70例ADR报告主要累及全身,其次为皮肤及其附件损害、胃肠系统损害。全身性损害的临床表现中过敏性休克发生频次最高,给药途径均为静脉给药,绝大多数发生时间在30 min内,其中最多发生在0~5 min,结果与文献报道一致[13]。导致过敏性休克的药物品种众多,抗微生物药、中药注射剂、抗肿瘤药位居前三位。过敏性休克存在不可预测性,对患者危害较大,临床应重视其发生,用药前仔细咨询过敏史,注意用药过程监护,一旦出现ADR及时停药,并采取有效的抢救措施。
综上所述,通过汇总医院新的/严重的ADR数据,分析其临床特点,发现ADR发生与患者自身因素、给药途径和药品种类相关,累及多个系统/器官、临床表现多样。为防范新的/严重ADR发生,药师应积极开展ADR培训,提高医护人员对新的/严重ADR的正确认识和防范意识,定期对ADR情况进行汇总分析,为医师用药提供参考;医师应重视入院ADR史咨询工作和完善出院ADR史记录,尤其是严重ADR,当患者再次就诊系统会自动提示ADR信息,提高医护人员警惕;药品生产企业应加强关注药物警戒信息,做好药品上市后再评价工作,主动收集和整理新的/严重ADR,并及时更新药品说明书。
