miR-204过表达对喉鳞癌细胞增殖、周期、凋亡及侵袭的影响及机制
2021-02-25罗德艳冯俊彭涛唐一萍杨久梅
罗德艳,冯俊,彭涛,唐一萍,杨久梅
川北医学院第二临床医学院·南充市中心医院,四川南充637000
喉癌属头颈部恶性肿瘤,其主要病理学类型为喉鳞状细胞癌(鳞癌),该病早期诊断率低、长期生存率不高,且癌细胞增殖、侵袭是造成治疗失败的重要原因[1]。因此,探索喉鳞癌特异性分子标志物和有效的基因治疗靶点,对喉鳞癌早期诊治、有效治疗尤为重要。近年来研究表明,微小RNA(miRNA)在恶性肿瘤早期诊断、靶向治疗、预后评估等方面有良好应用前景[2]。miR-204 是 miRNA 成员之一,已有研究发现其在肝癌[3]、前列腺癌[4]、胃癌[5]、宫颈癌[6]等多种恶性肿瘤中呈低表达,上调miR-204 表达可抑制细胞增殖、侵袭并促进细胞凋亡。但目前国内外缺乏关于miR-204 与喉鳞癌的研究,并且有待进一步明确其作用机制。因此,2020 年4—7 月,本研究通过观察miR-204 过表达对喉鳞癌细胞生物学行为的影响,以期为喉鳞癌的靶向治疗提供新思路。现将结果报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 人喉鳞癌细胞株Hep-2 由华西医学实验中心惠赠;RPMI1640 培养基、胎牛血清购自美国 Hyclone 公司;LipofectamineTM2000、TRIzol 试剂购自美国Invitrogen 公司;逆转录试剂盒、qRT-PCR 试剂盒购自大连宝生物工程有限公司;miR-204 mimics及NC-mimics购自上海吉玛制药技术有限公司;miR-204 及U6 引物购自苏州金唯智生物科技有限公司;细胞凋亡试剂盒购自南京凯基生物技术股份有限公司;CCK8 试剂盒购自武汉博士德生物工程有限公司;一抗高迁移率组蛋白A2(HMGA2)和 GAPDH 抗体均购自美国 Santa Cruz 公司;HRP 标记的二抗购自美国Bioworld 公司;Tran⁃swell 小室购自美国 Corning 公司;基质胶、FACSCali⁃bur 流式细胞仪购自美国BD 公司;Light Cycler 480 PCR仪购自瑞士ROCHE公司;Synergy 4多功能酶标仪购自美国Bio Tek公司。
1.2 细胞培养及转染 将Hep-2 细胞培养在RP⁃MI1640 培养基(含胎牛血清10%、链霉素、青霉素)中,培养条件:37 ℃、5%CO2饱和湿度培养箱。取生长状态良好的对数生长期细胞随机分为miR-204 模拟物组、阴性对照组、空白对照组,根据Lipofectami⁃neTM2000转染试剂说明进行操作,miR-204模拟物组和阴性对照组分别转染miR-204 mimics(使miR-204过表达)和 NC-mimics(miR-204 mimics 的阴性对照),空白对照组不进行转染。。
1.3 Hep-2 细胞中miR-204 表达检测 采用qRTPCR法。转染后24 h,根据TRIzol法提取Hep-2细胞总RNA,紫外分光光度仪测定含量、纯度,将总RNA反转录为cDNA。以cDNA 为模板,加入引物,进行qRT-PCR 检测。miR-204 上游引物序列5'-TG⁃GTTTTTTTTTAAATTAAGTTAGTAAAGT-3',下 游引物序列5'-ACAACCTACACAAAACAACCTATA⁃ATC-3'。内参U6 上游引物序列5'-CTCGCTTCG⁃GCAGCACA-3',下 游 引 物序列 5'-AACGCTTCAC⁃GAATTTGCGT-3'。PCR反应条件:94 ℃预变性30 s,94 ℃变性 20 s、60 ℃退火 30 s、72 ℃延伸 30 s,40 个循环。以 U6 为内参,采用 2-∆∆Ct法计算 miR-204 的相对表达量。
1.4 Hep-2 细胞增殖能力检测 CCK8 实验。转染后24 h,取各组细胞,以100 μL/孔(约1×104个细胞)将细胞接种于96孔板中,各组设立6个平行孔,培养24、48、72 h 后,各孔加入 CCK8 试剂10 μL,继续于37 ℃培养4 h。用酶标仪测定各孔450 nm 波长处的吸光度(OD)值,以OD值代表细胞增殖能力。
1.5 Hep-2 细胞克隆能力检测 采用平板克隆形成实验。取转染24 h 后的各组细胞,胰酶消化,PBS洗涤,加入RPMI1640 培养基中,制备细胞悬液;稀释后每组以600个细胞/孔的密度,接种到6孔板;培养14 d,用PBS 洗涤,多聚甲醛4%固定15 min,清除固定液,细胞染色20 min,去染色液,室温干燥;显微镜下观察克隆,超于50 个细胞的集落表示为1 个克隆,计数克隆数。
1.6 Hep-2 细胞周期测定 采用流式细胞术。转染后24 h,取各组细胞,用PBS 洗涤,加70%预冷乙醇4 ℃固定;隔夜后离心,分离乙醇,去上清,PBS 洗涤,加碘化丙啶50 μg/mL、RNase 50 μg/mL,4 ℃避光染色30 min。用流式细胞仪统计各周期细胞,计算G0/G1期、S期、G2/M期细胞占总细胞的比例。
1.7 Hep-2细胞凋亡率测算 采用流式细胞术。转染后24 h,各组取1×105个细胞,离心5 min(1 000 r/min,离心半径10 cm),去上清液,加入结合液500 μL 重悬细胞;后加入 Annexin V-FITC 5 μL 混匀,加入Propidium Iodide 5 μL 混匀,室温孵育15 min。用流式细胞仪检测凋亡细胞,计算细胞凋亡率。
1.8 Hep-2 细胞侵袭能力检测 采用Transwell 实验。转染后24 h,取各组细胞,采用无血清培养基制备细胞悬液,取含 2×105个细胞(200 μL 单细胞悬液)加于预铺基质胶的Transwell 小室上室,将含10%胎牛血清的RPMI1640 培养基500 μL 加入下室,孵育24 h,取出小室,轻微擦拭上室细胞,除去未穿膜的细胞,用4%多聚甲醛固定,染色、风干,显微镜(×100)观察,随机取5个高倍视野,计数穿膜细胞数。
1.9 Hep-2 细胞内HMGA2 蛋白表达检测 采用Western blotting 法。转染后24 h,取各组细胞,提取细胞总蛋白,BCA 法检测蛋白浓度。取50 μg 总蛋白,应用10% SDS-PAGE 分离蛋白,将产物转到PVDF 膜上,用含有5%脱脂牛奶的封闭液在4 ℃条件下浸泡膜4 h,加入一抗HMGA2(1∶1 000 稀释)和GAPDH(1∶2 000 稀释),4 ℃条件下孵育过夜,TBS缓冲液洗膜后加入二抗IgG,在室温条件下继续反应2 h,ECL 显影液显影。HMGA2蛋白相对表达量=HMGA2条带灰度值/GAPDH条带灰度值。
1.10 统计学方法 采用SPSS22.0 统计软件。符合正态分布的计量资料用±s表示,三组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组转染后miR-204 表达比较 空白对照组、阴性对照组、miR-204模拟物组miR-204相对表达量分别为 0.97 ± 0.10、1.01 ± 0.09、10.54 ± 0.49。miR-204 模拟物组miR-204 相对表达量高于空白对照组、阴性对照组(P均<0.05),而空白对照组与阴性对照组miR-204 相对表达量比较差异无统计学意义(P>0.05)。
2.2 miR-204 过表达对Hep-2 细胞增殖能力的影响 培养24、48、72 h,miR-204 模拟物组OD 值均低于空白对照组、阴性对照组(P均<0.05),空白对照组与阴性对照组各时间点OD 值比较差异无统计学意义(P均>0.05)。见表1。
表1 三组培养不同时间细胞增殖能力比较(±s)
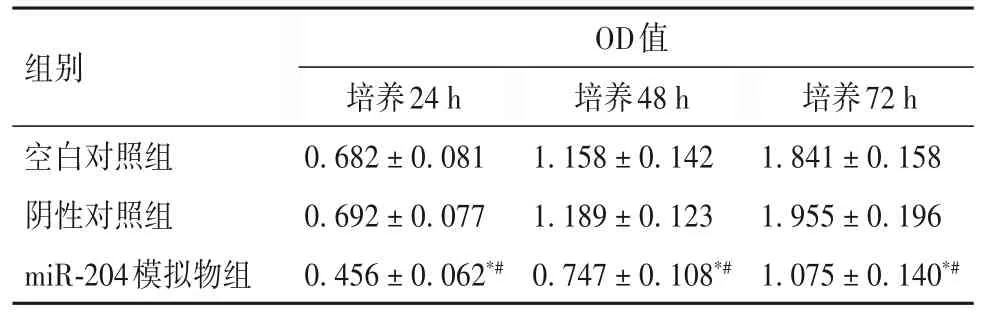
表1 三组培养不同时间细胞增殖能力比较(±s)
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
组别空白对照组阴性对照组miR-204模拟物组OD值培养24 h 0.682±0.081 0.692±0.077 0.456±0.062*#培养48 h 1.158±0.142 1.189±0.123 0.747±0.108*#培养72 h 1.841±0.158 1.955±0.196 1.075±0.140*#
2.3 miR-204过表达对Hep-2细胞克隆形成能力的影响 空白对照组、阴性对照组、miR-204 模拟物组、阴性对照组、空白对照组细胞克隆数分别为(120 ± 23)、(117 ± 18)、(55 ± 10)个。miR-204 模拟物组细胞克隆数低于空白对照组、阴性对照组(P均<0.05),空白对照组与阴性对照组细胞克隆数比较差异无统计学意义(P>0.05)。
2.4 miR-204 过表达对Hep-2 细胞周期的影响miR-204 模拟物组G0/G1期细胞比例高于空白对照组、阴性对照组(P均<0.05),S 期、G2/M 期细胞比例低于空白对照组、阴性对照组(P均<0.05);空白对照组与阴性对照组细胞周期分布比较差异无统计学意义(P均>0.05)。见表2。
表2 各组细胞周期分布比较(%,±s)

表2 各组细胞周期分布比较(%,±s)
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
组别空白对照组阴性对照组miR-204模拟物组Hep-2细胞G0/G1期44.95±7.26 46.62±7.59 68.19±9.45*#S期30.02±5.38 29.14±5.12 17.76±3.35*#G2/M期25.03±5.27 24.24±5.08 14.05±2.73*#
2.5 miR-204过表达对Hep-2细胞凋亡的影响 空白对照组、阴性对照组、miR-204 模拟物组细胞凋亡率分别为(4.87±1.89)%、(5.01±2.01)%、(21.64±4.89)%。miR-204 模拟物组细胞凋亡率高于空白对照组、阴性对照组(P均<0.05),而空白对照组与阴性对照组细胞凋亡率比较差异无统计学意义(P>0.05)。
2.6 miR-204 过表达对Hep-2 细胞侵袭能力的影响 空白对照组、阴性对照组、miR-204 模拟物组穿膜细胞数分别为(200± 28)、(195± 25)、(103± 17)个。miR-204 模拟物组穿膜细胞数低于空白对照组、阴性对照组(P均<0.05),而空白对照组与阴性对照组穿膜细胞数比较差异无统计学意义(P>0.05)。
2.7 miR-204 过表达对 Hep-2 细胞 HMGA2 蛋白表达的影响 空白对照组、阴性对照组、miR-204 模拟物组HMGA2 蛋白相对表达量分别为0.99 ± 0.09、1.02± 0.11、0.39± 0.14。miR-204 模拟物组Hep-2细胞HMGA2 蛋白相对表达量低于空白对照组、阴性对照组(P均<0.05),而空白对照组、阴性对照组HMGA2 蛋白相对表达量比较差异无统计学意义(P>0.05)。
3 讨论
miRNA 是特异性结合靶基因mRNA 的非编码小分子RNA,长20~25 个核苷酸,可引起靶基因mRNA 降解或抑制其翻译,从而达到调控下游基因的作用。目前认为,miRNA 广泛参与机体的生物学行为,与恶性肿瘤发生、进展、预后关系密切。许多异常表达的miRNA 在喉癌发生发展中起着癌基因或抑癌基因作用,可能为喉癌的靶向治疗提供新的方向。
miR-204 是miRNA 家族重要的成员,其编码基因位于人9 号染色体,研究发现其可能成为新的抑癌基因。研究发现,miR-204 过表达可促使色素上皮衍生因子失控,诱发前列腺癌[7-8]。而在头颈部鳞癌细胞中miR-204 过表达能够抑制肿瘤靶基因水平,并抑制细胞迁移、侵袭,发挥抑癌作用[9]。目前miR-204 在非小细胞肺癌[10]、卵巢癌[11]等肿瘤中的研究均发现,miR-204 过表达具有明确的抑癌作用。研究表明,miR-204 表达与p-STAT3 和抗凋亡基因Bcl-2 呈负相关,miR-204 过表达可抑制癌症细胞活力,诱导细胞凋亡[12]。但目前关于miR-204 对喉鳞癌的作用机制还有待进一步明确。本研究结果显示,miR-204过表达能抑制喉鳞癌Hep-2细胞增殖活性,同时降低细胞克隆形成能力;miR-204 过表达能够将喉鳞癌Hep-2 细胞周期阻滞于G0/G1期,并促进癌细胞凋亡;并且miR-204 过表达能够抑制喉鳞癌Hep-2 细胞的侵袭。以上提示miR-204 可能作为一种抑癌基因参与喉鳞癌的发生、发展过程。
HMGA2是高迁移率族蛋白超家族成员之一,其定位于人染色体12q13-15。HMGA2 在人正常组织中不表达或者表达极低,但是其在胚胎组织和人类许多恶性肿瘤组织中表达异常增高[12]。既往研究表明,HMGA2在绝大多数恶性肿瘤中作为癌基因发挥促癌作用[13]。研究已经证实HMGA2 在喉鳞癌细胞和组织中表达异常增高,抑制喉鳞癌细胞HMGA2能够抑制癌细胞的增殖及侵袭能力,并促进其凋亡[14-17]。近期研究发现,miR-204 在结肠癌[18]和甲状腺癌[19]中均能够通过调控HMGA2 发挥抑癌作用。本研究发现,miR-204过表达能够明显抑制Hep-2细胞中HMGA2 蛋白的表达,提示miR-204 过表达对Hep-2 细胞增殖、凋亡、细胞周期及侵袭的影响可能与其对HMGA2蛋白表达的抑制作用有关。
综上所述,miR-204 过表达能够将喉鳞癌Hep-2细胞周期阻滞于G0/G1期,抑制细胞增殖、侵袭,促进细胞凋亡,其机制可能与其对HMGA2 表达调控有关。这可能成为喉鳞癌的潜在治疗靶点,为临床诊治提供新的方向。
