3D联合超声造影引导多针经皮微波消融治疗复发性肝癌
2021-02-25李洁雷其理肖亿梁家瑜董金达孙兴马少波苏泽张智方兆山
李洁,雷其理,肖亿,梁家瑜,董金达,孙兴,马少波,苏泽,张智,方兆山
原发性肝癌(hepatocellular carcinoma,HCC)是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁我国人民的生命和健康[1]。局部热消融被认为是手术之外最有效的局部治疗方式,对于早期HCC,其治疗预后可与手术相当[2]。微波消融(microwave ablation,MWA)是近十年来快速发展的HCC局部热消融治疗技术,在安全性及有效性方面优于射频消融、无水乙醇注射及冷冻消融等[3]。MWA治疗复发性肝癌(复发性HCC)具有疗效确切、微创、安全、耐受性好,且可重复性强,是治疗HCC术后复发的理想选择[4]。meta分析[5]显示MWA在总体生存时间、无病生存时间和肿瘤复发率等可能优于肝切除术;而且相比于肝切除,WMA手术时间更短,手术中失血更少,并发症少。B型超声引导WMA治疗HCC具有创伤小、恢复快、并发症少、肿瘤坏死彻底、远期预后较好等优点,广泛应用于临床。但也存在一些局限性,比如对于较大的肿瘤病灶,可能出现“漏空现象”而导致消融不够致术后易复发[6]。三维可视化(three dimensional visualization,3D)技术引导下予以WMA治疗HCC可以提高患者的生存率,降低HCC复发率和并发症发生率[7]。超声联合3D技术引导下WMA治疗HCC,具有快速、精确、安全等特点,能增加肿瘤灭活率,延长患者生存时间[8]。与2D术前规划组相比,3D术前规划组在HCC微波消融首次消融成功率较高[9]。消融边界与肿瘤局部进展密切相关,即不足的消融边界可能导致较高的肿瘤局部进展[10]。安全消融边界是指为保证局部消融疗效,除需要消融灭活整个肿瘤组织外,还需要消融灭活距离肿瘤周围组织0.5~1.0 cm的正常肝脏组织[11]。因此术后及时准确的安全边界的评估是HCC消融治疗的重要环节。由于复发性HCC患者病情相对复杂,且对于直径>3 cm的复发性HCC微波消融相关研究较少。本研究拟采用三维可视化联合超声造影引导多针经皮微波消融治疗复发HCC,并采用CT-3D图像融合技术评估消融安全边界,评估经皮微波消融治疗复发性HCC的临床价值。现报道如下。
1 资料与方法
1.1 一般资料
本研究为前瞻性研究,选取2018年3月至2021年3月广西医科大学第五附属医院收治的75例复发性HCC患者。纳入标准:①所有HCC患者诊断均符合《HCC诊疗规范(2017年版)》[12],术前未接受化疗、放疗等抗肿瘤治疗;②经病理确定为HCC;③单发肿瘤,最大直径>3 cm,且≤6 cm;④多发肿瘤,最大直径≤5 cm,肿瘤数≤2个;⑤无门静脉、肝静脉、胆管癌栓和肝外转移,肿瘤距肝门部胆管、胆囊或胃肠的距离>5 mm;⑥肝功能Child-Pugh分级为A级或B级;⑦自愿受试并在术前签署知情同意书。排除标准:①术前增强CT影像等显示有脉管癌栓;②伴其他恶性肿瘤。符合条件的3D+CEUS组32例,2D组43例,具体的分组为:即按入院的顺序入组,按第一个患者先入3D+CEUS组,第二个的入2D组,如按顺序不愿意进入3D+CEUS组,愿意参与研究的则可进入2D组,否则剔除,以此类推。两组的年龄、性别、肿瘤大小、乙肝(HBV)背景、Child-Pugh分级、术前谷丙转氨酶(ALT)、凝血酶原时间(PT)、血小板(PLT)等差异性比较均无统计学意义(P>0.05),见表1。本研究中所有针对入组病人的检查和治疗均通过广西医科大学第五附属医院伦理委员会伦理审查批准通过。
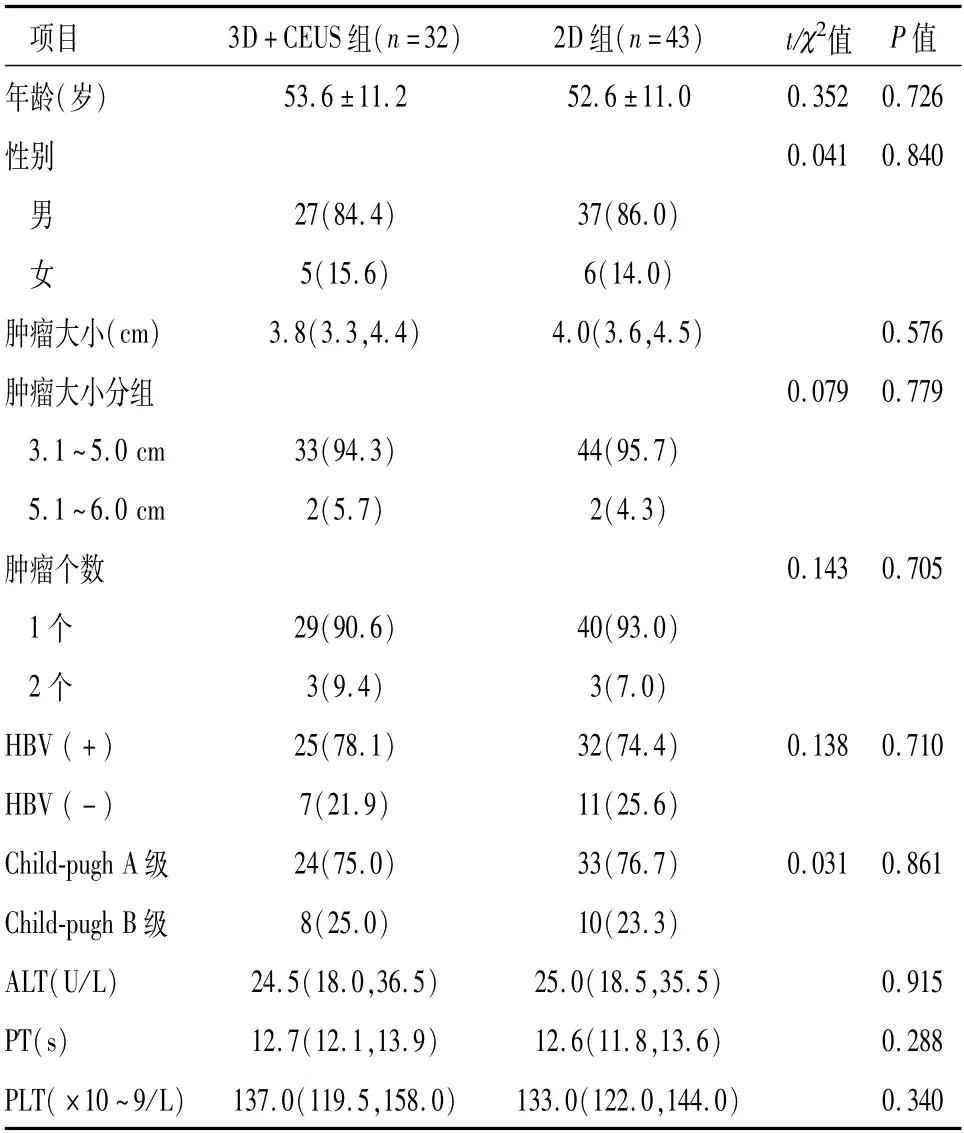
表1 两组的基本资料比较
1.2 仪器设备
①64层/128层螺旋CT(美国GE公司):获取WMA术前、术后二维CT DICOM数据(图1A、图1D);②三维重建采用一图智能三维可视化软件系统;③南京亿高微波系统工程有限公司所生产的ECO-100C肿瘤微波治疗仪,微波天线为该公司生产的一次性微波消融针;④超声诊断仪使用阿洛卡(ALOKA)多普勒彩色超声和配套的穿刺引导架,超声造影剂使用声诺维(注射用六氟化硫微泡)(意大利)。
1.3 微波消融治疗
2D组:具有丰富WMA治疗经验的医生组按照常规程序于术前通过患者二维CT评估肿瘤情况,初步确定穿刺部位。术中根据二维B型超声、增强CT等医学二维影像资料进一步确认WMA靶向位置,进行布针进行多针天线WMA治疗。消融功率设定为50~80 W。启动微波能量辐射后开始计时,时间5~10 min,进行多针叠加WMA,消融范围超出肿瘤边缘0.5~1.0 cm。完成上述操作后退针。术中B超动态观察消融情况。消融完毕后进一步确定肿瘤是否达到安全消融边界,必要时在补充消融。消融结束后,常规退针并毁损针道。拔针、术区覆盖无菌纱布。记录WMA针数及累积治疗时间。术后采用CT-3D图像融合[13]评价消融边界。
3D+CEUS组:采用3D联合CEUS引导多针电极WMA治疗。①术前3D重建[14]:将患者术前上腹部薄层CT数据(1.25 mm DICOM格式)导入3D软件系统,构建三维立体图像,构建出肝脏内解剖结构3D图像模型,并从各个角度、全方位的观察和定量分析;②3D分析和设计布针路线:采用3D技术进行术前规划,分析肋骨与肿瘤关系,设定布针路线,并于患者体表标记进针位置,制定个体化的WMA消融方案(图1B、图1C);③手术操作:结合术前3D分析和布针规划,气管插管全身麻醉后,先进行CEUS检查明确病灶后,结合术前3D分析制定消融治疗方案,确定布针方式及进针的角度。进一步确定布针后,麻醉医师控制暂停患者呼吸,微波消融针在术中超声引导下穿入肝脏病灶预定的位置。微波消融后即时行CEUS检查,CEUS评价消融,判断有残存肿瘤者给予即时补充微波消融。余同2D组。记录WMA针数及累积治疗时间。
1.4 安全消融边界的评估
采用CT-3D图像融合技术评估[13]。医学图像融合[15]是指:将相同或不同成像设备所获取的同一组织或器官的图像,利用计算机技术进行准确的配准和叠加等变换处理,和空间坐标上达到匹配,产生一种综合的信息影像。WMA治疗后1个月进行上腹部增强CT检查,进行术后二维CT数据三维重建。通过3D软件研发的图像融合功能,将患者术前(图1B)、术后3D图像(图1E)进行配准融合(图1F),即3D-CT图像融合技术,消融边界采用三维重建软件进行定量分析,安全消融边界定义距离肿瘤边界为0.5 cm。本研究所有患者接受WMV消融后,将患者术后复查的CT数据进行3D重建获得的3D图像与术前的3D重建图像进行图像融合(3D-CT图像融合),采用软件进行计算,消融距离肿瘤边缘≥0.5 cm(通过软件自动测量最短消融边界)则评定为达到安全消融边界,未达到0.5 cm则为不完全消融。2D组则术后1月才进行基于术前及术后的3D重建后进行3D-CT图像融合(目的是避免影响术者决策,并用于术后3D图像融合进行定量分析)后,评价消融边界(见图1F)。
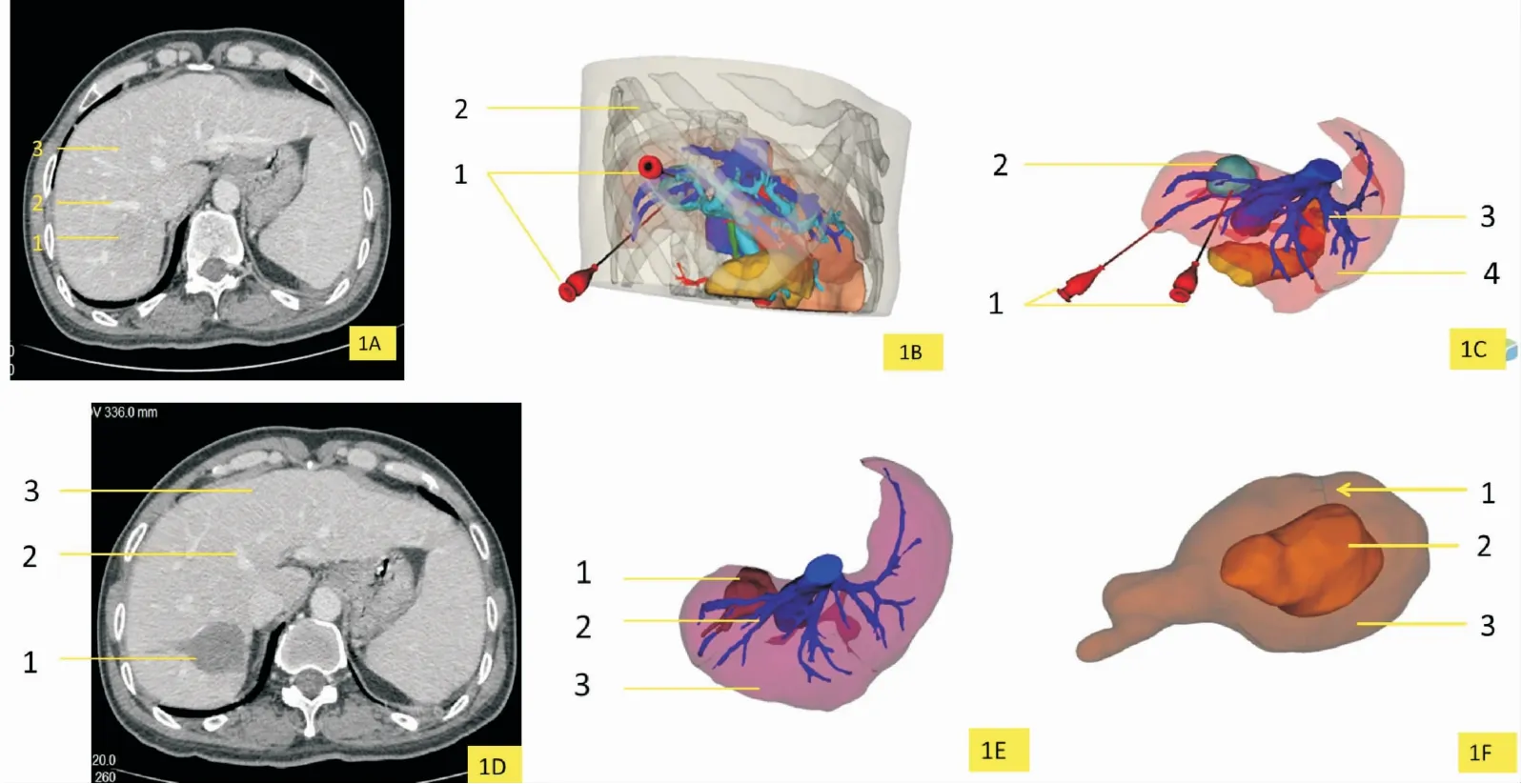
图1 复发性HCC微波消融图像和CT-3D图像融合评估消融边界图示,患者为肝右叶S5和S6段HCC行肿瘤切除术后1年复发,肿瘤复发病灶位于Couinuod S7段,直径大小为3.2 cm。图1A术前增强CT:1.肝癌肿瘤病灶2.肝右静脉3.肝脏;图1B 3D术前规划:微波消融布针路线1.两个虚拟消融天线2.肋骨;图1C 3D术前规划:微波消融布针路线1.两个虚拟消融天线2.肝脏肿瘤病灶3.肝静脉(蓝色)4.肝脏(粉色);图1D消融术后CT:1.消融区域2.肝中静脉3.肝脏;图1E消融术后3D图像:1.肿瘤消融区域2.肝右静脉3.肝脏(紫色);图1FCT-3D图像融合评估消融边界:1.图像融合后测量消融最短距离(显示6 mm)2.肿瘤病灶(棕色)3.消融区域(灰褐色)
1.5 随访
从完成WMV治疗时起计算随访时间。随访按照治疗后第1月、3月、6月、12月,然后每6月1次随访进行。技术有效定义为在WMV治疗后1个月经CT增强影像检查结果为肿瘤完全坏死。累积治疗时间:B超探查确定进针路线时起,以及消融治疗时间的总和,以及(和)CEUS的时间总和计为累积治疗时间。局部肿瘤进展定义为:增强影像学检查发现毁损灶中或附近肝脏组织中出现新的瘤灶。通过随访,收集患者生存情况。以WMA至诊断肿瘤复发的时间为无瘤生存时间,总体生存时间为手术当日至死亡的时间(或最后一次随访),局部复发率为随访期内肿瘤复发患者与总体患者相比,总体生存率为随访期内患者存活与总体患者相比。
1.6 统计学处理
采用SPSS19.0统计软件进行数据处理。计量资料符合正态分布采用表示,不符合正态分布的采用M(Q1,Q3)表示;计数资料采用率%表示。计量资料符合正态分布的采用t检验;如不符合正态分布,则采用两个独立样本的非参数Mann-WhitneyU检验;计数资料采用χ2检验或Fisher确切概率检验。无瘤生存时间和总存活(时间)率采用Kaplan-Meier生存分析,差异性比较采用Log-rank检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
3D+CEUS组完全消融率为96.9%显著优于2D组的79.1%,差异具统计学意义(P<0.05),见表2。3D+CEUS组中位无瘤生存时间792 d,优于2D组的726 d,两组的无瘤生存时间有统计学差异(Log-rankχ2=8.186,P=0.04),见图2。
2.2 两组的总存活(时间)率及肿瘤局部进展率比较
3D+CEUS组总体生存率84.4%,2D组总体生存率76.4%,差异性比较无统计学意义(P>0.05)。两组的总体生存时间无统计学差异(Log-rankχ2=3.326,P=0.071),见图2。3D+CEUS组局部复发率为31.3%,2D组局部复发率为41.9%,差异性比较无统计学意义(P>0.05),见表2。

图2 Kaplan-Meier生存曲线图
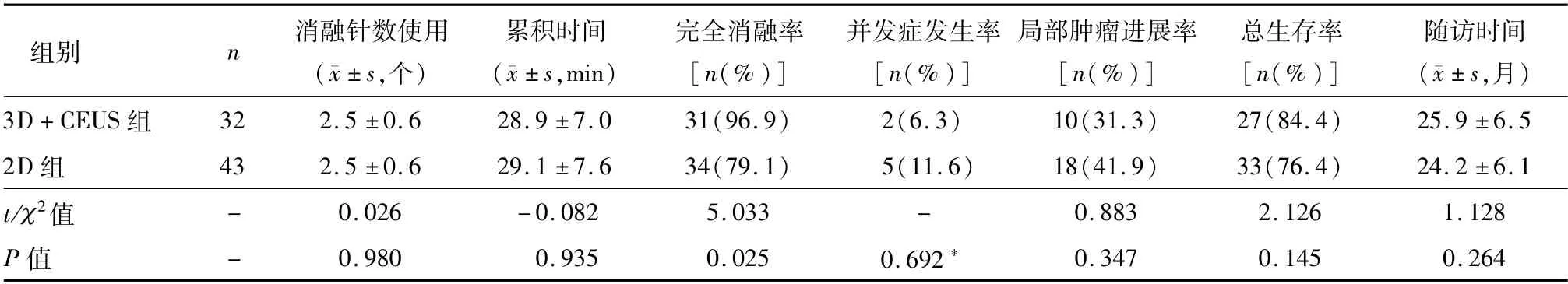
表2 两组微波消融术后的结果比较
2.3 两组的术后并发症比较
3D+CEUS组并发症发生率6.3%(2/32),其中1例术后出现胸腔积液,1例肝脓肿,均予穿刺引流、抗感染后治愈。2D组并发症发生率11.6%(5/43),其中2例胸腔积液,2例肝脓肿,1例胆汁漏,经积极穿刺引流、抗感染等治疗治愈。两组并发症发生率差异无统计学意义(P>0.05)。见表2。
2.4 两组的随访时间比较
两组的随访时间比较差异无统计学意义(P>0.05),见表2。
3 讨论
3.1 经皮WMA治疗复发性HCC的临床价值
在合适的HCC患者,外科手术是HCC的首选治疗方法,彻底的外科手术切除能提高患者远期预后[16]。但由于存在肝外转移、侵及血管、邻近重要解剖结构、严重肝硬化致肝体积过小、病灶过多等原因,仅有不足30%的HCC患者适宜手术切除[17]。经皮WMA治疗为微创治疗手段已常规应用于肝脏肿瘤的治疗[18],对于不能手术切除、2~3个癌灶位于不同区域或者位居肝脏深部或中央型的肝癌,局部消融可以达到手术切除相当疗效[19]。在符合米兰标准的复发HCC的治疗显示[20]:①WMA可获得与再手术切除相当的早期生存率,且疗效优于TACE治疗;②WMA和TACE与再手术切除相比具有微创性、术后恢复快、住院时间短等优点。MWA具有升高温度速度快、消融范围广、实时控温、可多点消融的优点。单针序贯WMA效果不等同于多针WMA产生消融效果。多针同步消融效果可产生更高的温度、更大的消融融合区域范围[21]。3针天线同步微波消融可获得较大的消融面积,对直径最大为6 cm的HCC亦能获得完全消融[22]。3针天线消融的直径、体积比2针天线消融的大,且具有统计学差异[23]。随着消融功率的增加,加上更大的功率天线和多针天线布阵,WMA可消融更大的范围区域,可实现消融的直径>7cm的肿瘤或更大的肿瘤[24]。WMA治疗复发性HCC可能的优势:(1)可重复性,较适用于不适合或不愿意开腹手术的患者;(2)创伤小,并发症的发生率低,住院时间短,术后恢复快;(3)可能增强免疫功能[25-26]。且相比于TACE,超声引导HCC消融治疗,可提高HCC患者的长期疗效[26],如HCC消融治疗再联合化疗[27]或联合保肝治疗[28]或联合胆管引流冷却[29]有助于提高治疗安全性和确保疗效。
3.2 3D技术联合CEUS在复发性HCC微波消融的价值
3D技术可帮助术者从不同的视角对肿瘤进行分析,整体把握肿瘤病灶的空间关系[30]。3D术前规划平台可以提高消融治疗的精准度,优化治疗方案,提高术者消融治疗信心[31]。术前3D分析帮助制定详细的消融计划,有助于减少手术的盲目性。通过对复发性HCC术前3D分析,选择合适的射频针数、模拟射频,设计合理的针道并标记,手术中联合CEUS实时观察、引导,更好的达到消融安全边界。本研究显示,3D+CEUS组完全消融率为96.9%,2D组达到完全消融率79.1%,3D+CEUS组完全消融率优于2D组,差异有统计学意义(P<0.05)。术中联合CEUS靶向多针天线布控WMA,同时CEUS全程监控WMA过程,术后即时CEUS评估WMA疗效,如仍有肿瘤残留或未达安全消融边界,即时补充WMA[32]。说明3D联合CEUS消融更为精准。在3D技术引导下予以WMA治疗HCC可以提高患者的生存率,降低HCC复发率和并发症发生率[7]。CEUS联合3D技术引导下WMA治疗HCC,具有快速、精确、安全特点,能增加肿瘤灭活率,延长生存时间[8]。有研究显示,3D术前规划组首次完全消融率为97.72%,而常规CT/MRI术前规划组的为79.69%,即3D组(36病人44个肿瘤病灶)只有1个病灶需再次消融,而2D组(58个病人64个肿瘤病灶)有13病灶需再次消融[9],3D组获得更高的首次消融率。3D辅助的手术规划下,超声引导进行经皮MWA及经皮胆道穿刺引流灌注治疗(直径>3 cm)的肝门部HCC是安全、有效的技术且可改善预后[30]。CEUS可实时观察、可重复检查。本研究3D+CEUS组完全消融率为96.9%,与超声造影引导HCC,完全消融的准确率可达到91.5%~98.8%相当[33]。
3.3 WMA术后CT-3D融合技术评估安全消融边界的价值
肿瘤局部进展是指发生于消融治疗区域内部或边缘部位的肿瘤复发[34],己知的危险因素包括肿瘤大小、邻近大血管、病理分化程度、消融边界等[35]。因此,准确判断消融是否达到安全边界,对于评估消融疗效、降低术后局部复发,提高肿瘤患者存活率至关重要。
临床上常采用B超、CEUS、增强CT或MRI等技术评价HCC消融治疗的疗效。常规B超在HCC消融治疗有时较难探清边界,在疗效评价上存在局限性。CEUS通过实时观察肿瘤血流分布、病变微循环等,能提供更多有价值的信息[36]。CEUS可准确确定消融的真实范围、清楚显示消融边界,可准确判断肝脏肿瘤是否完全消融,但也有CEUS自身的局限性,一次CEUS不能获得全肝各个时相图而至难以全面评价或可能出现漏诊。增强CT/MRI具有客观性较强、影响因素少等特点,但通常采用将治疗前后的CT/MRI横断面图像并排显示进行人工比对,非常依赖于经验性判断,一定程度上可能较难准确定量的评估是否获得“安全边界”。而WMA术后疗效准确评估的关键就是肿瘤边界与消融区边界空间位置关系的定量判断,因此需要一种更客观定量分析来进行疗效的准确评估[37]。3D技术平台评估肿瘤消融后疗效的正确率明显高于常规二维方法[31]。Tang等[13]对75例HCC采用基于CT-3D重建图像融合定量评估消融术后消融边界,较二维更为精准,更客观、准确。本研究3D+CEUS组的完全消融率为96.9%,2D组达到完全消融率79.1%,3D+CEUS组完全消融率优于2D组患者。完全消融率高的3D+CEUS组具有更高的无瘤生存时间,说明消融达到安全边界的无瘤生存时间更长。Teng等[38]研究显示HCC消融中安全边界<5 mm时局部复发率较高,消融安全边界每增加5 mm,局部复发率的风险降低46%。消融边界与肿瘤局部进展有密切相关,即不足的消融边界可能导致较高的肿瘤局部进展[10]。因此,消融边界是消融术后预测肿瘤局部进展重要的指标[39]。Jiao等[40]一项研究显示HCC结节直径<3 cm、3.1~5 cm、5.1~8 cm的完全消融率分别为96.4%、92.3%和78.6%,直径<3 cm与3~5 cm间的消融率基本相近,而直径>5 cm的消融率则明显下降。因此,不同大小肿瘤的疗效是有差异的,肿瘤体积越大,对患者的局部疗效、预后生存越不利。多种因素影响着肿瘤复发[35],其中肿瘤最大径为局部复发的独立危险因素,即肿瘤越大,侵犯重要周围器官的风险越高,在常规超声上通常难以发现微卫星灶或微血管侵犯,而导致局部复发率较高[41]。WMA治疗后复发间隔时间越短的患者预后越差,表现为肿瘤局部进展快,总体生存率更低,因而肿瘤局部进展也是影响WMA患者长期生存的危险因素。
不同HCC的局部热消融治疗方法存在各自的优势和缺陷,适应证有重叠,治疗手段的实施涉及多个学科协作完成。近年来,HCC的非手术治疗取得显著进展。药物治疗,特别是抗血管生成药物联合免疫治疗用于晚期或不可切除HCC的治疗可获得30%左右的客观缓解率,病人中位生存期也提高到20个月左右[42-43],由于HCC生物学行为异质性高,不同个体肝脏疾病背景以及预后影响因素均存在较大差异。HCC术后复发的影响因素众多,因此应当充分利用并整合优化资源,通过多学科团队为HCC病人提供个体化的正确决策[44],以期待获得更好的疗效和生存时间。
4 结论
对于合适大小(>3 cm,<6 cm)的复发性HCC患者,术前采用3D规划,术中使用3D技术联合CEUS引导多针天线微波消融治疗复发性HCC,术后采用CT-3D图像融合定量分析消融安全边界客观、准确,可获得更高的完全消融边界和无瘤生存时间,具有一定的应用前景。
