经腹腔镜诊断的肉瘤样腹膜恶性间皮瘤1例
2021-02-25苟国娥黄晓俊
苟国娥,黄晓俊
腹膜间皮瘤(malignant peritoneal mesothelioma,MPM)是一种很罕见且恶性程度极高肿瘤,发病率约为0.41~1.9/100万,肉瘤型仅占10%~15%[1]。该病临床表现无特异性,常易误诊为结核性腹膜炎及其他腹腔转移瘤,而MPM的早期诊断与治疗方式的选择、预后密切相关[2],本文章分享1例经腹腔镜明确诊断的肉瘤样MPM及相关的文献进行总结,以提高临床医生对该病诊断的认识。
1 病例报告
患者范某,男性,46岁,农民,因“间断腹胀1月,加重1周”于2020年12月8日入院,伴发热、盗汗,最高体温38.3摄氏度,同时伴有乏力、体重下降约6 kg,无寒战、腹痛、黄疸、胸痛、气短等不适。否认石棉接触史及恶性肿瘤家族史。查体:腹膨隆,腹壁韧,全腹无压痛及反跳痛,未触及肿块,液波震颤阳性。
辅助检查:腹部增强CT未确见实体瘤,腹膜弥漫增厚未见明显强化,腹腔广泛粘连慢性腹膜炎征,中—大量腹水。胃镜及结肠镜检查未见异常,肿瘤标志物除CA-125为48.39 U/mL外,余均正常(癌胚抗原1.1μg/L,CA19-9 2.59 U/mL)。腹水常规:李瓦特试验+,白细胞总数1 684.00×106/L,单核多于多核。胸水生化:腺苷脱氨酶193 U/L,总蛋白38.6 g/L,ADA 13 U/L,乳酸脱氢酶616 U/L,腹水CA125 527.3 U/mL,多次送检腹水脱落细胞检查仅一次见异形细胞,留置腹腔引流管但因腹水粘稠堵塞管腔引流不畅。
治疗经过:入院后患者病史、体征及腹部CT、感染指标WBC 15.31×109/L、CRP120.17 mg/L、PCT 0.135 ng/L、血沉77 mm/h考虑结核性腹膜炎不排外,给予了四联诊断性抗结核治疗,一周后症状持续不缓解,腹围进行性增大,考虑腹腔罕见肿瘤不排外遂请普外科行腹腔镜下腹膜活检术。术中见腹腔内广泛粘连,腹壁及大网膜、肠系膜可见多处结节样增生,选5处取活检,同时引出黄绿胶冻样腹水约1 800 mL。术后病理示(图1):细胞圆形或多角形,胞浆丰富,嗜酸性,核浆比增大,异形深染,瘤巨细胞及多核瘤巨细胞可见,坏死多,细胞表达CKp(+),Vimentin(+),Desmin(+),CK8/18(+),CK7(+),CK20(-),WT-1(++),D2-40(-),EMA(-),CEA(-),CD138(+)、TTF-1(-),Calretinin(-),PAX8(-)和claudin 4(-),诊断为肉瘤样恶性间皮瘤。患者肉瘤样MPM无外科手术指针且经评估后无法耐受全身化疗,诊断1月后去世。
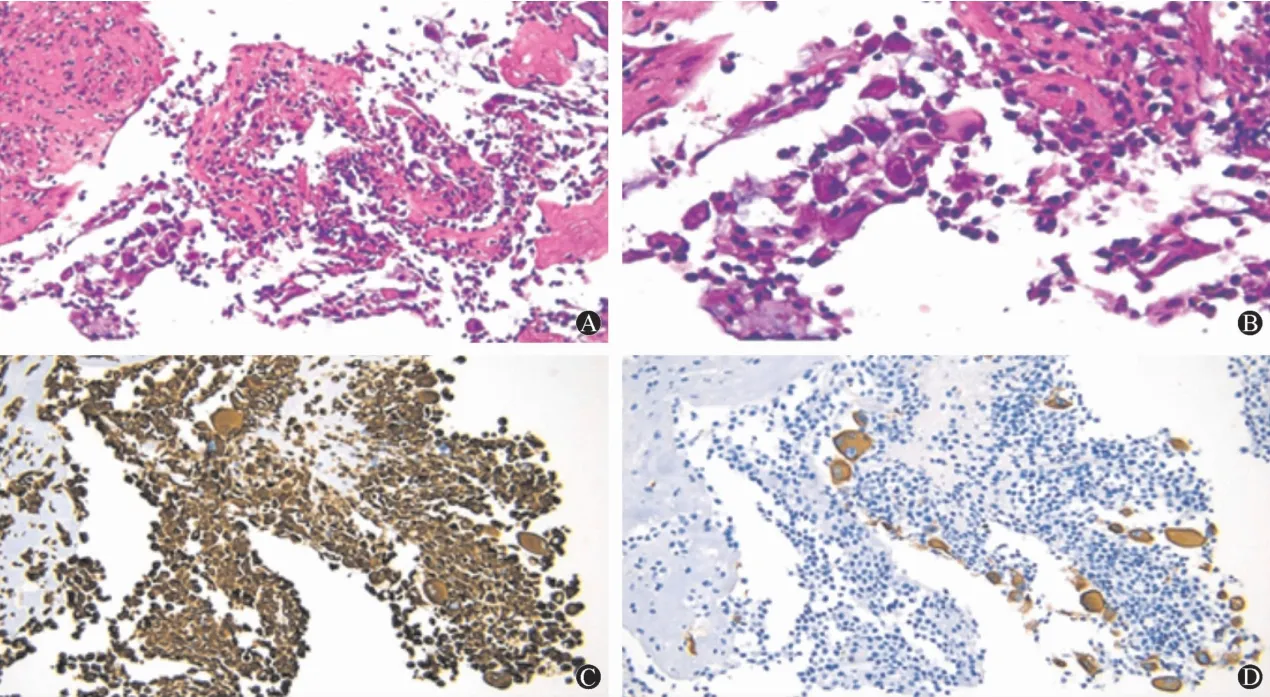
图1 活检组织常规病理及免疫组化 A:常规病理染色(HE×200);B:病理染色(HE×400);C:Vimentin+(SP×400);D:CKp+(SP×400)
2 讨论
恶性间皮瘤(Malignant mesothelioma,MM)是种罕见但恶性程度极高的肿瘤,通常起源于胸膜、腹膜、心包腔及阴道间皮细胞,MPM占所有MM的7%~20%[1]。石棉暴露与MM之间存在公认的因果关系,考虑与石棉引起的慢性炎症相关,潜伏期40~70年不等[3],随着工业化过程中石棉暴露的增多,2000-2013年中国MM的发病率逐年升高,年增长率为2.5%[4]。其中8%的MPM与石棉暴露有关,另外BRCA相关蛋白1(BAP1)的突变或缺失导致的遗传易感性增加、放射性物质、猿病毒40、有机化学物等也可致病,本例患者否认任何形式的石棉接触史。
因为疾病早期临床表现没有特异性,MPM通常在晚期诊断。该病临床表现通常取决于肿瘤在腹腔内扩散的程度,最常见的症状/体征是腹水(77%)、腹痛(69%)、乏力(43%)、体重减轻(32%)、食欲不振(30%)和腹部肿块(30%),不太常见的主诉包括新发的疝气、肠梗阻、穿孔及不明原因的发烧和盗汗[5]。腹部CT和腹部超声的征象主要是1)中-大量腹水,2)腹部肿块,3)腹膜增厚、间皮细胞组成的肠壁浆膜层通常弥漫受累,伴有大网膜和肠系膜弥漫不规则增厚或结节、甚至呈现网膜饼的形状及肠管走型紊乱模糊[6]。不过这些临床表现及超声、CT的征象容易和结核性腹膜炎、腹膜转移癌等疾病混淆,易出现漏诊,虽然超声及CT不能作为诊断MPM的金标准,早期筛查仍具有一定地优势[7]。MRI和PET-CT一般不作为常规检查,但可以判断早期占位病变良恶性、是否有转移并与淋巴瘤鉴别。
腹水中检测脱落细胞学最可能提供有用的信息,然而,腹水中通常只有极少数的恶性细胞,癌细胞阳性检出率不足51%,肉瘤样成分极少进入腹腔积液,因此肉瘤样类型脱落细胞的检测阳性率更低[5],本例患者腹水多次送检脱落细胞,仅一次检出异形细胞。因此,MPM在临床上最终诊断是依靠病理及免疫组化,在组织学形态分为上皮型(70%)、肉瘤型(10%~15%)和双相型(15%~20%)三类,上皮型是最常见的也是三种组织分型中预后最好的[8]。免疫组化标记在MPM组织学诊断中起着至关重要作用,MPM目前没有明确的特异性标记物,在实际工作中常采用Calretinin、CKp,Vimentin、WT-1、D2-40、细胞角蛋白5/6和EMA阳性染色中的一项或一组联合诊断,而癌标记物如CEA、BerEP4、MOC31、ER、PAX8和claudin 4呈阴性染色[9]。
因此适量的组织学标本对于病理及免疫组化诊断非常重要,腹腔镜、剖腹探查、CT或超声引导下的穿刺活检成为目前获取标本的主要手段[2]。更推荐腹腔镜作为首选,原因如下:①与一般的外科剖腹探查术相比腹腔镜因其侵袭性小更易被患者及家属接受;②同时腹腔镜下活检提供的标本比CT或超声引导下的核心针活检或切口/切除活检更充足,尤其是超声容易受肠腔气体干扰,对肠系膜病变及较深部位的淋巴结显示不清,且活检成功率与操作医师的经验密切相关,对比之下腹腔镜可视条件下活检更安全、成功率更高;③与CT或超声引导下穿刺活检相比,腹腔镜下可以观察整个腹腔确定病变的侵及范围,计算腹膜癌指数(peritoneal cancer index,PCI)评价腹腔内肿瘤负荷帮助制定下一步治疗计划;④也可以根据活检术中病理及探查情况直接行以腹膜切除技术为核心的肿瘤细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC),该术式是国际腹膜表面肿瘤联盟目前推荐地对于一般状态良好(ECOG 0或1)、PCI和疾病分布有利于完全或接近完全(CC0或CC1)切除、上皮型MPM患者的首选治疗方式,通过腹膜联合脏器切除尽可能清除所有肉眼可见病变,该综合治疗模式可将部分MPM患者的中位生存时间提升至5年以上[1]。
MPM因发病隐匿、发病率低、临床表现无明显特异性,临床对其认识不足误诊率较高。因此,遇到原因不明的腹胀、腹痛、难治腹水且有腹壁弥漫性病变证据的个体都应该考虑排除MPM,建议首选腹腔镜取得活检组织组结合病理及免疫组织化学染色进一步明确诊断。
