3-甲基腺嘌呤腹腔注射干预大鼠胃窦组织自噬最佳药物剂量与用药时间探讨
2021-02-24肖小娟赵莎彤陈丝怡
肖小娟,魏 星,赵莎彤,陈 巧,陈丝怡,彭 艳
(湖南中医药大学,湖南 长沙 410208)
细胞自噬是进化上高度保守的降解细胞内异常蛋白和受损细胞器以实现细胞稳态和自我更新的过程,自噬也是真核细胞维持稳态、实现更新的一种重要进化机制[1-2]。细胞自噬是当前的研究热点,它与肿瘤[3]、心脏疾病[4]、肝脏疾病[5]、糖尿病[6]等多种常见疾病的发生、发展有关。3-甲基腺嘌呤(3-Methyladenine,3-MA)是常用的自噬抑制剂,经查阅相关文献[7-11]后发现3-MA多用于体外细胞实验,较少用于在体动物实验,然而有些研究其处理因素必须作用于实验动物而非细胞,这种情况下需要用3-MA进行在体动物实验,但不同实验所使用的药物剂量各有不同[12-15]。本研究选用了三组常用剂量10、15、30 mg/kg的3-MA给雄性SD大鼠腹腔注射进行预实验以探索3-MA作用于大鼠影响其自噬的最佳药物剂量。另外不同的处理因素干预时长也有所不同,有些干预时间较长,在10 d以上[16],所以本研究选择15 d作为干预时间,观察3个不同剂量的作用效果,并选用3个剂量中的最大剂量30 mg/kg干预1、3、15 d以摸索3-MA用于大鼠对自噬抑制的维持时间有多长,为后期进行自噬相关研究提供依据。
1 材料与方法
1.1 实验动物与分组 21只健康雄性SD大鼠,SPF 级,体重为180~220 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002,动物购买后均饲养于湖南中医药大学动物实验中心SPF级实验动物房,室温 19~26 ℃,相对湿度 40%~70%,昼夜循环,保持12 h光照。将大鼠编号1~21,适应性喂养7 d后采用随机数字表法进行实验分组。将21只健康雄性 SD大鼠随机分为以下七组:A组3-MA 10 mg/kg组、B组3-MA 15 mg/kg组、C组3-MA 30 mg/kg组、D组PBS组、E组空白对照组、F组3-MA 30 mg/kg 3 d组、G组3-MA 30 mg/kg 1 d组,每组3只。
1.2 主要试剂与仪器 3-MA(货号M129496,阿拉丁)、雷帕霉素(Rapamycin,RAPA,货号R817296,麦克林)、PBS缓冲液(货号PB180327,普诺赛)、二甲基亚砜(DMSO,货号D806645,麦克林)、兔多抗GAPDH(37 kD,货号AB-P-R 001,杭州贤至生物有限公司)、兔多抗LC3B(19 kD,货号ab48394,Abcam)、兔多抗P62(62 kD,货号E-AB-62289)、HRP标记羊抗兔二抗(货号BA1054,武汉博士德生物工程有限公司)、电泳仪电源(型号DYY-7C,北京六一仪器厂)、垂直电泳槽(型号DYCZ-24DN,北京六一仪器厂)、电转仪(型号DYCZ-40,北京六一仪器厂)、水平摇床(型号TS-1,江苏海门其林贝尔仪器制造有限公司)、pH计(型号LP115,德国Metter-Toledo GmbH公司)、电子天平(型号CPA,北京赛多利斯仪器系统有限公司)、磁力搅拌器(型号T8-1,江苏省金坛市中大仪器厂)、酶标仪(型号mμlISKANMK3,Thermo) 、离心机(型号HI650,湖南湘仪实验室仪器开发有限公司)。
1.3 配药及干预方法 先称量大鼠体重,按不同组别计算出所需3-MA药物总剂量,然后将3-MA用PBS溶液配成浓度为10 mg/ml的药液,现配现用。大鼠适应性喂养7 d后进行干预,干预期间每天称量大鼠体重,根据大鼠体重A、B、C组分别按10、15、30 mg/kg剂量腹腔注射3-MA;D组注射等剂量PBS溶液,左右腹腔交替注射,干预3个疗程,每个疗程5 d,疗程期间休息2 d,共计19 d;E组不做任何处理为空白对照组;G组按30 mg/kg剂量腹腔注射3-MA,在适应性喂养结束后的第1个疗程的第1天注射1次,然后其它疗程不做任何处理,仅喂养至干预结束,共19 d。F组按30 mg/kg剂量腹腔注射3-MA,分别在每个疗程的第1天注射1次,共3次,其余时间不做任何处理至干预结束,共19 d,第20天取材。
1.4 观察指标 P62和LC3蛋白表达:将大鼠麻醉处死后,迅速剪取胃窦组织一块,置于冻存管中,保存在-80 ℃冰箱待检测。用Western blot方法检测胃窦组织中LC3和P62的相对表达量。

2 结 果
2.1 相同时间不同剂量3-MA干预后胃窦组织P62和LC3的相对表达 ①P62相对表达量:A、D、E三组两两对比均无统计学差异(均P>0.05);与D、E组相比,B、C组P62表达增加(均P<0.05);C组P62表达高于B组(P<0.05)、A组(P<0.01)。②LC3Ⅱ与LC3Ⅰ的比值:D、E组相比无统计学差异(P>0.05);A组(P<0.05)、B组(P<0.05)、C组(P<0.01)的LC3Ⅱ/LC3Ⅰ值均低于D、E组;C组的LC3Ⅱ/LC3Ⅰ值低于B组(P<0.05)、A组(P<0.01);B组LC3Ⅱ/LC3Ⅰ值低于A组(P<0.05)。见表1(图1)。
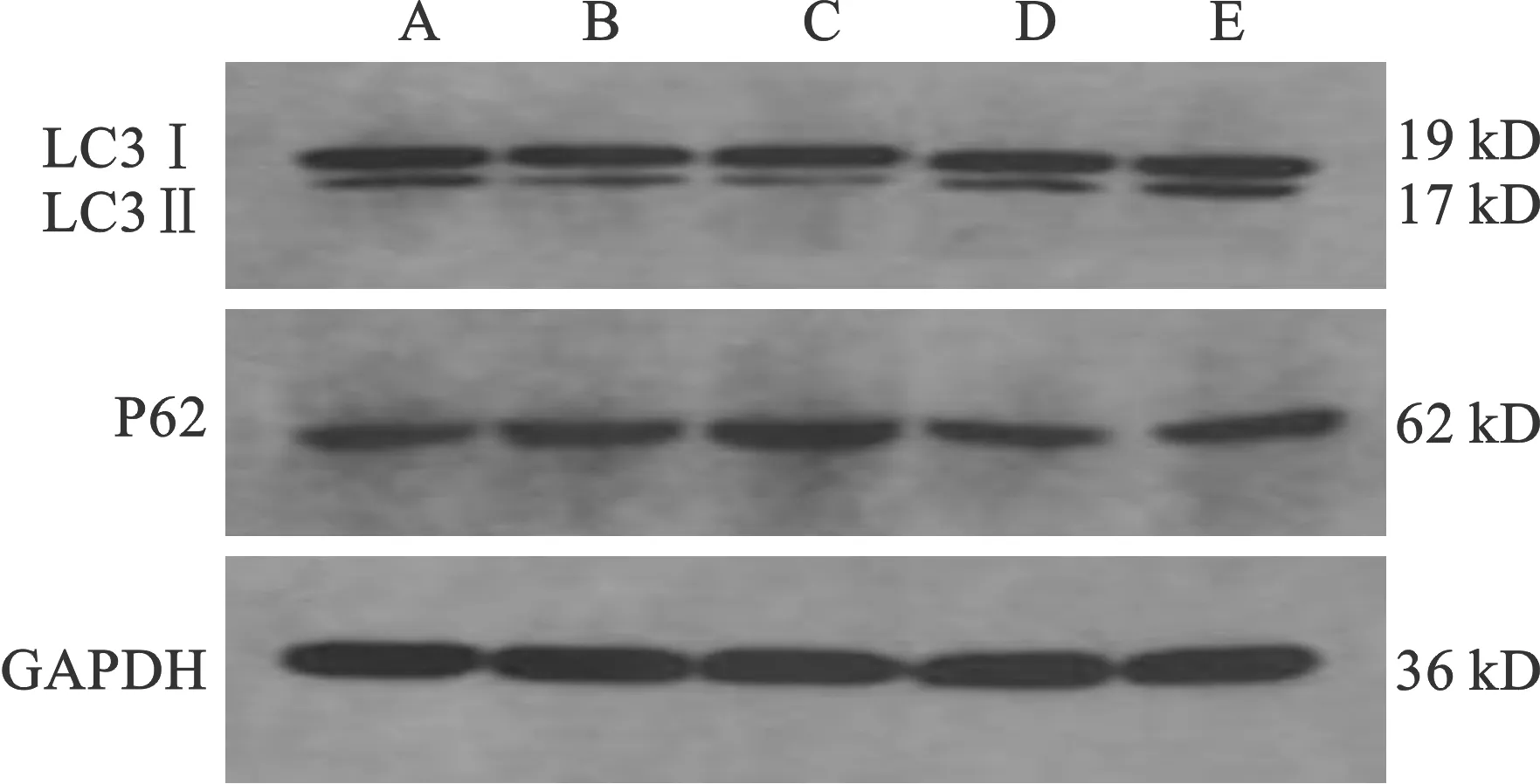
图1 各组大鼠LC3、P62蛋白表达电泳图
表1 各组大鼠P62蛋白及LC3Ⅱ/LC3Ⅰ比值
2.2 相同剂量3-MA干预不同时间后胃窦组织P62和LC3的相对表达 ①P62相对表达量:各组比较差异均有统计学意义(均P<0.01);C组的P62表达明显高于F组、G组(均P<0.01),G组的P62表达明显高于F组(P<0.01)。②LC3Ⅱ与LC3Ⅰ的比值:各组比较差异均有统计学意义(均P<0.01);G组LC3Ⅱ/LC3Ⅰ值高于F组、C组(均P<0.01);C组LC3Ⅱ/LC3Ⅰ值高于F组(P<0.05)。见表2(图2)。

表2 各组大鼠P62蛋白及LC3Ⅱ/LC3Ⅰ比值
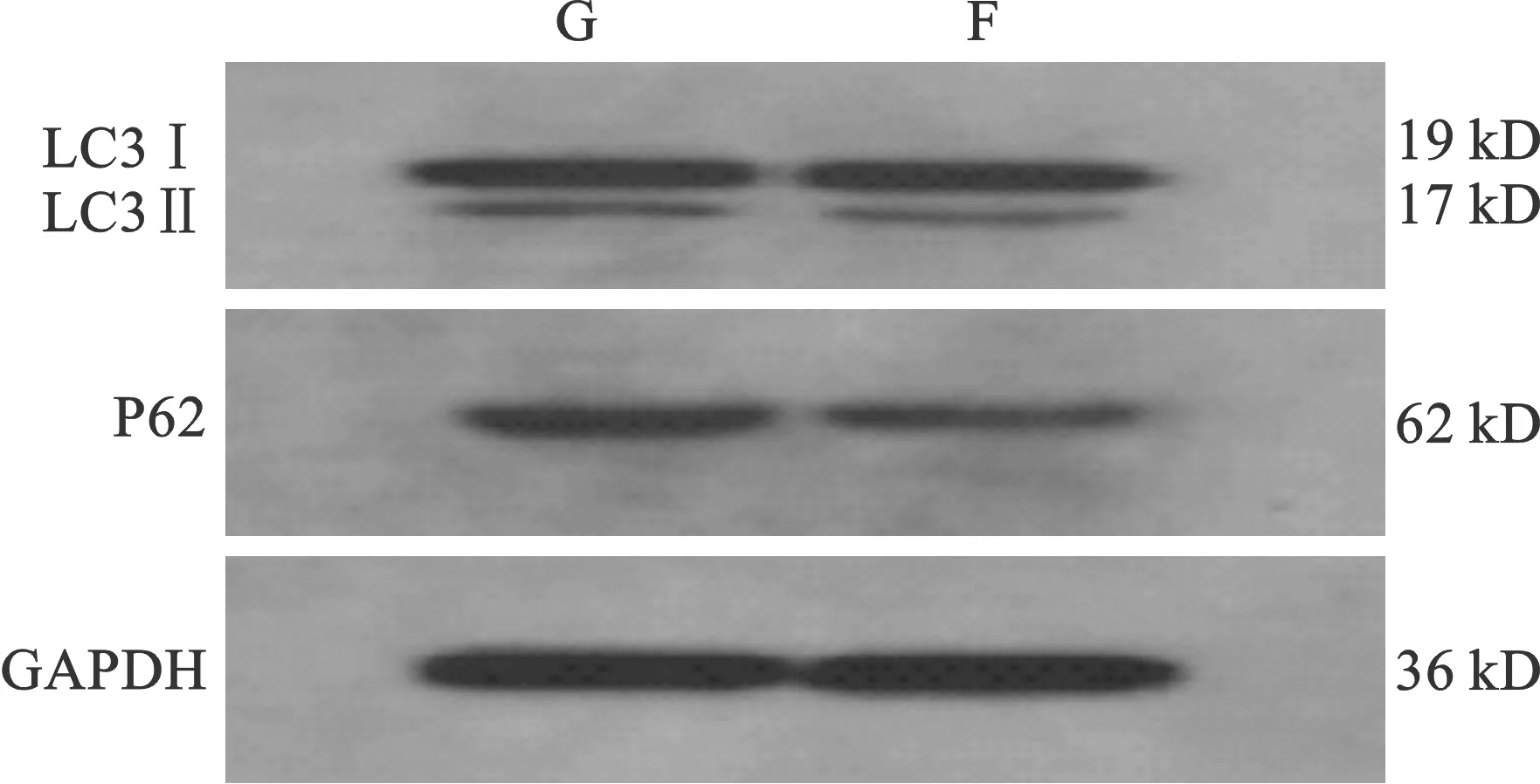
图2 各组大鼠LC3、P62蛋白表达电泳图
3 讨 论
细胞自噬可能被饥饿、生长因子缺乏、高生物能量需求、氧化应激、感染、蛋白质聚集物积累、营养状况、温度、氧气浓度、细胞密度等多种因素诱导发生,其过程大致分为三步[17],最初的步骤包括隔离膜的形成(囊泡成核)和扩张(囊泡伸长),这也被称为吞噬体。吞噬体膜的脂质来源尚不清楚,内质网、质膜和线粒体都有可能是其来源[18]。然后,吞噬体的边缘融合(囊泡完成)形成自噬小体,这是一个隔离细胞质物质的双层膜结构。随后自噬小体与溶酶体融合,形成自噬溶酶体,其中的内容被降解成更小的物质成分,这一过程为细胞提供了自我更新所需的营养和材料。LC3Ⅰ 位于细胞质,LC3Ⅱ 则位于自噬小体膜上,自噬过程中,LC3Ⅰ 经泛素样加工修饰后,与自噬膜表面的磷脂酰乙醇胺结合,形成LC3Ⅱ并聚集在自噬体膜上。随着自噬小体的形成,细胞质中处于游离状态的LC3Ⅰ逐渐转化为LC3Ⅱ,从而LC3Ⅱ在自噬体膜的表达会逐渐增加[19-20],所以LC3Ⅱ含量的多少与自噬泡数量的多少成正比,而LC3Ⅱ与LC3Ⅰ 的比值大小通常被用于评估自噬激活的程度,是判断自噬水平高低的依据[21-22]。P62也称为SQSTM,可通过UBA和LIR结构域分别结合泛素化底物及自噬小体,将待降解底物转运至自噬溶酶体系统。在自噬过程中,P62发挥着重要作用,它不仅作为泛素化蛋白的接头蛋白,也作为底物溶酶体降解。因此,在生理条件下基础水平的自噬可以维持P62处于一个较低的浓度水平[23]。如果自噬小体和溶酶体发生融合功能障碍,自噬被抑制,溶酶体不能顺利降解P62,P62就会积聚,P62的数量会增加[24-25]。3-MA是磷脂酰肌醇3-激酶(PI3K)的抑制剂,PI3K是一种能磷酸化磷脂酰肌醇的脂激酶,在众多控制mTOR激活的信号通路中,它是胰岛素等生长因子应答的关键元素。在哺乳动物细胞中,有三类PI3K:Ⅰ类PI3K、Ⅱ类PI3K、Ⅲ类PI3K。3-MA不仅抑制Ⅰ类PI3K,也抑制Ⅲ类PI3K,作为PI3K抑制剂,3-MA可以间接阻断其下游AKT的激活[26],也可以通过抑制由Beclin1和Vps34组成的复合物即Ⅲ类PI3K而抑制双膜泡的形成,并阻止这些自噬体吞噬细胞成分,进而影响微管相关蛋白1轻链β(LC3b)定位于细胞膜,从而抑制自噬[10]。在本研究实验过程中,各组大鼠精神状态较好、活动自如、饮食正常,均未出现药物注射异常反应,可见大鼠对3-MA腹腔适应性较好。
本研究发现,在使用不同剂量3-MA腹腔注射干预相同时间后,其自噬抑制效果存在明显差异。结合LC3Ⅱ/LC3Ⅰ、P62的检测结果分析,在腹腔注射相同时间15 d情况下,随着3-MA剂量的增加,大鼠胃窦组织中P62的表达升高,而LC3Ⅱ/LC3Ⅰ的值下降,且3-MA组与PBS组和空白对照组差异明显。说明10、15、30 mg/kg剂量的3-MA腹腔注射均有抑制大鼠胃窦组织细胞自噬的作用,其中 30 mg/kg剂量组自噬抑制效果优于10、15 mg/kg剂量组。另外,在腹腔注射相同剂量3-MA 30 mg/kg的前提下,干预不同时间1、3、15 d,其自噬效果也存在差异。结合LC3Ⅱ/LC3Ⅰ、P62的检测结果,其中干预15 d组的P62相对表达最高,LC3Ⅱ/LC3Ⅰ值低,且P62与LC3Ⅱ/LC3Ⅰ值相差较明显,说明用3-MA 30 mg/kg剂量干预15 d自噬抑制效果优于1 d组、3 d组。但本研究尚存在一定的局限,因为是预实验,所以样本数量较小,且本课题组在查阅相关文献后仅选取了3个剂量梯度及3个时间阶段,浓度及时间的选取无法做到全面。而且曾有体外细胞实验研究证明3-MA在自噬的调节中具有双重作用,虽然它能够抑制饥饿诱导的自噬,但它在营养丰富的培养基中的长期处理会诱导自噬[27]。所以在体内动物实验中是否存在比30 mg/kg剂量自噬抑制效果更好的更高剂量以及比干预15 d自噬抑制效果更好的干预持续时间,尚待进一步研究。
综上,用3-MA直接给大鼠进行腹腔注射可以抑制大鼠胃窦组织细胞自噬,3个剂量组中30 mg/kg为3-MA腹腔注射抑制大鼠胃窦组织细胞自噬的最佳药物剂量,腹腔注射干预15 d自噬抑制效果最强。
