辣椒溶杆菌NF87-2防治瓜类蔬菜蔓枯病的研究
2021-02-23张心宁乔俊卿李玥蓉刘永锋刘邮洲
左 杨,张心宁,乔俊卿,李玥蓉,刘永锋,刘邮洲*
(1. 江苏省农业科学院植物保护研究所,南京 210014;2. 江苏省睢宁县农业农村局,睢宁 221225;3. 南京工业大学生物与制药工程学院,南京 211816)
由亚隔孢壳属瓜类黑腐球壳菌Didymella bryoniae引起的蔓枯病是世界范围内的一种真菌土传病害,可危害多种葫芦科作物,如甜瓜、西瓜、黄瓜、哈密瓜等,严重影响瓜类蔬菜的产量和品质[1]。据报道,西甜瓜蔓枯病田间发病率一般为15%~25%,严重时高达60%~80%,减产可达30%以上[2]。病原菌以分生孢子器或子囊壳在宿主残骸中越冬,亦可存活在种子中,一般带菌率为 5%~30%,病菌在种子上可存活18个月以上[3]。蔓枯病在瓜类蔬菜的整个生育期都能危害,植株各部位均可受害,其中以叶片、茎蔓和果实受害为主,引起叶片、茎蔓枯死和果实腐烂。高湿及昼夜温差大有利于蔓枯病的发生,在田间温度20 ℃~25 ℃、相对湿度85%以上时,病原菌能够迅速侵染寄主组织并大量繁殖,可在短时间内导致大量藤蔓枯死,造成严重的经济损失[4]。
国内有关瓜类蔬菜蔓枯病的防治研究起步较晚,目前并无良好的高抗品种。生产上采取的防治方法主要是化学防治,长期、大量使用化学药剂不仅增加农产品有毒化学物质残留,影响农产品安全和人类健康,而且造成生态环境严重污染,病原菌易产生抗药性等[5]。生物防治对人畜安全、环境兼容性好、病菌不易产生抗药性,越来越受到人们的重视,并初见成效[6]。目前国内外对蔓枯病菌研究和应用较多的生防真菌主要是木霉菌[7,8],生防细菌主要有芽胞杆菌属Bacillus和假单胞菌属Pseudomonas等[9-12],利用辣椒溶杆菌Lysobacter capsici防治蔓枯病尚未见报道。此外,烟管菌Bjerkandera adustaM1对西瓜蔓枯病菌有较好的抑制作用,温室盆栽防效高达74.3%,在扫描电镜下观察到烟管菌M1能够直接穿透西瓜蔓枯病菌菌丝[6]。撕裂蜡孔菌Ceriporia lacerateHG2011的发酵液能防治黄瓜蔓枯病,降低发病率和病情指数,同时还可以提高土壤酶活性,促进黄瓜幼苗吸收养分、健康生长[13]。
本研究以蔓枯病菌DB-20为靶标菌,通过平板对峙、种子发芽、幼苗生长和温室盆栽防治试验,筛选出理想的拮抗细菌有效防治瓜类蔬菜蔓枯病,为开发防治瓜类蔬菜蔓枯病的生物杀菌剂提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株 拮抗细菌-辣椒溶杆菌Lysobacter capsiciNF87-2、枯草芽胞杆菌Bacillus subtilisPTS-394、绿针假单胞菌Pseudomonas chlororaphisYL-1、萎缩芽胞杆菌Bacillus atrophaeusYL3、贝莱斯芽胞杆菌Bacillus velezensisYL21和短小芽胞杆菌Bacillus pumilusZR3-2,病原真菌-蔓枯病菌Didymella bryoniaeDB-20均由本实验室保存并提供。
1.1.2 植物材料 西瓜品种:K3(感病品种,江苏省农业科学院蔬菜研究所提供),京欣一号和早佳8424(市售常见品种);黄瓜品种:研四黄瓜(市售常见品种)。
1.1.3 培养基及营养液 蔓枯病菌的培养基为马铃薯葡萄糖琼脂(potato dextrose agar , PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、水1000 mL;拮抗细菌的培养基为LB ( Luria-Bertani )培养基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、水1000 mL。
1.1.4 拮抗细菌发酵液和次生代谢产物的制备 挑取拮抗细菌的新鲜菌苔接种于100 mL LB液体培养基中,28 ℃、150 r/min摇培36 h,得到拮抗菌发酵液,用空白LB培养液调至菌含量109CFU/mL(下同),备用。采用酸沉淀法[14],将芽胞杆菌发酵液于4 ℃、10000 r/min离心15 min,上清液用6 mol/L HCl调pH至2.0,4 ℃沉淀12 h,10000 r/min离心20 min,弃上清液,收集沉淀,得到的沉淀加入2 mL甲醇(MeOH)后用1 mol/L NaOH调节pH至7.0,获得芽胞杆菌脂肽类化合物的粗提物,放−20 ℃保存备用。采用乙酸乙酯萃取法[15],将辣椒溶杆菌NF87-2发酵液于4 ℃、10000 r/min离心15 min,上清液用6 mol/L HCl调pH至3.0,以等体积乙酸乙酯进行萃取,上层萃取液以旋转蒸发仪蒸干浓缩,以2 mL甲醇-水溶液(MeOH-H2O,体积比2:1)溶解,获得辣椒溶杆菌NF87-2发酵液的代谢产物粗提物,放−20 ℃保存备用。
1.1.5 蔓枯病菌的培养和孢子悬液的配制 蔓枯病菌在PDA平板上28 ℃培养7 d 后,用灭菌的打孔器打孔直径5 mm的圆形菌块,随后用灭菌手术刀在新鲜黄瓜上去除同等大小面积的表皮后放置圆形菌块,室温放置5~7 d。待蔓枯病菌的分生孢子长出后,用灭菌毛刷蘸取少量无菌水,轻轻将表面孢子刮下,放至无菌水中。血球计数板检测孢子数目,配置成105孢子/mL的悬浮液。
1.2 拮抗细菌和代谢产物对蔓枯病菌菌丝生长的室内抑制试验
蔓枯病菌DB-20在PDA平板28 ℃培养 7 d 后,沿菌落边缘用直径 5 mm 打孔器打孔,将菌块置于PDA 平板中央。培养皿四周呈“十”字形(距培养皿中心 30 mm)滴加拮抗菌发酵液(平板水平线,菌含量109CFU/mL)和清水对照(平板竖直线)各 5 μL。每处理重复3皿。28 ℃恒温培养,待对照处理病原菌菌落长满平板时测量各处理菌落生长半径,计算抑制率,抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
将5 mm的蔓枯病菌菌块置于PDA 平板中央。培养皿四周呈“十”字形(距培养皿中心 30 mm)打孔,孔径为5 mm。孔内分别滴加清水对照 10 μL、溶剂对照(甲醇或甲醇水)10 μL、拮抗菌代谢产物 5和10 μL,共计4个处理,每处理重复3皿。28 ℃恒温培养4 d后,测量各处理病原菌菌落生长半径。
1.3 拮抗细菌和代谢产物对蔓枯病菌孢子萌发的抑制试验
试验共设7个处理:3株拮抗细菌NF87-2、PTS-394和YL21的发酵液、代谢产物和清水对照。在灭菌凹玻片中分别滴加40 μL的拮抗菌发酵液10倍稀释液(菌含量108CFU/mL)、代谢产物和清水(或甲醇),随后加入40 μL的蔓枯病菌DB-20孢子液,混匀。将凹玻片放置含有保湿滤纸的培养皿中,25 ℃恒温培养箱中培养6 h。当清水(或甲醇)对照处理的孢子萌发率达到90%以上时,调查各处理孢子萌发情况,计算孢子萌发抑制率,抑制率(%)=(对照孢子萌发数-拮抗细菌发酵液或代谢产物处理后孢子萌发数)/对照孢子萌发数×100,调查孢子总数设定为300个。每个处理重复3次。
1.4 拮抗细菌与蔓枯病菌同时接种处理对西瓜种子发芽的影响
采用培养皿中放置保湿滤纸进行发芽试验。选取3个西瓜品种,每个品种选取500粒饱满的种子,每个处理100粒,分别浸于无菌水(CK水)、DB-20孢子悬浮液+无菌水(体积比1:1)(CK病)和DB-20孢子悬浮液+拮抗菌发酵液10倍稀释液(体积比1:1,菌含量108CFU/mL)中,共计5个处理,24 h后取出,将种子分别摆放在直径为15 cm的培养皿上,28 ℃培养箱培养,3和7 d后分别调查种子发芽率。试验重复3次。值得注意的是,拮抗细菌发酵液的菌含量如果过高(>108CFU/mL)会影响西瓜种子正常的发芽和出苗,因此本研究中均采用拮抗细菌发酵液10倍稀释液(菌含量108CFU/mL)。发芽率(%)=(发芽种子粒数/供试种子总粒数)×100。
1.5 拮抗细菌与蔓枯病菌同时接种处理对西瓜出苗的影响
选取3个西瓜品种,每个品种选取出芽且芽长基本一致的500粒种子,每个处理100粒,分别浸于无菌水(CK水)、DB-20孢子悬浮液+无菌水(体积比1:1)(CK病)和DB-20孢子悬浮液+拮抗菌发酵液10倍稀释液(体积比1:1,菌含量108CFU/mL)中,共计5个处理,30 min后取出,播于育秧盘中,常规管理,7 d后调查出苗情况。试验重复3次。
1.6 拮抗细菌和代谢产物防治黄瓜蔓枯病的温室盆栽试验
将长至两片真叶的健康黄瓜幼苗移栽至装有200 g无菌土的花盆中(1棵/盆),缓苗15 d,共计240盆。试验设8个处理:40 mL无菌水(CK水),同时接种20 mL DB-20孢子悬浮液+20 mL无菌水(CK病),同时接种20 mL DB-20孢子悬浮液+20 mL拮抗菌发酵液(3株拮抗菌NF87-2、PTS-394和YL21,菌含量109CFU/mL),同时接种20 mL DB-20孢子悬浮液+20 mL拮抗菌代谢产物(3株拮抗菌NF87-2、PTS-394和YL21)。每个处理10株黄瓜幼苗,试验重复3次。各处理液用喷壶均匀喷施在黄瓜植株的茎和叶片上,7 d后再喷施拮抗菌发酵液或代谢产物一次。14 d后调查病情指数,计算防效。分级标准[6]:0级:植株健康,茎叶处无病斑,或发病叶小于1%;1级:茎叶有小块病斑。发病叶为1%~25%;2级:茎叶有大块病斑,发病叶为26%~50%;3级:茎叶有大量病斑,枯萎卷曲,发病叶为51%~75%;4级:植株有大量病斑,发病叶片为76%~90%;5级:发病叶片占到90%以上或全株病死。病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
1.7 数据统计与分析
采用Excel 2010和DPS 7.05软件进行统计分析,采用邓肯氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 拮抗细菌和代谢产物对蔓枯病菌菌素生长的室内抑制作用
试验结果表明(图1,表1),6株拮抗菌对蔓枯病菌菌丝生长均表现出一定的抑制作用,但不同细菌的抑制能力有所不同。辣椒溶杆菌NF87-2的抑菌效果最好,可以形成明显的抑菌带,抑制率为 81.6%;其次是贝莱斯芽胞杆菌YL21和枯草芽胞杆菌PTS-394,抑制率分别为56.5%和55.5%;其余3株拮抗细菌的抑制率为 38.4%~42.6%,6株拮抗菌对蔓枯病菌菌丝生长的抑制率由低到高是 ZR3-2<YL3<YL-1<PTS-394<YL21<NF87-2。选取效果良好的辣椒溶杆菌 NF87-2、枯草芽胞杆菌 PTS-394和贝莱斯芽胞杆菌YL21开展后续试验。
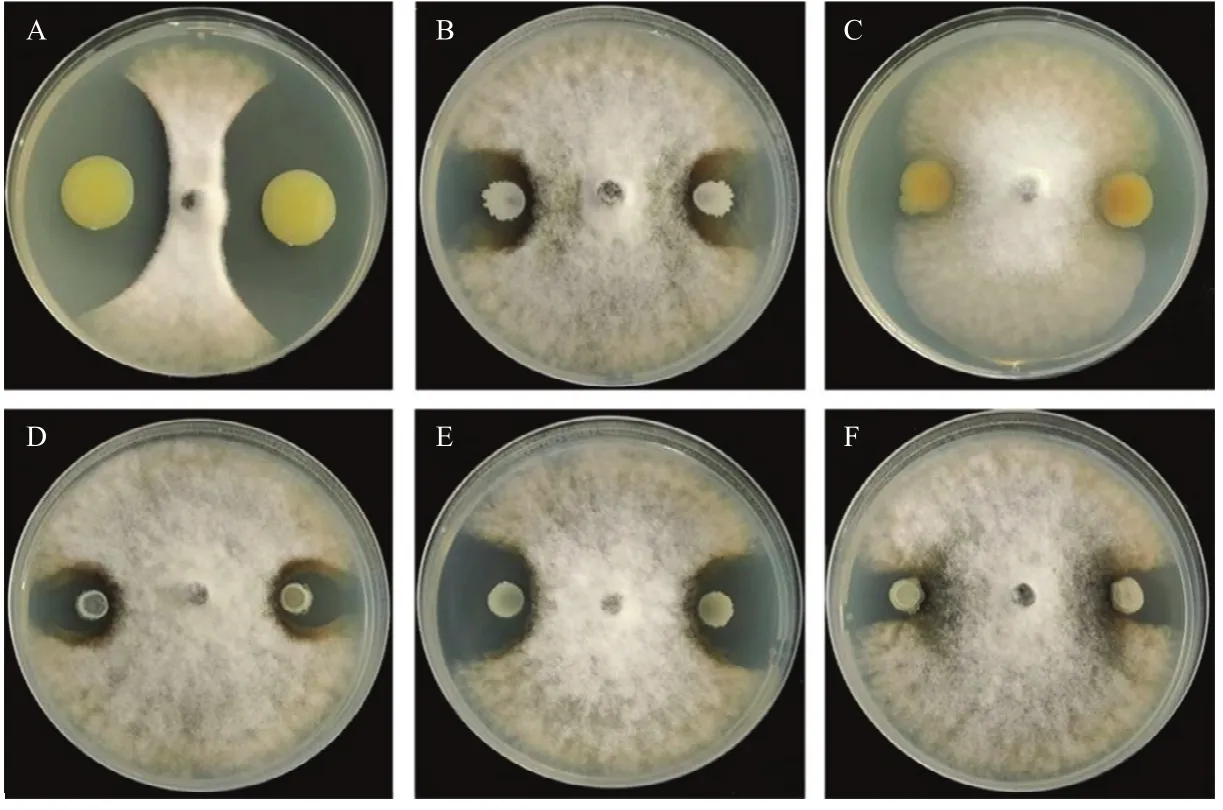
图1 拮抗细菌对蔓枯病菌菌丝生长的室内抑制作用Fig. 1 Inhibition efficacy of six antagonistic bacteria on D. bryoniae
拮抗细菌代谢产物对蔓枯病菌的平板对峙生长试验结果表明(图2,表1),辣椒溶杆菌NF87-2用乙酸乙酯提取的代谢产物、芽胞杆菌PTS-394和YL21酸沉淀提取的脂肽类粗提物对蔓枯病菌菌丝生长均具有抑制作用,清水对照和溶剂对照均无抑制作用。当对照处理的病原菌生长半径达30 mm时,拮抗菌代谢产物处理的病原菌生长半径为11.0~12.1 mm。各菌株代谢产物5 μL处理和10 μL处理的病原菌生长半径基本无差异。
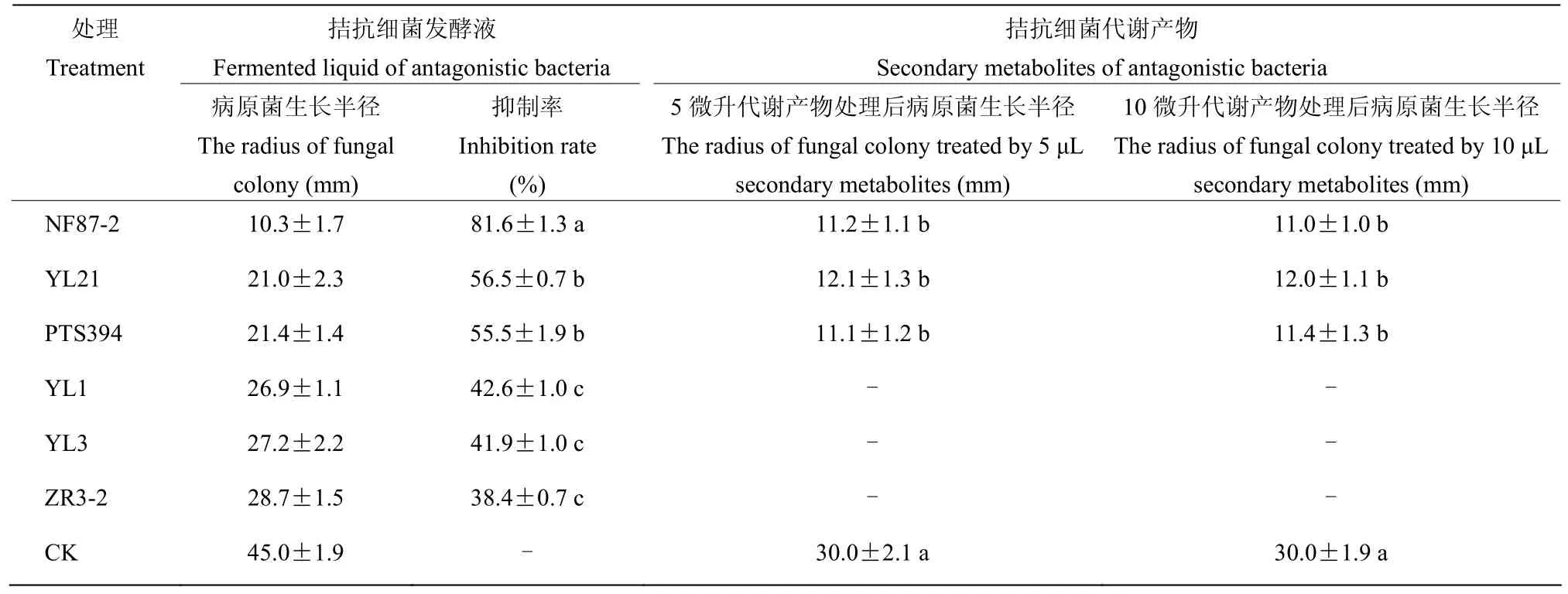
表1 拮抗细菌及代谢产物对蔓枯病菌菌丝生长的室内抑制作用Table 1 Inhibition efficacy of antagonistic strains and secondary metabolites against D. bryoniae in vitro
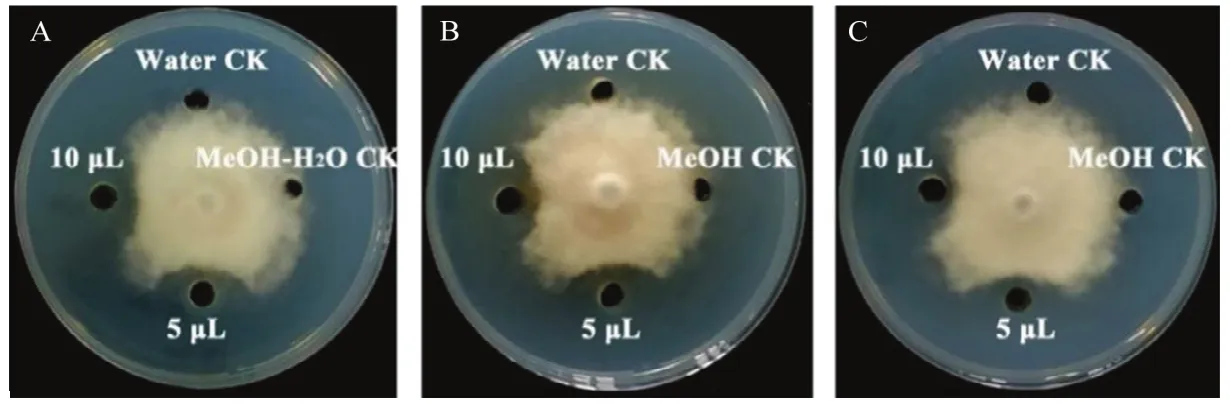
图2 3株拮抗细菌代谢产物对蔓枯病菌菌丝生长的室内抑制作用Fig. 2 Inhibition efficacy of secondary metabolites produced by three antagonistic bacteria on D. bryoniae
2.2 拮抗细菌和代谢产物对蔓枯病菌孢子萌发的抑制作用
清水对照处理6 h后,几乎所有的蔓枯病菌孢子均正常萌发,形成细长芽管,萌发率为95.3%。3株拮抗细菌发酵液10倍稀释液处理均对蔓枯病菌的孢子萌发表现出一定的抑制作用,其中辣椒溶杆菌NF87-2处理的抑制作用最强,蔓枯病菌孢子萌发率仅为38.7%,抑制率为59.4%;枯草芽胞杆菌PTS-394和贝莱斯芽胞杆菌YL21处理后,蔓枯病菌孢子萌发率分别为69.3%和71.7%,抑制率分别为27.3%和24.8%(表2)。
甲醇溶剂处理后,蔓枯病菌的孢子萌发率为 90.3%,略低于清水对照处理。3株拮抗细菌分泌的次生代谢产物对蔓枯病菌孢子萌发的抑制作用较强,与各自对应的发酵液相比,孢子萌发均呈下降趋势。辣椒溶杆菌NF87-2、枯草芽胞杆菌PTS-394和贝莱斯芽胞杆菌YL21代谢产物处理后,蔓枯病菌的孢子萌发抑制率分别为67.2%、37.3%和35.8%(表2)。
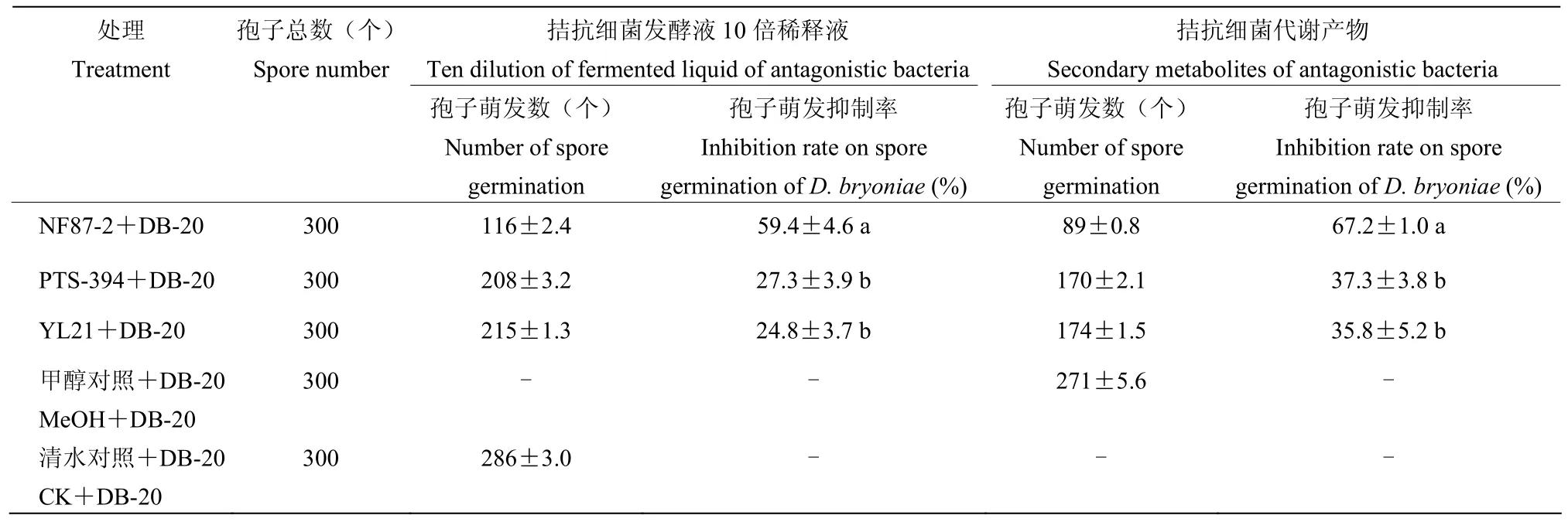
表2 3株拮抗细菌及其代谢产物对蔓枯病菌孢子萌发的抑制作用Table 2 Inhibition efficacy of three antagonistic bacteria and secondary metabolites on spore germination of D. bryoniae
2.3 拮抗细菌与蔓枯病菌同时接种处理对西瓜种子发芽的影响
3个西瓜品种清水对照处理无差异,3 d后发芽率为46%~49%,7 d后发芽率为78%~82%。蔓枯病菌孢子液处理西瓜种子后,发芽率明显下降,3和7 d后发芽率分别为15%~20%和31%~48%(表3)。
拮抗细菌与蔓枯病菌同时接种处理对种子发芽有明显的影响,其中辣椒溶杆菌NF87-2处理后7 d,感病品种K3、京欣一号和早佳8424的发芽率分别为69%、83%和75%,与病原菌DB-20处理组相比,发芽率提高了122.6%、72.9%和70.5%(表3)。
贝莱斯芽胞杆菌YL21和枯草芽胞杆菌PTS-394处理组的种子发芽率相当,处理后3 d感病品种K3、京欣一号和早佳8424的发芽率分别为23%~25%、36%~38%和30%~32%,处理后7 d感病品种K3、京欣一号和早佳8424的发芽率分别为49%、66%~69%和59%~61%,与病原菌处理组相比,发芽率提高了58.1%、37.5%~43.8%和34.1%~38.6%(表3)。
表3 3株拮抗细菌与蔓枯病菌同时接种处理对西瓜种子发芽的影响Table 3 Seed germination rate after inoculated with antagonistic strains and D.bryoniae
2.4 拮抗细菌与蔓枯病菌同时接种处理对西瓜出苗的影响
感病品种K3清水对照处理组的出苗率为83%,但接种蔓枯病菌DB-20孢子悬浮液后,发病非常严重,出苗率仅为6%,即使施用辣椒溶杆菌NF87-2、枯草芽胞杆菌PTS-394和贝莱斯芽胞杆菌YL21处理,出苗率仍然较低,分别为21%、11%和8%(图3)。
京欣一号品种试验中清水对照处理组的出苗率为89%,蔓枯病菌DB-20孢子悬浮液处理组的出苗率为38%,显著低于对照处理。辣椒溶杆菌NF87-2与蔓枯病菌同时接种处理组的出苗率为82%,与清水对照处理效果相当,枯草芽胞杆菌PTS-394与蔓枯病菌同时接种处理的出苗率和贝莱斯芽胞杆菌YL21处理组相当,分别为53%和51%,比病原菌处理组分别提高了39.5%和34.2%(图3)。
早佳8424品种清水对照处理组的出苗率为88%,蔓枯病菌DB-20孢子悬浮液处理组的出苗率下降为30%,3株拮抗细菌(辣椒溶杆菌NF87-2、枯草芽胞杆菌PTS-394和贝莱斯芽胞杆菌YL21)与蔓枯病菌接种处理后,西瓜幼苗的出苗率明显提高,分别为76%、48%和43%,比病原菌处理组分别提高了153.3%、60.0%和43.3%(图3)。
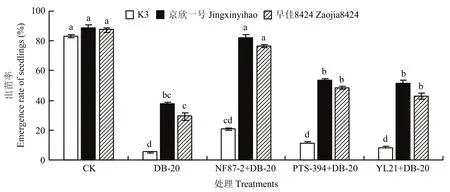
图3 拮抗细菌与蔓枯病菌同时接种处理对西瓜幼苗生长的影响Fig. 3 Seedling growth after inoculated with antagonistic strains and D. bryoniae at the same time
2.5 拮抗细菌和代谢产物对黄瓜蔓枯病的盆栽防治效果
3株拮抗细菌发酵液处理对黄瓜蔓枯病具有明显的防治效果,空白培养基对照处理的病情指数较低,第2次施药后14 d的病情指数为0.8,单独接种蔓枯病菌孢子液的黄瓜苗发病严重,第2次施药后14 d的病情指数为 39.3。辣椒溶杆菌 NF87-2发酵液处理后的防效最好,病情指数显著低于病原菌处理,防治效果为81.6%,贝莱斯芽胞杆菌YL21和枯草芽胞杆菌PTS-394发酵液处理的防治效果相当,分别为71.4%和67.4%;辣椒溶杆菌NF87-2、贝莱斯芽胞杆菌YL21和枯草芽胞杆菌PTS-394分泌的次生代谢产物对黄瓜蔓枯病也有一定的防治效果,但均比各自的发酵液防治效果低,分别是66.5%、57.2%和54.8%(表4、图4)。

图4 辣椒溶杆菌NF87-2、枯草芽胞杆菌PTS-394和贝莱斯芽胞杆菌YL21及其代谢产物对黄瓜蔓枯病的防治效果Fig. 4 Control effects of three antagonistic strains and their secondary metabolites on cucumber gummy stem blight in pot experiment

表4 3株拮抗细菌发酵液及其代谢产物对黄瓜蔓枯病的温室盆栽防效试验Table 4 Control effects of three antagonistic strains and their secondary metabolites on cucumber gummy stem blight in pot experiment
3 讨论
溶杆菌属是20世纪70年代末新建立的一个属,属于黄单胞科Xanthomonadaceae,γ-变形菌门Gramma proteobacteria。革兰氏阴性细菌,无芽胞,菌体杆状,无鞭毛。该属的细菌一般都能产生黄色至黄褐色色素,细菌基因组中G+C含量很高,一般为65%~70%[16]。这类细菌能产生胞外酶、抗生素及表面活性物质,对许多微生物包括真菌、细菌及线虫等都表现出拮抗活性[17]。目前研究应用较多的菌株包括产酶溶杆菌L. enzymogenes[18-20]、胶状溶杆菌L. gummosus[21]、抗生素溶杆菌L. antibioticus[22,23]和辣椒溶杆菌[24-27]。前期研究结果表明,辣椒溶杆菌 NF87-2可以很好地抑制多种病原真菌菌丝生长,并且对辣椒猝倒病有很好的田间防效[15]。本文室内外抑菌试验的结果表明,菌株NF87-2能有效防控瓜类蔬菜蔓枯病,是一株非常有应用前景的生防菌。
蔓枯病作为危害瓜类蔬菜的一种重要病害,当前研究大部分集中在病原菌鉴定、简单的抗病遗传规律、抗病材料筛选和防治方法等方面[4]。通过观察、试验、模拟、定性或定量分析,探明不同环境下寄主—病原菌相互作用而形成的时空动态规律,可有助于实现病害的准确预测和综合治理[28]。Punja等[11]研究发现,蔓枯病的药剂防治时间很重要。枯草芽胞杆菌QST713制剂能够有效防治黄瓜蔓枯病,如果先接种蔓枯病菌,24 h后喷施枯草芽胞杆菌发酵液,黄瓜蔓枯病发生严重,防效几乎为0;反之,如果先接种枯草芽胞杆菌发酵液,24 h后接种蔓枯病菌孢子液,则发病率明显下降。Santos等[28]研究发现,蔓枯病菌对湿度有很强的敏感性,建议生产上避开雨季种植西甜瓜,可以有效防治蔓枯病的发生。Rennberger等[29]研究了蔓枯病菌子囊孢子在空气中的传播动力学,发现西瓜植株接种蔓枯病菌后,292~313 d后在植株残余组织上仍然可以检测到子囊孢子;平板上的子囊孢子7 d后释放了90%,蔓枯病的发病率随着接种源地理位置距离的增加而下降。总之,蔓枯病菌的子囊孢子是该病害流行的主要工具,葫芦科作物的残余组织可以作为其长期存活的介体,因此在生产上应该及早、彻底地清除或烧毁残余组织,阻断蔓枯病菌的生存条件[29]。本文的研究结果表明,蔓枯病菌在植物生长的全生育期都应该注意防控,首先是种子处理,带菌种子的发芽率仅为48%,菌株NF87-2同时接种处理后种子发芽率提高为83%,与清水对照相当;其次在苗床阶段,接种蔓枯病菌后西瓜出苗率仅为38%,而用菌株NF87-2同时接种处理后可以明显减缓发病率,出苗率提高为82%;黄瓜幼苗移栽后,菌株NF87-2和蔓枯病菌同时接种处理,防效显著。上述的试验结果对于生产上开发利用辣椒溶杆菌NF87-2,确定其最佳防治时间、使用剂量和防治效果提供数据支撑。
前人研究结果表明,蔓枯病菌胁迫下,西甜瓜体内的防御酶-苯丙氨酸解氨酶 PAL、多酚氧化酶 PPO和过氧化物酶POD会发生明显变化,并且这种变化与西甜瓜品种的抗性直接相关[30]。除此之外,西甜瓜品种内源激素含量的变化及其相关基因的表达也与其对蔓枯病的抗病能力是相关的,比如抗蔓枯病甜瓜抗源PI420145叶片中低浓度的乙烯以及高浓度的茉莉酸和水杨酸提高了其对蔓枯病的抗病能力,叶片中EIN 2、PDF1.2、EDS 5和NPRI在接种早期的高表达促使其比感蔓枯病甜瓜“白皮脆”(对照)更早一步对蔓枯病菌的侵染作出反应[31]。任海英等[32]研究发现,对蔓枯病抗性不同的甜瓜品种感染蔓枯病后 APX的转录水平发生显著变化,与对照相比,有的抗性品种APX转录水平升高,但是有的抗性品种APX转录水平降低,推测APX在甜瓜与蔓枯病菌的互作过程中可能与其他多种信号网络交叉互作。Ruangwong等[8]发现木霉菌PSU-P1对西甜瓜蔓枯病有很好的防效,同时发现木霉菌处理后,寄主体内的POD、PPO、几丁质酶和β-1,3-葡聚糖酶均明显提高,这可能与防御反应直接相关。本文中菌株NF87-2分泌的次生代谢产物室内抑制蔓枯病菌孢子萌发的效果优于菌株发酵液,表明菌株NF87-2分泌的次生代谢产物是其发挥抑菌活性所必须的。但在盆栽试验中,菌株NF87-2发酵液对蔓枯病的防效比其次生代谢产物高,呈显著性差异,这其中是否也包含菌株NF87-2处理后,引起寄主植株体内防御酶系、激素的变化,从而激发了寄主的抗病性?后续将研究拮抗细菌代谢产物对西瓜种子发芽和出苗的影响,同时监测拮抗细菌或代谢产物与病原菌同时接种处理后西瓜种子、幼苗或植株体内各种防御酶系、激素的变化,为阐明拮抗细菌的作用机制提供理论依据。
