微生物注浆固化砂土若干因素的影响机制研究
2021-02-23徐晶穆柏竹赵子华
徐晶,穆柏竹,赵子华
(同济大学先进土木工程材料教育部重点实验室,上海 201804)
0 引言
软弱砂土作为工程界的困扰之一,不仅会严重削弱地基的完整性,也会影响岩土工程的稳定性,容易诱发上部结构的破坏,如边墙开裂、顶拱塌落等。因此,提高软弱砂土层的稳定性和力学特性,是减少工程危害的前提。传统固化方式,大多基于无机或有机灌浆材料,如石灰、水泥或树脂[1],但传统灌浆材料具有诸多弊端。例如,石灰或水泥在应用过程中会严重改变土壤的pH值,使土壤呈碱性,并对周围环境造成负面影响;树脂等高分子材料尽管固结效率高,但所包含的助剂具有一定毒性,同样存在环境问题。基于此,有必要开发新的砂土固化材料及配套固化工艺[2-5]。
自然界中的某些微生物通过在细胞内部或外部生成一些难溶化合物,可有选择性地填塞或黏结孔洞[6]。Boquet[7]研究发现,土壤环境中的细菌在合适条件下能够产生碳酸钙矿物,由此开启了微生物诱导碳酸钙沉积(Microbial Induced Carbonate Precipitation,MICP)的研究热潮。Lowenstan[8]总结了在土体颗粒间生成碳酸钙沉积物的方法,将其分为微生物控制和微生物诱导2类,并认为微生物诱导方式对环境的影响小,且方便应用。Van Wijngarden等[9]通过建立数学模型,对MICP注浆过程中的影响因素进行了详细分析。程晓辉等[10]研究了MICP在地基加固、力学性能提升方面的作用。崔明娟等[11]研究了注射方式对MICP固化过程的影响。徐晶等[12-13]研究了MICP在混凝土内部自修复领域的应用。总结已有文献可知,MICP技术的实施可依赖于一种可以高效产生脲酶的嗜碱性菌,该菌以尿素为氮源,通过自身的代谢活动产生脲酶,将尿素水解成NH4+和CO32-,CO32-可与细胞壁周围的钙离子发生沉积,并将细胞作为成核位点,形成碳酸钙晶体[14-15]。
总的来说,MICP固化技术基于自身环境友好等优点,具有广泛的应用价值和开发潜力,是仿生智能材料的重要组成部分[16]。但是,MICP固化是一个非常复杂的生物-化学过程,该过程涉及的诸多因素都可能影响到最终的固化效果。
本文通过对菌种生长参数、脲酶活性等进行分析,研究MICP固化砂柱的碳酸钙均匀性和砂粒胶结方式,采用无侧限抗压强度、显微组织观察、XRD、SEM,分别从宏观、微观角度对固化效果进行综合分析,以期为形成强度可控、胶结方式可控的砂土固化提供新思路。
1 实 验
1.1 菌的培养及筛选
1.1.1 菌种选择
本实验采用2种嗜碱性产脲酶菌,菌种A:ATCC 11859,购自中国普通微生物菌种保藏管理中心(CGMCC);菌种B:DSM 276,购自德国微生物菌种保藏中心(DSMZ)。使用前菌株均为冻干粉,贮藏于-80 ℃低温冰箱内。
1.1.2 培养基选择
为选取合适的培养基,本研究比较了细菌在不同培养基中的生长情况,不同培养基的成分及相应编号如表1所示。
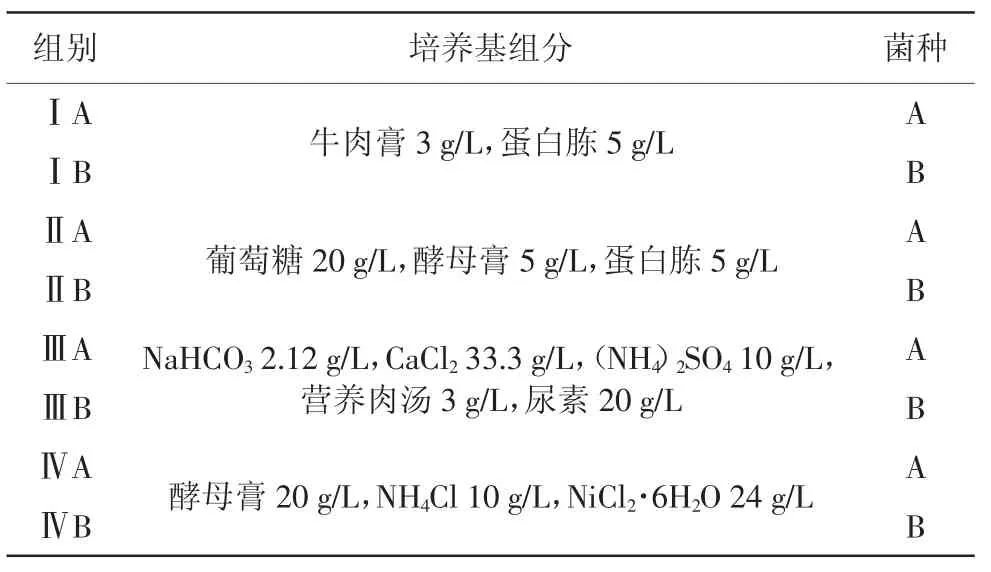
表1 培养基组分
将培养基分装于锥形瓶,置于高温灭菌锅内120 ℃灭菌20 min,而培养基中受热易分解的组分,如尿素,则单独采用0.2 μm微孔滤膜过滤除菌后再与高温灭菌组分混合。待冷却到室温后,将相应2种细菌依次接种至液体培养基中。再将液体培养基置于水浴振荡器内(27 ℃、120 r/min)振荡培养,采用分光光度计在600 nm波长下测试不同时期菌液的光密度(OD)值,描绘生长曲线。
1.1.3 菌种脲酶活性测试
按前述实验得到的最优菌种及培养基组合,重复灭菌、接种、培养操作。待细菌培养至生长曲线指数期与稳定期过渡阶段时进行离心收集(离心速度4000 r/min,离心时间10 min)。收集过程中采用无菌水作为收集菌种湿细胞的介质,确保菌液OD值为1.0,根据OD值-细菌个数拟合曲线推算,最终获得浓度为7.9×1010个/ml的浓缩菌液。
将每1 ml浓缩菌液分别加入到体积9 ml、浓度40 g/L的尿素溶液中充分搅拌均匀后,采用手持式电导率测定仪测试混合溶液的电导率,连续测试10 min。其中,标记为A、B的2组不通入空气直接测试电导率,标记为A+、B+的2组采用蠕动泵通入空气,同时测试电导率,以评价供氧水平对菌活性的影响。
1.2 砂土固化实验
首先采用液体培养基(成分:牛肉膏3 g,蛋白胨5 g,去离子水1000 ml)培养目标菌种18 h,使其达到生长稳定期。测量菌液OD值后,进行离心浓缩(离心速度4000 r/min,离心时间10 min)。随后将1 ml浓缩菌液(浓度7.9×1010个/ml)与50 ml尿素溶液(浓度40 g/L)均匀混合。最后将200 g ISO标准砂装入垫好纱布的PVC筒中(PVC筒内径约4.6 cm,砂柱高度4 cm)。
砂土固化装置如图1所示,首先用胶塞将PVC筒下端堵住以保证密封性。取上述菌液、尿素混合液50 ml缓慢加入到已装好ISO标准砂的PVC管中,搅拌均匀后静置2 h,再用蠕动泵以5 ml/min的速率将50 ml、浓度为0.5 mol/L的氯化钙溶液泵入。此时氯化钙作为固定液发挥作用,其中的钙离子可中和细菌表面负电荷,使得细菌更容易被固定在砂颗粒表面,而不在后续的灌浆过程中被冲出[17]。
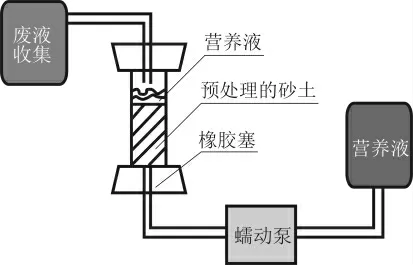
图1 砂土固化装置示意
静置10 min后,再采用蠕动泵泵送营养液(1000 ml去离子水、55.5 g无水氯化钙、3 g牛肉膏、5 g蛋白胨、40 g尿素)的方式进行注浆。每次注浆50 ml,速率为5 ml/min。间隔24 h注浆1次,注浆7 d后停止。注浆采取2种通气条件进行对比:一种为每次注入营养液结束后持续通气10 min,另一种为单纯注入营养液而不通气。具体注浆实验通气方案如表2所示。

表2 注浆实验通气方案
1.3 测试与表征
1.3.1 碳酸钙含量测试
将固化砂柱拆模,待砂柱上下端磨平后,控制样品砂柱高度为4 cm进行相应测试。分别取上(1 cm)、中(2 cm)、下(1 cm)3段砂柱,先置于烘箱内100 ℃烘干2 h,取出后记录干质量m1,再将砂柱泡入浓度为10%的稀盐酸中,24 h后测试溶液的pH值,保证pH值小于7,使碳酸钙充分反应,再次置于烘箱内重复烘干称重步骤,记录质量m2。碳酸钙含量按式(1)计算:
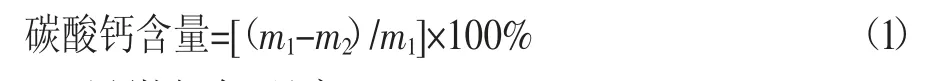
1.3.2 显微组织观察
随机取不同样品的中部砂块,采用冷镶嵌的方式制作金相试样,经打磨抛光后使固化的砂块裸露在试样表面,在金相显微镜下观察砂粒胶结方式、固化产物填充情况。
1.3.3 无侧限抗压强度
参照ASTM D2166无侧限抗压强度测试标准,采用4 cm高度的样品进行测试,加载参数为1 mm/min,直至试样破坏,得到样品的无侧限抗压强度。
1.3.4 SEM观测
把破坏后的试样置于100 ℃的烘箱内烘干2 h,随机选取砂柱中部断面平滑部位,采用FEI香港有限公司肖特基场发射扫描电子显微镜(Nova Nano SEM 450)进行SEM观测。
1.3.5 XRD分析
2 实验结果与分析
2.1 不同培养基及细菌组合的生长曲线
按上述实验方法配制培养基、接种细菌,并将其放在适宜环境中振荡培养,采集不同时期菌液OD值,绘制生长曲线如图2所示。
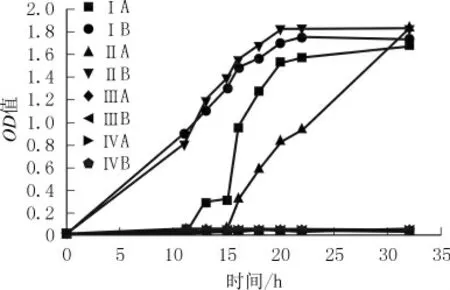
图2 不同培养基及菌种组合的生长曲线
由图2可知,Ⅲ号、Ⅳ号培养基中2种细菌生长缓慢,几乎不生长。对A菌种而言,其在Ⅰ号培养基中的延滞期较Ⅱ号培养基中短,能更快进入生长指数期。而B菌种能同时较好的适应Ⅰ号、Ⅱ号2种培养基,延滞期较短。综合考虑,选取Ⅰ号培养基(牛肉膏3 g/L,蛋白胨5 g/L)最佳。另外还可知,2种菌种的指数期末、稳定期初的时间均为18~20 h,这为后期脲酶活性测试培养时间的选择提供了依据。
2.2 脲酶活性测试结果
2种菌种多次的脲酶活性测试结果如图3所示。
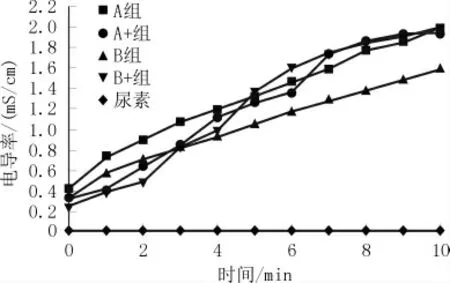
图3 不同菌种在不同供氧条件下的脲酶活性
由图3可见,对照组中无菌尿素的电导率始终为0,这是由于纯尿素溶液几乎不导电。而一旦加入具有脲酶活性的菌种之后,溶液的导电率迅速提高。这是由于细菌水解尿素产生铵根及氢氧根等带电离子。因此,可由电导率的高低判断细菌对应的脲酶活性。从通气水平的角度看,A、B两种菌种在测试前3 min内,不通气组分的脲酶活性均高于通气组分的脲酶活性,这是由于通气初期使得混合液体内部涌动,离子运动较为不稳定,而分析测试10 min内数据的整体趋势则能表明不同菌种在不同通气条件下的脲酶活性。从菌种的角度,对A菌种而言,是否通气对其自身脲酶活性整体影响并不明显。而对B菌种而言,不通气时其整体脲酶活性低于通气时脲酶活性,可见B菌种对供氧水平更为敏感。
2.3 砂土固化实验结果与分析
2.3.1 强度及均匀性分析
图4(a)为未经细菌固化处理,固化试验前标准砂形态,图4(b)为经A细菌固化处理后的标准砂试样。

图4 砂土固化对比照片
由图4可直观看出,经过微生物固化处理后,原本松散的砂粒固化成结实的砂柱,且具有一定的强度。各组别具体强度测试结果如表3所示。
STM32F103系列有2个高级定时器、4个通用定时器以及2个基本定时器和一个实时时钟(RTC)等。RTC计时准确,体积小耗电低,广泛应用于无人控制的自动化领域。103系列还包括2个看门狗计时器和一个SysTick计时器。看门狗采用32KHZ低速时钟工作,假如主时钟停止工作了,看门狗还可以继续工作,用途十分广泛。程序驱动较简单,实验室储备充足。
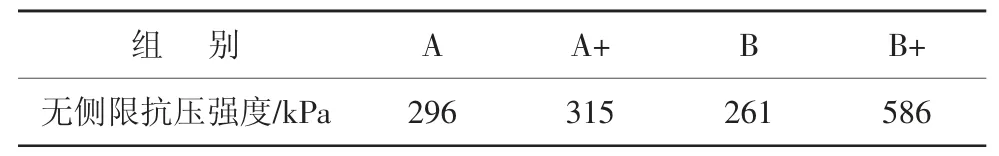
表3 各组砂柱的无侧限抗压强度
由表3可见,从菌种角度而言,A菌种在通气与不通气2种实验条件下,整体强度差异性较小;而B菌种在2种实验条件下,整体强度有较大差异。由此可知,A菌种对供氧水平这一因素较为不敏感,而B菌种则较为敏感。这一结论也与前述脲酶活性结论相互佐证。
图5为各组试样不同部位的碳酸钙含量分析结果。
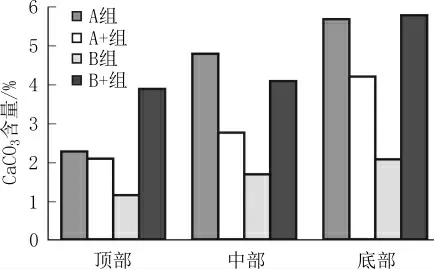
图5 各组试样不同部位的碳酸钙含量
由图5可见,各组砂柱试样底部的碳酸钙含量均最高,中部次之,顶部含量最低。同时,A、B+两组砂柱样品的碳酸钙含量明显较多。从菌种角度而言,经B菌种固化处理的砂柱,其顶部、中部、底部的碳酸钙含量差异较经A菌种固化处理的砂柱要小,故B菌种的均匀性较A菌种较好。从供氧条件而言,A+组相较于A组,B+组相较于B组,通气组分不同部位的碳酸钙含量差异均较未通气组分小,这是由于通气可使细菌更均匀地分布在砂柱的各个部位,进一步使得碳酸钙分布更为均匀,可见通气可以改变菌种的均匀性。
2.3.2 砂粒胶结方式分析
图6为砂粒间胶结情况的金相显微镜图像。

图6 砂粒间胶结情况的金相显微镜图像
由图6可见,A组分样品砂粒间的缝隙虽有部分被填充,但仍有部分间隙明显;A+组分样品砂粒间间隙明显,未有有效胶结存在;B组分样品砂粒间明显存在白色物质,将各个砂粒胶结;B+组分样品砂粒间隙被大量白色物质填充,几乎无缝隙存在。分析可知,微生物成矿产生的白色物质可以填充缝隙,并胶结砂粒。而砂粒胶结方式的不同也对强度有所贡献,在随机选取的4组样品中观察到的胶结现象也与强度有一定对应性,胶结效果最好的B+组分样品,其无侧限抗压强度也最高。
2.3.3 SEM分析
图7为4组样品的SEM照片。

图7 4组样品的SEM照片
由图7可见,4组试样中均能清晰地看到碳酸钙晶体,该晶体是常见的菱形六面体结构,且在试样中堆积紧密。A组分样品中碳酸钙成型良好;A+组分样品中可见规则的碳酸钙晶体形态;B组分样品中也可看到明显的碳酸钙晶体;B+组分样品中可见晶体内的明显孔洞,从尺寸大小及碳酸钙成型机理可推知,该孔洞应为细菌死亡后所留下的孔洞。
2.3.4 XRD分析
图8为经固化后4种样品的XRD图谱。
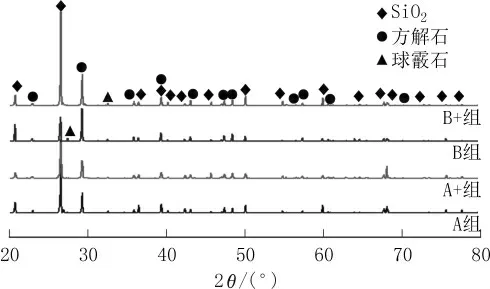
图8 固化后4种样品的XRD图谱
由图8可见,4种样品的衍射峰基本相同,样品所得的峰与标准峰吻合良好,主要成分有二氧化硅、碳酸钙2种物质,其中,碳酸钙的晶型属于方解石。方解石是一种难溶于水,而且与砂粒兼容性良好的物质。因此,本文采用的固化方法能将松散砂粒有效胶结,显著改善砂柱的力学性能。此外,在B菌种固化的砂柱样品中,还检测到少量球霰石晶体,这是营养盐溶液中的钙离子在微生物代谢作用下形成的晶体,属于微生物胶结后的附产物。
3 影响机制分析
综合上述结果,从碳酸钙含量、无侧限抗压强度、均匀性分析等方面尝试解释固化效果与各个因素之间的关系,其中均匀性分析参照标准差计算公式,以碳酸钙含量绝对值为原始数据进行计算,结果如表4所示。
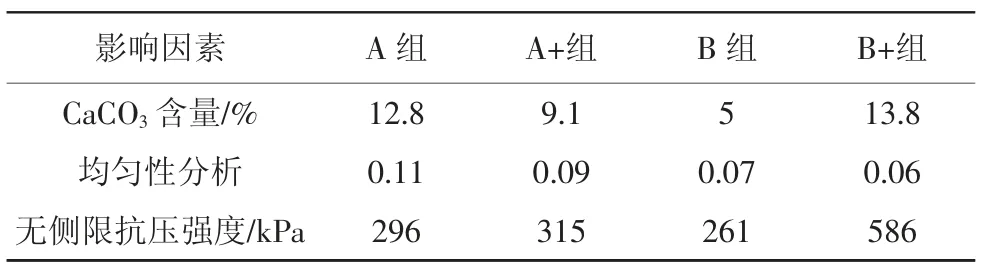
表4 影响机制分析
实验控制测试砂柱高度为4 cm,该实验获得的最大无侧限抗压强度为586 kPa。通气情况下的B菌种砂柱强度较高,不通气情况下的A菌种砂柱强度较高,该结果与脲酶活性实验结果相互印证。可见脲酶活性影响菌种的碳酸钙含量,进而对强度有一定影响。分析表4可知,碳酸钙含量和固化均匀性均对固化砂柱的无侧限抗压强度有影响。总的来说,与均匀性相比,碳酸钙含量对无侧限抗压强度的影响更大。碳酸钙含量越高则砂土固化强度越高,比较B+、A+、B组分,在固化均匀性相差较小时,碳酸钙含量与无侧限抗压强度呈明显正相关;均匀性对强度亦有贡献,比较A、B+两组分,在碳酸钙含量相近时,均匀性较好的组分无侧限抗压强度更高;通气条件对均匀性亦有贡献,分别比较A、A+及B、B+组分,处于注浆后持续通气10 min条件下的组分均匀性更好。综合来看,脲酶活性将导致碳酸钙含量产生差异,碳酸钙含量与砂土固化强度强相关。而在碳酸钙含量相近的情况下,均匀性将进一步对强度造成影响,通气条件则会对细菌均匀性造成影响,进而间接对固化产物及强度产生影响。
4 结论
(1)微生物脲酶活性、氧气偏好等本身影响其生命活动的生理指标直接影响砂柱固化的效果。微生物砂柱固化后,强度显著提高,本实验砂柱无侧限抗压强度最高可达586 kPa。
(2)脲酶活性将导致碳酸钙含量产生差异,而碳酸钙含量与砂土固化强度强相关。而在碳酸钙含量相近的情况下,固化均匀性将进一步对强度造成影响。其中,通气条件一方面可通过影响菌种的脲酶活性来影响碳酸钙总体含量,进而影响固化砂柱的强度;另一方面可通过改变菌种分布的均匀性,进一步改变固化产物分布的均匀性而影响固化砂柱的强度。
(3)XRD结果显示,固化产物为碳酸钙晶体;SEM结果表明,碳酸钙产物与细菌的作用后易产生孔洞。为今后研究砂粒胶结方式提供了方向与思路。
