TLR4抑制剂TAK-242预处理改善急性缺血性脑卒中诱导的肠黏膜屏障损伤①
2021-02-23杨涌涛石燕芳展群岭
伉 奕 杨涌涛 马 宇 程 惠 石燕芳 王 玥 展群岭 万 东
(重庆市九龙坡区中医院脑病科,重庆 400080)
脑卒中是一类由脑血管病变引发的神经功能缺损的脑血管疾病,分为缺血性脑卒中和出血性脑卒中两大类[1]。其中缺血性脑卒中的发病率、病死率和复发率远高于出血性脑卒中[2]。急性缺血性脑卒中(acute ischemic stroke,AIS)发生时机体会产生强刺激引起全身的应激反应,进而引发其他远端脏器发生病理改变。肠道是应激反应的中心器官,也是重要的靶器官,脑卒中应激引起的消化道症状在临床上很常见,如腹胀、便秘等[3],但由此引发的肠黏膜屏障损伤机理未见确切报道。因此,研究AIS病程中肠黏膜屏障功能障碍的发生机制具有重要临床意义。Toll样受体4(toll-like receptor 4,TLR4)是固有免疫的重要组成部分,可构成肠道的第一道保护屏障,既是细胞内的跨膜信号传导分子,又是细胞表面的免疫识别受体。有研究表明,急性肝衰竭诱导的肠黏膜屏障损伤中,LPS/TLR4/MyD88信号通路被激活,TLR4表达水平显著上调[4];也有研究认为,LPS可以通过激活TLR4/MyD88信号通路而影响肠上皮紧密连接,会导致肠道通透性增加,肠黏膜屏障破坏[5]。然而,TLR4是否参与AIS诱导的肠黏膜屏障损伤,目前还未曾报道。本研究通过线栓法制备大鼠中动脉栓塞所致的大鼠AIS模型,观察TLR4抑制剂TAK-242预处理对大鼠肠黏膜损伤的影响,以期为AIS的治疗提供思路和理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级雄性SD大鼠45只,7~8周龄,体重(260±20)g,由湖北省动物实验中心提供,动物合格证编号:SCXK(鄂)2019-0013。饲养条件:温度为24℃,湿度为50%,通风良好,明暗光照交替12 h,标准饲料喂养,自由进食及饮水。
1.1.2主要仪器及试剂 TAK-242又名Resatorvid(瑞沙托维),购自美国MedChemExpress公司;二胺氧化酶(diamine oxidase,DAO)、IL-6、内毒素(endotoxin,ET)、肿瘤坏死因子-α(TNF-α)、D-乳酸(D-Lactate, D-Lac)和IL-1β检测试剂盒购自美国R&D公司;异硫氰酸荧光素-葡聚糖(fluorescein isothiocyanate-dextran,FITC-Dextran)购自美国Sigma公司;Claudin-1、ZO-1、TLR4、MyD88、NF-κB p65和β-actin抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔及山羊抗小鼠IgG二抗购自武汉博士德生物工程有限公司。
1.2方法
1.2.1动物造模及分组处理 将45只SPF级雄性SD大鼠适应性饲养1周后,随机分成3组,即假手术组(sham)、模型组(model)、TAK-242预处理组(TAK-242),每组15只。所有大鼠腹腔注射2%戊巴比妥钠麻醉后,参照文献[6]采用改良Longa线栓法制作AIS大鼠模型,术后待大鼠清醒后采用Zea-Longa五级评分法进行评估,以1~3分为造模成功。其中sham组大鼠仅暴露颈动脉不插入线栓。术前24 h,TAK-242组大鼠经尾静脉注射TAK-242(10 mg/kg)[7],sham组和model组大鼠分别注射等量生理盐水。
1.2.2神经功能缺损评分 各组大鼠于造模24 h后,采用Zea-Longa五级评分法评估神经功能缺损情况,0分:未观察到神经功能缺失症状;1分:不能完全伸展左前肢,轻度神经功能缺失;2分:向左侧转圈,中度神经功能缺失;3分:向左侧倾倒,重度神经功能缺失;4分:无法正常行走,意识水平低下。评分越高表示神经功能损伤越严重[8]。
1.2.3TTC法评估大鼠脑梗死面积 造模24 h后,各组随机取5只大鼠,采用断头法处死大鼠,取脑并剔除小脑和低位脑干,立即放入-20℃冷冻,取出后沿冠状位从额极向后连续切片(约2 mm),2%TTC 染液于37℃避光染色15 min。正常区域呈鲜红色,梗死区域呈白色。采用Image-Pro Plus 6.0软件计算脑梗死面积占脑组织总面积的百分比(%)。
1.2.4ELISA检测大鼠血清相关指标 腹主动脉取血,以3 000 r/min离心5 min,分离血清,按照试剂盒说明书进行操作,采用酶标仪在450 nm波长处测定各孔的OD值,根据标准曲线计算血清中DAO、D-Lac、ET、TNF-α、IL-1β和IL-6的含量。
1.2.5FITC-Dextran示踪法[9]检测大鼠肠黏膜通透性 各组随机取5只大鼠,于造模后20 h,采用0.4 mg/g FITC-Dextran进行灌胃处理,4 h后采血,肝素钠抗凝,3 500 r/min离心15 min。取25 μl血浆加入100 μl PBS,用全波长多功能酶标仪测定其荧光强度,激发光波长为488 nm,发射光波长为525 nm,制作标准曲线并计算样品浓度。
1.2.6HE染色观察大鼠肠黏膜组织病理学变化 取距Treitz韧带5 cm处部分空肠组织,PBS液洗净后用10%甲醛固定24 h,随后进行脱水处理,并进行石蜡包埋,制作石蜡切片,厚度为3~4 μm,行HE染色,于显微镜下观察病理改变,采用Chui′s评分评价肠损伤情况[10]。
1.2.7Western blot检测大鼠小肠组织中相关蛋白表达 收集各组大鼠小肠组织,加入预冷的组织蛋白裂解液和蛋白酶抑制剂匀浆,冰上碾磨组织,4℃条件下12 000 r/min离心15 min,收集上清,采用考马斯亮蓝法测定蛋白浓度。取20 μg蛋白煮沸变性后上样,聚丙烯酰胺凝胶电泳分离蛋白,转移至PVDF膜,5%脱脂奶粉室温封闭1 h,分别加入Claudin-1、ZO-1、TLR4、MyD88、NF-κB p65和β-actin一抗,4℃孵育过夜。次日加入相应二抗室温孵育1 h,ECL试剂曝光显影。以目的蛋白与β-actin灰度比值表示该目的蛋白的相对表达量。

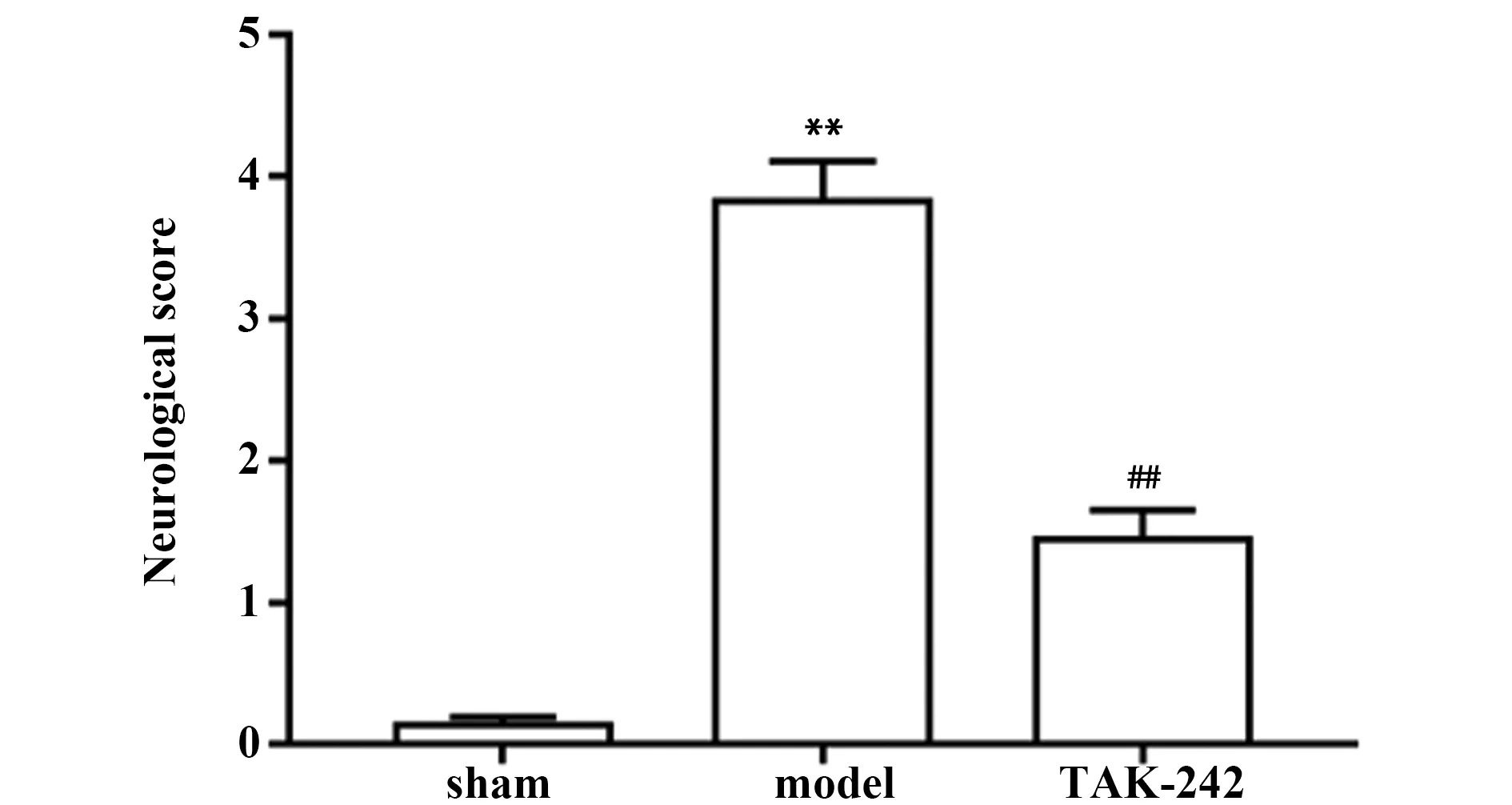
图1 各组大鼠神经功能缺损评分比较Fig.1 Comparison of neurological scores of rats in each groupNote:Compared with sham group,**.P<0.01;compared with model group,##.P<0.01.
2 结果
2.1各组大鼠神经功能缺损评分 如图1所示,与sham组比较,model组大鼠神经功能评分显著升高(P<0.05);与model组比较,TAK-242组大鼠神经功能评分显著降低(P<0.05)。
2.2TAK-242预处理对AIS大鼠脑梗死面积的影响 如图2所示,sham组大鼠未出现脑梗死现象,而model组和TAK-242组大鼠均出现脑梗死现象。与model组比较,TAK-242组大鼠脑梗死面积显著降低(P<0.05)。
2.3TAK-242预处理对AIS大鼠血清中DAO、D-Lac和ET含量的影响 如图3所示,与sham组比较,model组大鼠血清中DAO、D-Lac和ET含量显著升高(P<0.05);与model组比较,TAK-242组大鼠血清中DAO、D-Lac和ET含量显著降低(P<0.05)。
2.4TAK-242预处理对AIS大鼠血清中炎症因子水平的影响 如图4所示,与sham组比较,model组大鼠血清中TNF-α、IL-1β和IL-6含量显著升高(P<0.05);与model组比较,TAK-242组大鼠血清中TNF-α、IL-1β和IL-6显著降低(P<0.05)。
2.5TAK-242预处理对AIS大鼠肠黏膜通透性的影响 如图5所示,与sham组比较,model组大鼠血浆中FITC-Dextran浓度显著升高(P<0.05);与model组比较,TAK-242组大鼠血浆中FITC-Dextran浓度显著降低(P<0.05)。

图2 各组大鼠脑梗死面积比较
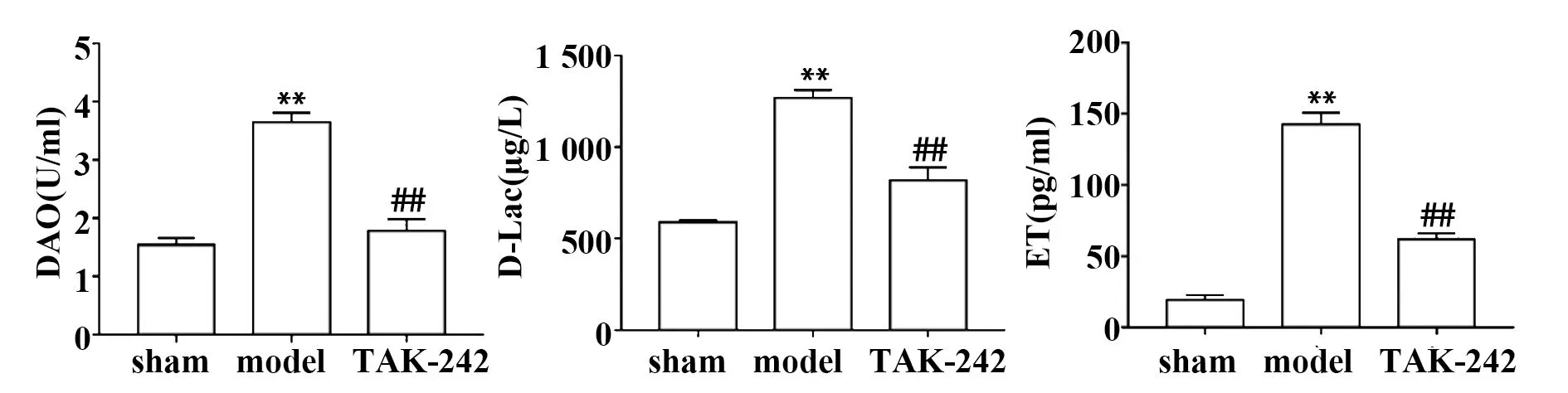
图3 各组大鼠血清中DAO、D-Lac和ET含量比较Fig.3 Comparison of DAO,D-Lac and ET contents in serum of rats in each groupNote:Compared with sham group,**.P<0.01;compared with model group,##.P<0.01.
2.6TAK-242预处理对AIS大鼠肠黏膜组织病理变化的影响 如图6A所示,sham组大鼠小肠黏膜完好,肠上皮细胞未见破坏,绒毛排布规整,刷状缘光整平滑;model组有严重的组织损伤,绒毛萎缩变形,肠隐窝加深,大量炎症细胞浸润,毛细血管充血;与model组比较,TAK-242组绒毛高度恢复,隐窝排列整齐,各层结构相对清晰完整。如图6B所示,与sham组比较,model组Chui′s评分显著升高(P<0.05);与model组比较,TAK-242组Chui′s评分显著降低(P<0.05)。
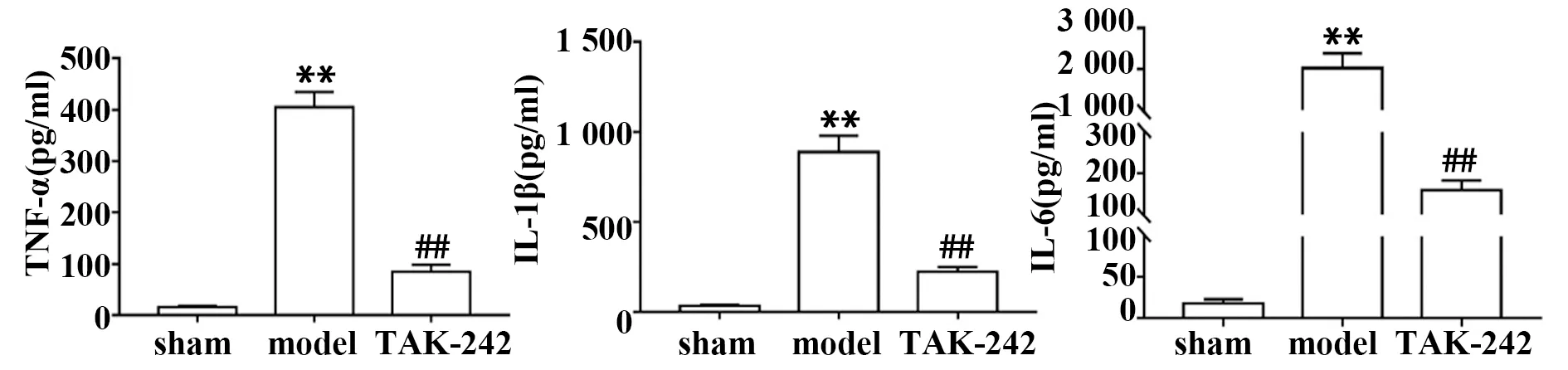
图4 各组大鼠血清中TNF-α、IL-1β和IL-6含量比较Fig.4 Comparison of TNF-α,IL-1β and IL-6 contents in serum of rats in each groupNote:Compared with sham group,**.P<0.01;compared with model group,##.P<0.01.
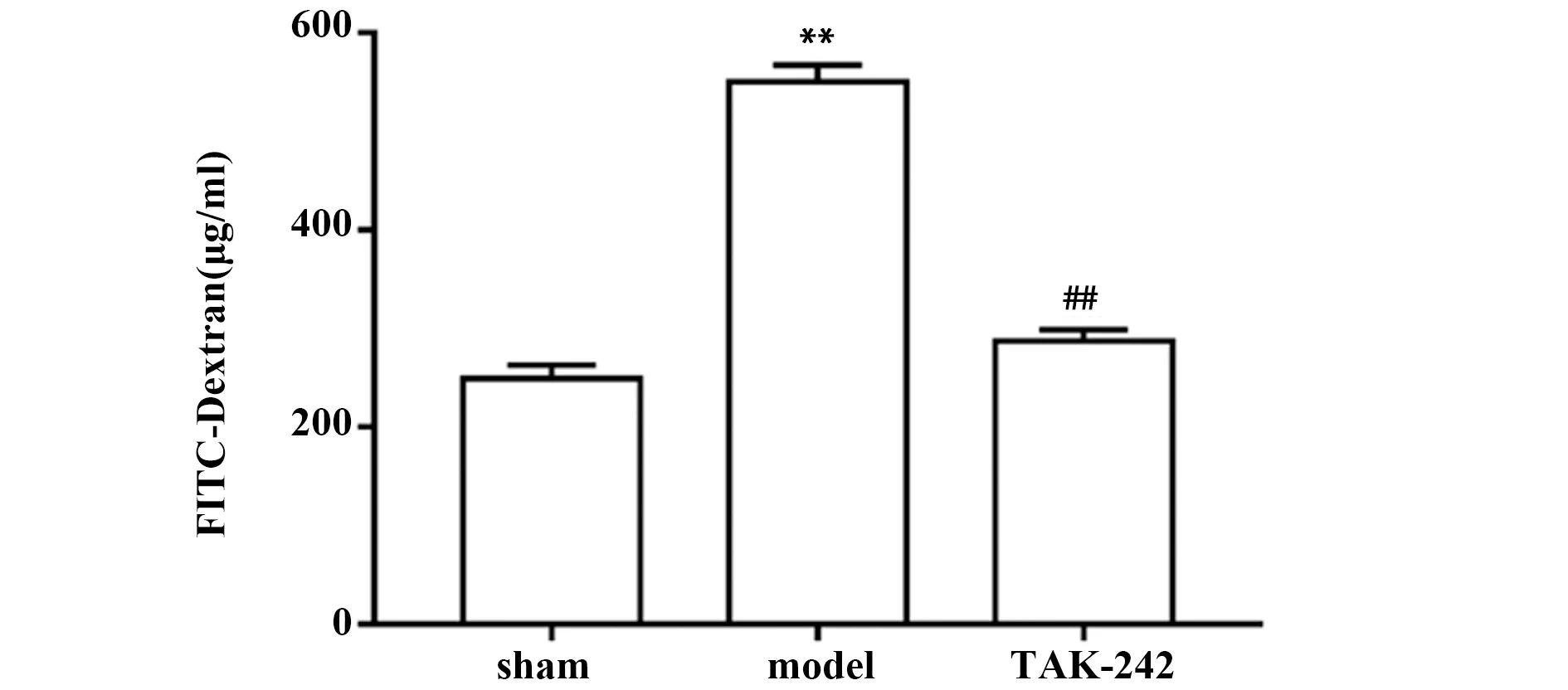
图5 各组大鼠肠黏膜通透性的比较Fig.5 Comparison of intestinal permeability of rats in each groupNote:Compared with sham group,**.P<0.01;compared with model group,##.P<0.01.
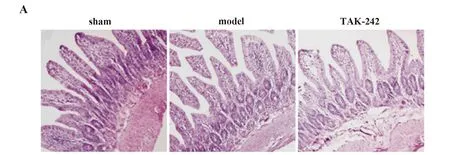
图6 各组大鼠小肠组织切片病理观察
2.7TAK-242预处理对AIS大鼠小肠组织紧密连接蛋白表达的影响 如图7所示,与sham组比较,model组大鼠小肠组织中Claudin-1和ZO-1蛋白水平均显著降低(P<0.05);与model组比较,TAK-242组大鼠小肠组织中Claudin-1和ZO-1蛋白水平均显著升高(P<0.05)。
2.8TAK-242预处理对AIS大鼠小肠组织TLR4/NF-κB信号通路的影响 如图8所示,与sham组比较,model组大鼠小肠组织TLR4、MyD88和NF-κB p65蛋白水平均显著上升(P<0.05);与model组比较,TAK-242组大鼠小肠组织中MyD88和NF-κB p65蛋白水平均显著降低(P<0.05),TLR4蛋白水平变化无统计学意义(P>0.05)。
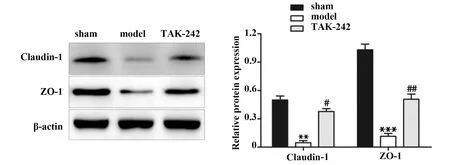
图7 各组大鼠小肠组织中Claudin-1和ZO-1蛋白表达比较Fig.7 Comparison of Claudin-1 and ZO-1 protein expression in small intestine of rats in each groupNote:Compared with sham group,**.P<0.01,***.P<0.001;compared with model group,#.P<0.05,##.P<0.01.
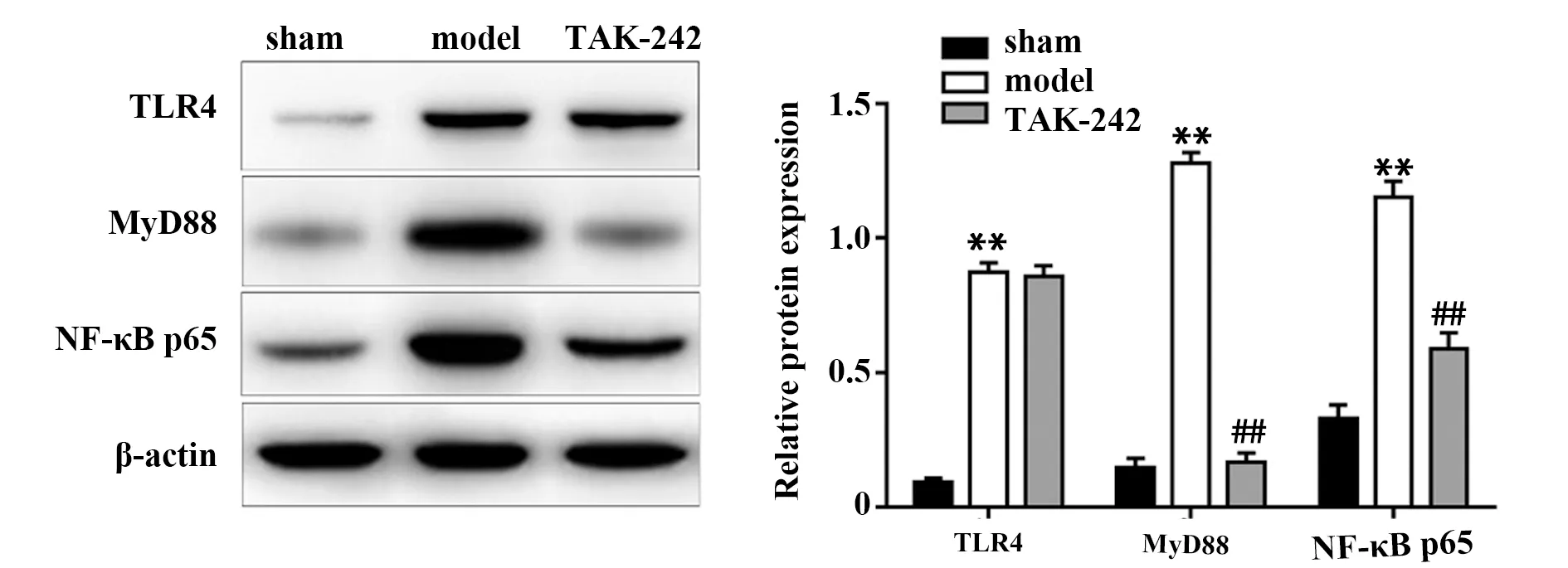
图8 各组大鼠小肠组织中TLR4、MyD88和NF-κB p65蛋白表达比较Fig.8 Comparison of TLR4,MyD88 and NF-κB p65 protein expression in small intestine of rats in each groupNote:Compared with sham group,**.P<0.01;compared with model group,##.P<0.01.
3 讨论
胃肠道作为人体重要的组织系统,是营养物质消化、吸收、转运的主要器官。正常情况下,肠道黏膜的各种生理性屏障可以保证致病因素无法越过屏障侵入肠道以外的地方,但遭受打击或应激状态下,屏障完整性被破坏,肠道就成了各种毒素和病原微生物入侵机体的第一道防线。目前认为肠道在应激时是多器官功能障碍的始动器官,AIS可使机体处于一种强烈的应激状态。本实验中使用的TLR4信号通路抑制剂TAK-242分子量小,可在机体组织中迅速分散,直接结合TLR4胞内区域,从而抑制炎症因子的产生[11]。本研究结果显示,TAK-242预处理可有效改善AIS大鼠神经功能以及肠黏膜屏障损伤。
D-乳酸(D-Lac)是肠道内多种细菌的发酵代谢产物,如大肠杆菌、克雷伯杆菌、乳酸杆菌等。正常生理条件下,肠道内的D-Lac在肠黏膜机械屏障的屏蔽下很少被吸收,但当肠黏膜屏障功能发生障碍时,D-Lac可经由损伤的肠黏膜入血,导致D-Lac的生成量上升,因此血液中D-Lac的含量能够作为评价肠黏膜受损伤程度的一个重要指标[12]。二胺氧化酶(DAO)是存在于哺乳动物小肠黏膜上皮细胞内的一种酶,它能够分解氨基酸代谢过程中产生的胺。在肠黏膜上皮细胞无损伤的情况下,血浆中无DAO的出现,但当肠黏膜上皮细胞被破坏时,细胞内的DAO便会释放入血,使血液中的含量上升,故DAO水平可以反映肠黏膜屏障功能及通透性的变化[13]。内毒素(ET)是促使机体发生炎症反应的重要因素之一,肠道黏膜屏障可导致肠道内ET移位至血液循环系统,因而血液ET含量常被作为临床判断机体肠道黏膜屏障功能的指标[14]。有研究显示,重症急性胰腺炎(SAP)诱导的大鼠胃肠功能障碍模型中,血清D-Lac和ET水平显著上调,右美托咪定可减轻SAP大鼠胃肠黏膜的损伤,下调D-Lac和ET的水平[15]。本研究结果显示,AIS大鼠血清中DAO、D-Lac和ET含量显著升高,表明肠黏膜屏障功能被破坏;而TAK-242预处理后可降低大鼠血清中DAO、D-Lac和ET含量,说明抑制TLR4的表达可以有效减轻屏障的损伤。
在众多肠道屏障功能障碍的损伤机制中,炎症介导损伤属于其中极其重要的一部分[16]。正常情况下,炎症反应本身属于机体自身的保护机制,但在反应激烈不受控制的情况下会呈现出“瀑布样”反应,对机体造成严重损伤。AIS诱导的肠黏膜屏障损伤将导致肠道内细菌和内毒素移至血液循环系统,从而诱发全身炎症反应综合征(SIRS),甚至是多系统功能衰竭综合征(MODS)。故本研究检测了各组大鼠血清中炎症因子水平,结果显示AIS大鼠血清中炎症因子TNF-α、IL-6和IL-1β含量均显著上升;而TAK-242预处理后大鼠血清中炎症因子TNF-α、IL-6和IL-1β含量均显著降低。说明干预TLR4表达可以抑制AIS大鼠肠黏膜屏障损伤介导的炎症反应。
FITC-Dextran是一种低分子多聚糖,正常情况下,机体不含FITC-Dextran且不被小肠吸收,经胃管进入消化道的FITC-Dextran进入血液循环的唯一方式便是破坏肠道屏障的完整性。血浆中的荧光强度越强,FITC-Dextran的浓度越高,提示肠黏膜屏障损伤越严重[17]。本研究结果显示,AIS大鼠血浆中FITC-Dextran浓度显著升高,与既往研究结果一致[9];而采用TAK-242预处理后大鼠血浆中FITC-Dextran浓度显著降低。同时病理结果显示,模型组大鼠的肠黏膜组织被破坏,肠绒毛减少且顶端上皮细胞坏死,肠黏膜内可见大量炎症细胞浸润;而TAK-242预处理后大鼠肠黏膜厚度及绒毛长度恢复,隐窝排列整齐,各层结构相对清晰完整。说明肠黏膜屏障保护系统与TLR4的表达具有相关性,抑制其表达可降低肠上皮细胞的通透性,缓解肠黏膜的损伤。
TLR4作为肠道固有免疫的重要组成部分,构成了肠道对细菌识别的第一道屏障,它既是细胞表面免疫识别受体,又是胞内跨膜信号传导分子。在TLR4激活后的信号传递过程中,MyD88依赖的信号途径占主导地位,通过依次活化多个胞内信号衔接分子,最终激活通路下游的NF-κB从而调控多种炎症介质的表达[18-19]。此外,肠黏膜结构系统中包含紧密连接蛋白,其中膜蛋白ZO-1和跨膜蛋白Claudin-1是两种典型的紧密连接蛋白。他们的存在影响肠道选择性屏障功能,无论是变异、减少还是缺失都会导致肠上皮细胞的通透性提高,从而使内毒素等大分子物质进入体循环。故ZO-1和Claudin-1的表达水平能在一定程度上反映肠屏障损伤情况[20-21]。本研究结果显示,AIS大鼠小肠组织中Claudin-1和ZO-1蛋白水平均显著降低,而TLR4、MyD88和NF-κB p65蛋白水平均显著上升;采用TAK-242预处理后大鼠小肠组织中Claudin-1和ZO-1蛋白水平均显著升高,MyD88和NF-κB p65蛋白水平均显著降低,而TLR4蛋白水平改变无统计学意义,这主要与TAK-242的作用原理相关,TAK-242对TLR4信号通路的抑制作用主要是通过下调 TLR4下游信号分子MyD88蛋白的表达发挥抑制作用[22]。由此可以推测AIS诱导的肠黏膜屏障损伤与TLR4/NF-κB信号通路的激活有关。
综上所述,TLR4抑制剂TAK-242可通过抑制TLR4/NF-κL信号通路介导的炎症反应,从而改善AIS诱导的肠道屏障功能损伤,本研究结果可为AIS诱导的肠黏膜屏障损伤的防治提供新的理论依据。此外,肠道炎症反应是肠黏膜屏障损伤的早期表现,而本研究并未对肠道局部炎症因子水平进行检测,这是本文的不足之处,后续研究中将进行完善。
