西红花苷对缺血性脑卒中后抑郁大鼠炎症反应及TLR4/MyD88/NF-κB信号通路的影响①
2021-02-23徐倩倩钱旭东窦志杰张雪茹
徐倩倩 钱旭东 孙 凡 刘 恒 窦志杰 龚 静 张雪茹
(承德医学院附属医院神经内科,承德 067000)
卒中后抑郁是脑卒中后常见的情感障碍,发病率较高,预后较差,且卒中后抑郁可诱发脑卒中再发以及其他血管相关事件。卒中后抑郁的发病机制复杂,研究发现中枢神经系统的炎症反应在卒中后抑郁的发病中发挥重要作用[1]。西红花苷为一类水溶性类胡萝卜素,具有抗炎、心血管保护、神经保护、抗肿瘤等多种药理活性[2]。陈欣宇等[3]研究发现卒中后抑郁大鼠脑组织IL-1水平升高,西红花苷可降低脑组织IL-1水平,通过抗炎作用发挥改善卒中后抑郁大鼠的抑郁症状。但西红花苷对卒中后抑郁脑组织中其他炎症因子的影响及其抗炎的可能机制目前少有报道。本文研究西红花苷对脑卒中后抑郁大鼠脑组织IL-1β、IL-6、肿瘤坏死因子-α(TNF-α)水平及Toll样受体4/髓样分化蛋白88/核转录因子-κB(TLR4/MyD88/NF-κB)信号通路的影响,进一步探讨西红花苷对脑卒中后抑郁大鼠抑郁症状的缓解作用及可能机制。
1 材料与方法
1.1材料 健康、雌雄各半、清洁级、体重200~220 g SD大鼠购自北京市医疗器械检验所,许可证号:SYXK(京)2015-0005,动物购回后在承德医学院动物房中适应性饲养1周,用标准啮齿类动物饲养笼饲养,自由进食进水。西红花苷(源叶生物公司,纯度99%,批号:111588-201812);苏木素(南京建成生物工程研究所);兔抗鼠TLR4多克隆抗体(1∶200)、兔抗鼠MyD88多克隆抗体(1∶200)、兔抗鼠NF-κB多克隆抗体、兔抗鼠P65多克隆抗体、兔抗鼠p-P65多克隆抗体、兔抗鼠I-κBα多克隆抗体、兔抗鼠p-I-κBα多克隆抗体(美国Sigma公司);IL-1β、IL-6、TNF-α ELISA试剂盒(南京建成生物工程研究所);Olympus BX51显微镜(日本奥林巴斯);Tanon电泳仪(上海天能科技有限公司)。
1.2方法
1.2.1分组 将72只大鼠根据随机数字法分为对照组(C组)、模型组(M组)、西红花苷组(CR组),每组24只。
1.2.2脑卒中模型建立 M组和CR组大鼠采用KoiZumi法建立脑卒中大鼠模型[4]。水合氯醛麻醉大鼠,取颈前正中切口,暴露,分离颈总动脉、颈外动脉、颈内动脉,结扎颈总动脉主干和颈外动脉近端,动脉夹夹闭颈内动脉,颈总动脉分叉处剪开一小口,插入线栓,插入线栓长度约18~20 mm,建立局灶性脑缺血改变,结扎颈内动脉,逐层缝合。对照组大鼠不插入线栓,其他步骤同模型组。建模24 h内,采用Longa 5分法评定大鼠神经功能,行为正常者为0分;提起大鼠对侧前肢内收、内旋者为1分;挤压大鼠两侧,对侧抵抗力下降者为2分;大鼠围绕手术对侧转圈者记3分;无法自主活动者记4分[5]。0分和4分大鼠弃之不用,取正常大鼠重新按上述方法建模以补充。实验过程中观察各组大鼠每天进食、饮水、毛色、活动度、逃避反应等情况。实验过程中死亡大鼠则另取正常大鼠按照同样方法以补充。
1.2.3脑卒中后抑郁模型建立 M组和CR组大鼠脑卒中建模后7 d开始,按照慢性不可预见的温和性应激建立脑卒中后抑郁模型,慢性不可预见的温和性应激包括:禁水17 h、禁食20 h、持续光照17 h、倾斜鼠笼45°17 h、湿笼21 h、水平摇晃5 min、4℃游泳5 min、夹尾1 min、行为限制2 h[6]。以上刺激每日随机采用1种,相邻两天刺激不相同,结合单独饲养,共21 d,建立脑卒中后抑郁模型,C组大鼠群笼正常环境饲养。建模大鼠糖水消耗实验和旷场试验结果与未建模大鼠有显著性差异表示建模成功。
1.2.4给药方式 慢性不可预见的温和性应激期间CR组大鼠腹腔注射西红花苷(50 mg/kg),1次/d,至应激刺激结束[7]。C组和M组大鼠按照相同方法腹腔注射等量生理盐水。
1.2.5体重检测 分别予应激前和应激后称取各组大鼠体重。
1.2.6糖水适应实验 先给予大鼠糖水训练检测其基线值:第1天内给予2瓶1%蔗糖水,第2天内给予1瓶蔗糖水、1瓶矿泉水,禁食禁水23 h,测接下来1 h糖水消耗,即给予1瓶蔗糖水和1瓶矿泉水。统计糖水偏嗜比(SP)(SP=糖水摄入量/糖水和矿泉水总摄入量×100%)。然后给予2 h正常饮食饮水,禁食禁水 21 h,测1 h糖水消耗,以最后1次SP为基线值,排除SP<60%大鼠,取正常大鼠重新建模补充。分别测量各组大鼠应激前和应激后SP值。
1.2.7旷场试验 采用80 cm×80 cm×60 cm敞箱进行旷场试验。将箱底面分为面积相等的25块,大鼠在底面进行水平活动,若靠边行走,则穿越1格为1次,若按直径方向走,10 cm为1次。垂直得分为大鼠双前爪离开底面再落到底面为1次。分别与应激前和应激后,观察5 min内各大鼠水平运动次数和垂直运动次数。
1.2.8取材 旷场试验结束后,每组取12只大鼠进行心脏灌流,至腹腔内脏器由红色变为苍白色、左心房流出液为无色时改用多聚甲醛继续灌注固定脑组织,至大鼠四肢完全变硬后停止灌流,断头取出脑组织,多聚甲醛固定4 h,常规进行石蜡包埋,制成 4 μm石蜡切片。每组剩余12只大鼠水合氯醛麻醉,在冰盘上快速开颅取脑,分离海马组织,将其分为2份,一份用于ELISA测定,一份用于Western blot测定。
1.2.9ELISA测定脑组织IL-1β、IL-6、TNF-α水平 将海马组织在冰浴环境下研磨匀浆,15 000 r/min 离心20 min,取上清液,ELISA测定脑组织IL-1β、IL-6、TNF-α水平。
1.2.10免疫组化测定脑组织TLR4、MyD88、NF-κB表达 取海马最大的冠面切片进行免疫组化染色:将海马组织石蜡切片脱蜡、水化,枸橼酸修复缓冲液高压热修复抗原,置于过氧化氢中孵育10 min封闭内源性过氧化物酶活性,PBS冲洗,加入一抗:兔抗鼠TLR4多克隆抗体(1∶200)、兔抗鼠MyD88多克隆抗体(1∶200)、兔抗鼠NF-κB多克隆抗体(1∶200)过夜孵育,PBS液冲洗,加入抗兔抗体酶复合物孵育30 min,PBS液冲洗,DAB显色10 min,流水冲洗,苏木素复染2 min,PBS液冲洗,梯度酒精脱水,二甲苯透明,中性树胶封片。阴性对照用PBS代替一抗。胞浆呈棕黄色为阳性细胞。镜下观察200倍视野下CA1区免疫组化阳性细胞数。
1.2.11Western blot测定各组大鼠脑组织P65、p-P65、I-κBα、p-I-κBα蛋白水平 取大鼠海马组织加入RIPA裂解液冰浴中匀浆,收集总蛋白,考马斯亮蓝法测定蛋白总量,经电泳,转膜,脱脂奶粉封闭,加入一抗:兔抗鼠P65多克隆抗体(1∶300)、兔抗鼠p-P65多克隆抗体(1∶300)、兔抗鼠I-κBα多克隆抗体(1∶300)、兔抗鼠p-I-κBα多克隆抗体(1∶300),过夜孵育,加入二抗(1∶2 000)孵育2 h,ECL发光剂发光,胶片上曝光,经显影定影后,采用Quantity One软件分析条带灰度值。以β-actin为内参。目标蛋白水平以目标蛋白条带灰度值/β-actin条带灰度值表示。

2 结果
2.13组大鼠一般状态 C组大鼠进食、饮水、毛色、活动度均正常;M组大鼠进食、饮水减少,毛色差、活动量明显减少,无明显逃避反应;CR组大鼠进食、饮水、毛色、活动度及逃避反应均较M组改善。整个实验过程中共死亡15只大鼠,均另取正常大鼠按照同样方法处理以补充。
2.23组大鼠体重比较 应激前,3组大鼠体重差异无统计学意义(F=0.074,P=0.929);应激后,3组大鼠体重差异有统计学意义(F=65.672,P<0.001),M组大鼠体重低于C组,CR组大鼠体重高于M组。见图1。
2.33组大鼠SP比较 应激前,3组大鼠SP差异无统计学意义(F=0.130,P=0.878);应激后,3组大鼠SP差异有统计学意义(F=214.307,P<0.001),M组大鼠SP低于C组,CR组大鼠SP高于M组。见图2。
2.43组大鼠水平运动次数比较 应激前,3组大鼠水平运动次数差异无统计学意义(F=0.049,P=0.952); 应激后,3组大鼠水平运动次数差异有统计学意义(F=115.912,P<0.001),M组大鼠水平运动次数低于C组,CR组大鼠水平运动次数高于M组。见图3。
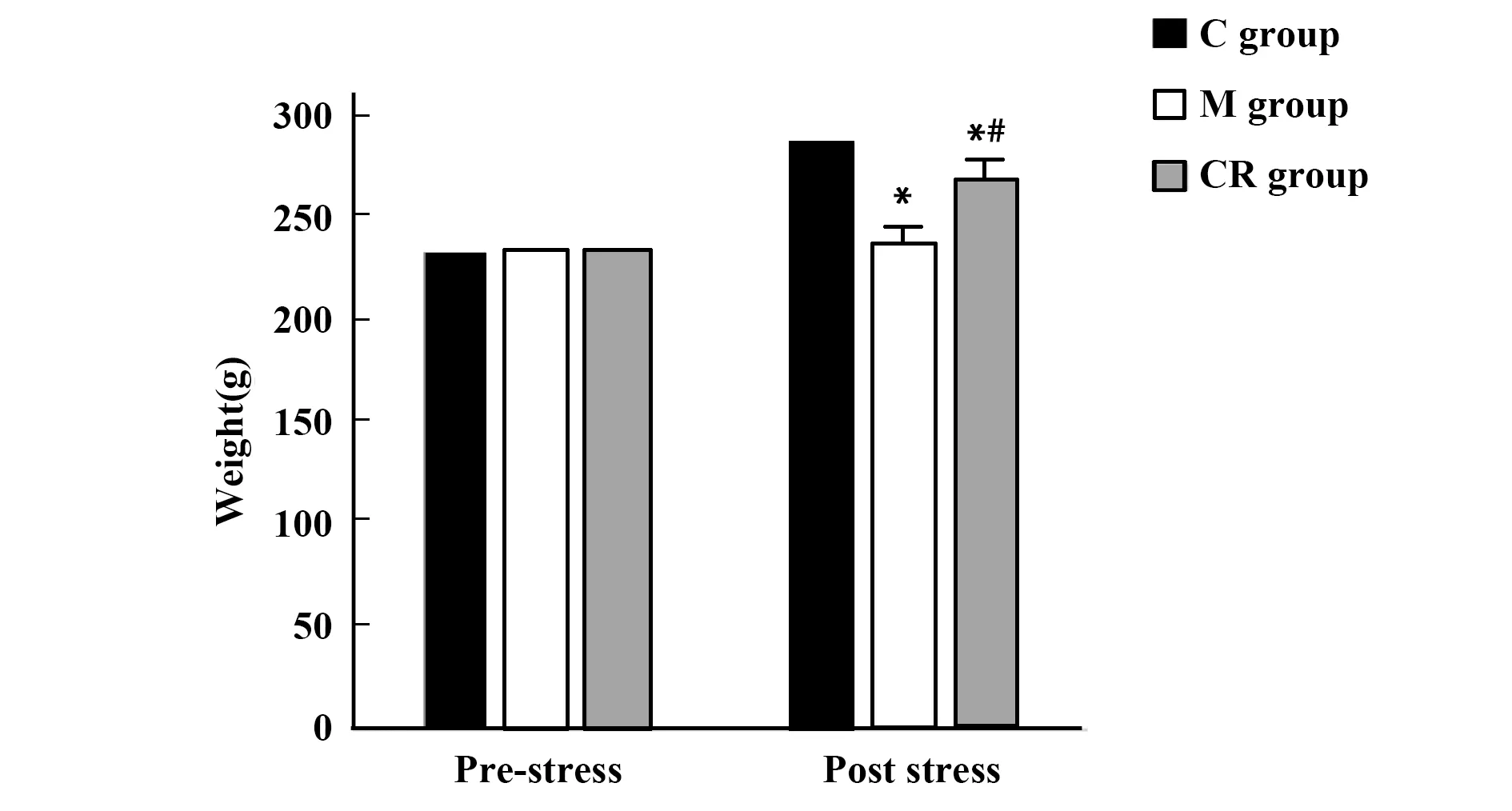
图1 3组大鼠应激前后体重比较Fig.1 Comparison of body weight before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
2.53组大鼠垂直运动次数比较 应激前,3组大鼠垂直运动次数差异无统计学意义(F=0.355,P=0.702);应激后,3组大鼠垂直运动次数差异有统计学意义(F=69.910,P<0.001),M组大鼠垂直运动次数低于C组,CR组大鼠垂直运动次数高于M组。见图4。
2.63组大鼠海马组织IL-1β、IL-6、TNF-α水平比较 应激后,3组大鼠海马组织IL-1β、IL-6、TNF-α水平差异有统计学意义(P<0.05),M组大鼠海马组织IL-1β、IL-6、TNF-α水平高于C组,CR组大鼠海马组织IL-1β、IL-6、TNF-α水平低于M组。见表1。
2.7各组大鼠海马组织TLR4、MyD88、NF-κB免疫组化表达 应激后,3组大鼠海马组织TLR4、MyD88、NF-κB阳性细胞数差异有统计学意义(P<0.05),M组大鼠海马组织TLR4、MyD88、NF-κB阳性细胞数高于C组,CR组大鼠海马组织TLR4、MyD88、NF-κB阳性细胞数低于M组。见表2、图5~7。
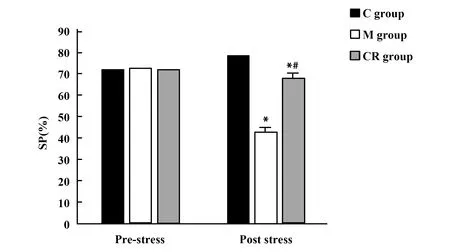
图2 3组大鼠应激前后SP比较Fig.2 Comparison of SP before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
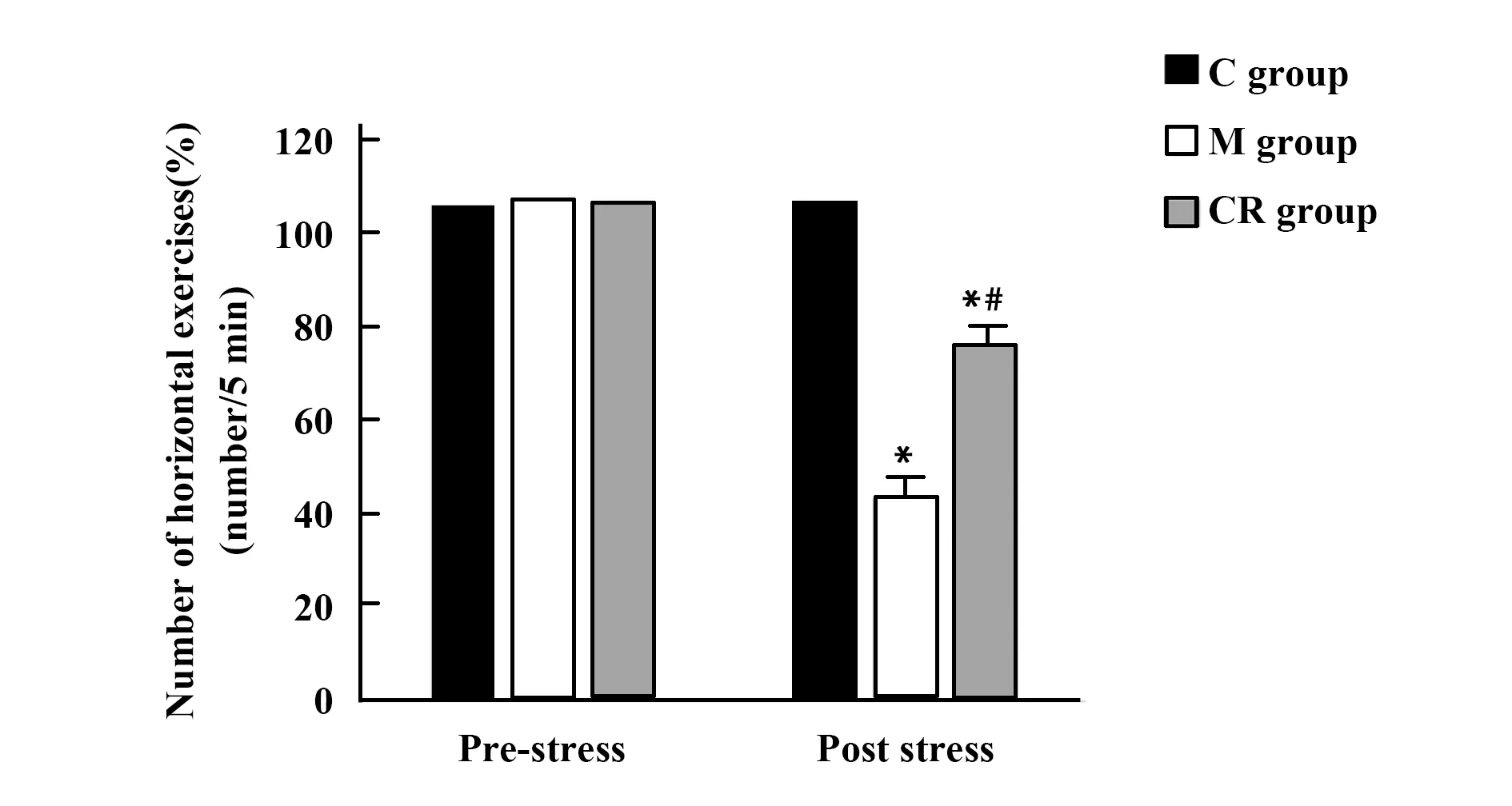
图3 3组大鼠应激前后水平运动次数比较 Fig.3 Comparison of horizontal exercises number before and after stress in three groups of ratsNote:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
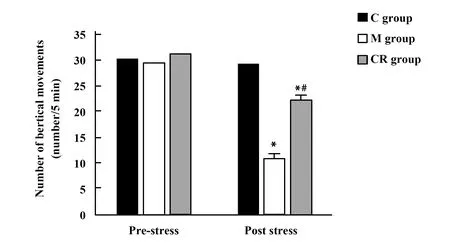
图4 3组大鼠应激前后垂直运动次数比较(次/5 min)Fig.4 Comparison of vertical movements number before and after stress in three groups of rats(number/5 min)Note:Compared with C group,*.P<0.05;compared with M group,#.P<0.05.
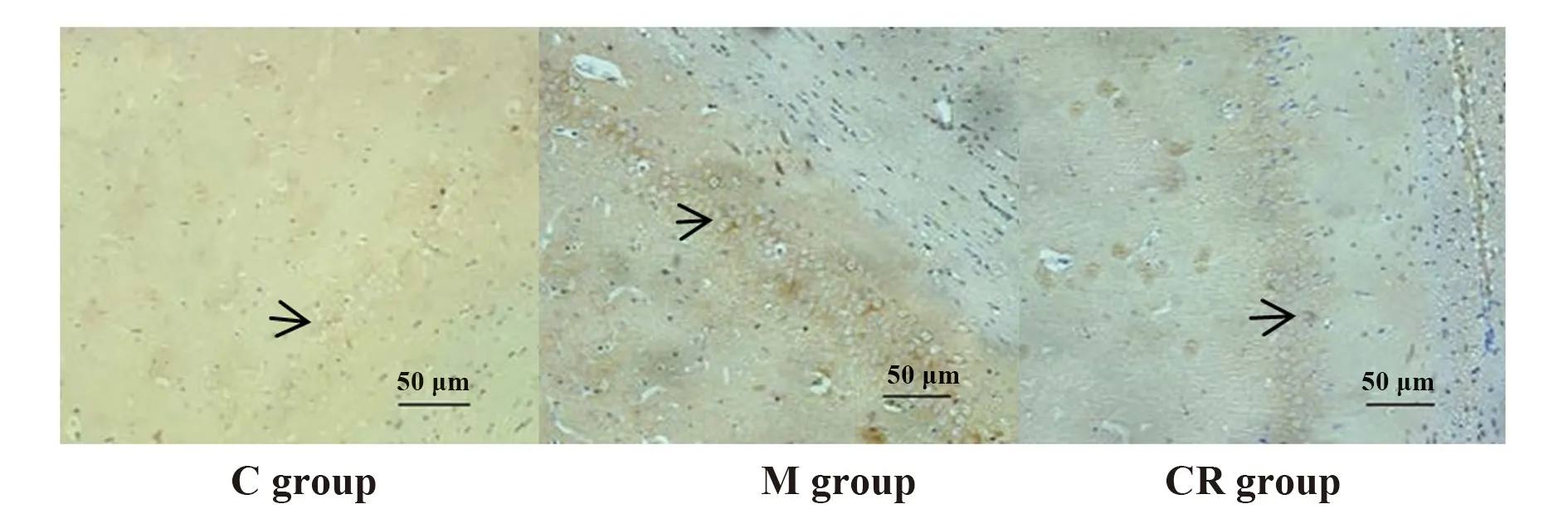
图5 免疫组化测定3组大鼠海马组织TLR4表达(×200)Fig.5 TLR4 expression in hippocampus tissue of three groups of rats by immunohistochemistry(×200)

图6 免疫组化测定3组大鼠海马组织MyD88表达(×200)Fig.6 MyD88 expression in hippocampus tissue of three groups of rats by immunohistochemistry(× 200)

图7 免疫组化测定3组大鼠海马组织NF-κB表达(×200)Fig.7 NF-κB expression in hippocampus tissue of three groups of rats by immunohistochemistry(×200)
表1 3组大鼠海马组织IL-1β、IL-6、TNF-α水平比较

表2 3组大鼠海马组织TLR4、MyD88、NF-κB阳性细胞数比较

表3 3组大鼠海马组织P65、p-P65、I-κBα、p-I-κBα蛋白水平比较
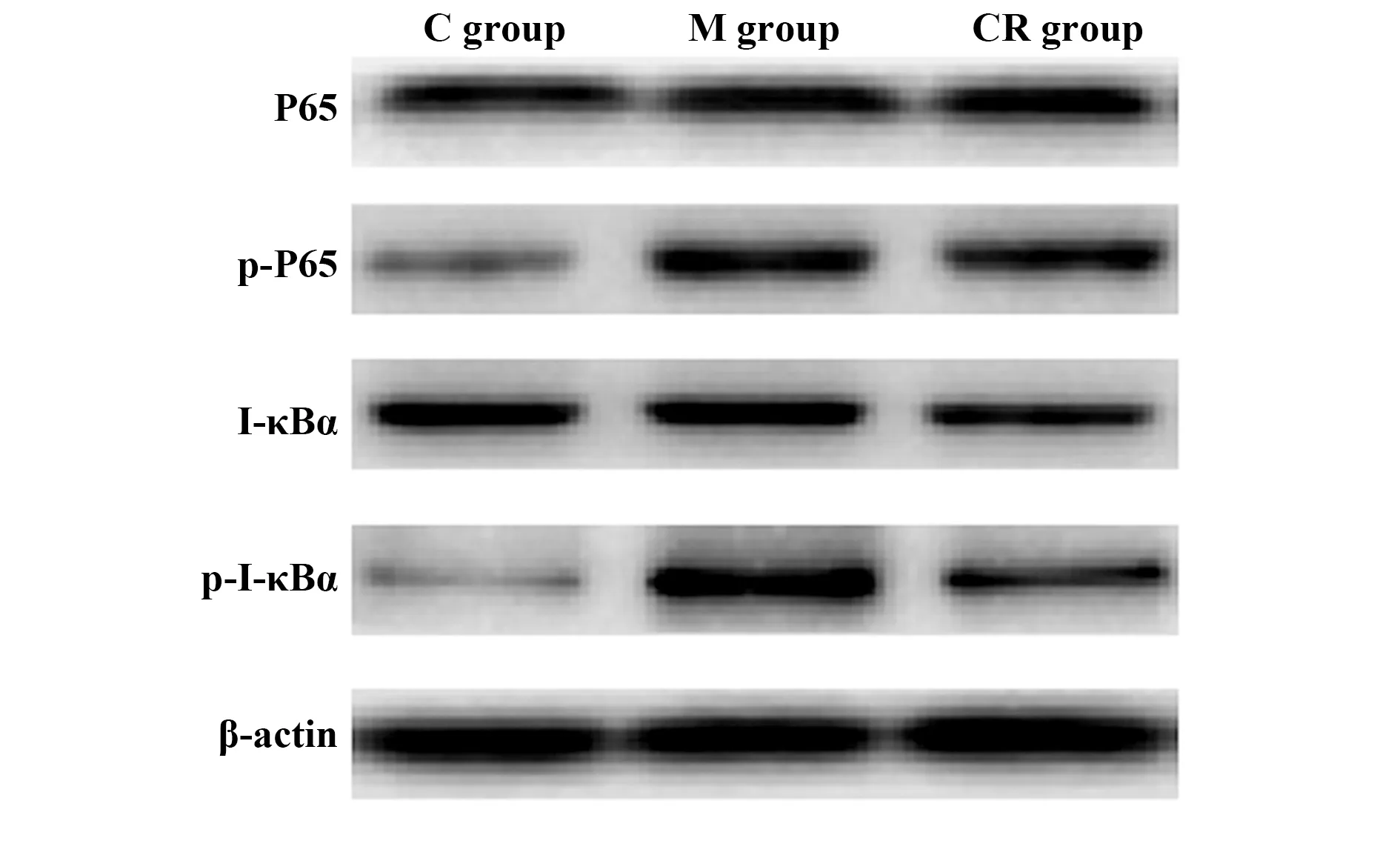
图8 Western blot测定各组大鼠海马组织P65、p-P65、I-κBα、p-I-κBα蛋白水平Fig.8 Western blot determination of P65,p-P65,I-κBα,and p-I-κBα protein levels in hippocampus tissue of rats in each group
2.83组大鼠海马组织P65、p-P65、I-κBα、p-I-κBα蛋白水平比较 3组大鼠海马组织P65、I-κBα蛋白水平差异无统计学意义(P>0.05);3组大鼠海马组织p-P65、p-I-κBα蛋白水平差异有统计学意义(P<0.05),M组大鼠海马组织p-P65、p-I-κBα蛋白水平高于C组,CR组大鼠海马组织p-P65、p-I-κBα蛋白水平低于M组。见表3、图8。
3 讨论
脑卒中后抑郁为脑卒中后比较严重的一类并发症,大约1/3的脑卒中患者会出现脑卒中后抑郁。脑卒中后抑郁为一类慢性疾病,患者往往出现失望、悲观、对治疗失去信心、绝食及自杀倾向,从而对患者的预后带来不良影响。脑卒中后抑郁的发病机制复杂,近年来研究已证实脑卒中后抑郁患者抑郁行为的发生是由促炎细胞因子介导的,脑卒中可引起IL-1β、IL-6、TNF-α等多种促炎因子水平升高,这些炎症因子和内分泌功能、神经递质代谢、突触可塑性等病理生理过程关系密切[6-8]。下丘脑-垂体-肾上腺轴异常和抑郁症的发生关系密切,下丘脑-垂体-肾上腺轴的激活是抵御应激的内分泌机制之一;IL-1β、IL-6、TNF-α等炎症因子是引起下丘脑-垂体-肾上腺素轴改变的潜在因素之一,其可引起皮质醇和乙酰胆碱水平升高,影响去甲肾上腺素活性。炎症细胞因子水平升高还可引起吲哚胺-2,3-双加氧酶升高,导致脑组织5-HT含量下降,从而诱发抑郁症状的发生。如WEN等[9]研究发现脑卒中诱发的炎症反应与脑卒中后抑郁的关系密切;JIAO等[10]研究发现IL-6与脑卒中后抑郁的患病风险呈正相关,可以预测脑卒中后抑郁的预后;WIUM-ANDERSEN等[11]研究发现抗炎治疗可降低脑卒中后抑郁的患病风险。由此可见,抑制炎症反应对脑卒中后抑郁具有防治作用。
炎症反应可由多种信号通路介导,TLR4/MyD88/NF-κB信号通路为介导炎症反应的主要信号通路之一。TLRs为Ⅰ型跨膜蛋白,其和配体结合可导致细胞内同源区募集接头蛋白,从而活化炎症反应,产生一系列炎症因子[12-16]。TLR4为研究最广泛的一种,在中枢神经系统中,TLR4主要在神经胶质细胞中表达。脑损伤时产生的内源性配体可激活TLR4,活化的TLR4通过MyD88依赖性信号通路激活NF-κB。在MyD88依赖性信号途径中,MyD88与IL-1受体相关激酶结合,激活TNF受体相关因子-6,使I-κKɑ/β磷酸化被激活,从而进一步激活NF-κB,NF-κB转入细胞核,诱导产生IL-1β、IL-6、TNF-α等一系列炎症因子,从而导致炎症反应的发生[17]。
西红花苷来源于番红花、栀子花,具有抗肿瘤、抗血栓、调节免疫功能、保护神经元、抗神经炎症等多种作用。大量研究发现西红花苷在多种炎症相关性疾病中发挥抗炎作用,如LI等[12]研究发现西红花苷可抑制类风湿关节炎的炎症反应;YARIJANI等[13]研究发现西红花苷通过抑制炎症反应发挥对缺血再灌注引起肾脏损伤的保护作用;SHAFAHI等[14]研究发现西红花苷通过抗炎作用抑制海马神经元凋亡;LIU等[15]研究发现西红花苷对大鼠Ⅱ型胶原诱导的关节炎具有抗炎和抗关节炎作用。西红花苷可通过NF-κB信号通路发挥作用,如FU等[18]研究发现西红花苷通过抑制NF-κB信号通路激活来抑制破骨细胞形成和骨吸收;DU等[19]研究发现西红花苷可通过抑制NF-κB信号激活减少烟曲霉诱导的气道炎症;LI等[20]研究发现西红花苷可抑制NF-κB信号通路引起的炎症反应,发挥对足细胞的保护作用。
本文通过建立脑卒中后抑郁大鼠模型,并给予西红花苷治疗,发现西红花苷可改善脑卒中后抑郁大鼠的抑郁症状,降低海马组织IL-1β、IL-6、TNF-α水平。表明西红花苷可能通过抑制脑组织炎症反应缓解脑卒中后抑郁大鼠的抑郁症状。介于TLR4/MyD88/NF-κB信号通路在介导炎症反应中发挥重要作用,西红花苷可通过NF-κB信号通路抑制炎症反应,因此推测西红花苷可能通过TLR4/MyD88/NF-κB信号通路抑制炎症反应,从而发挥抗抑郁作用。本文对其进行研究,发现西红花苷可降低脑卒中后抑郁大鼠海马组织中TLR4、MyD88、NF-κB表达,降低海马组织p-P65、p-I-κBα蛋白水平。p-P65为NF-κB的活化形式,p-P65水平降低表明NF-κB的活化被抑制;I-κBα本身具有抑制NF-κB活化的作用,I-κBα降解可导致NF-κB进入细胞核内活化,启动下游因子表达,抑制I-κBα降解,可抑制I-κBα磷酸化过程,降低p-I-κBα水平,从而抑制NF-κB转录活化水平[21]。故本研究结果表明西红花苷具有抑制TLR4/MyD88/NF-κB信号通路激活的作用,由此推测西红花苷可能通过抑制TLR4/MyD88/NF-κB信号通路激活抑制脑组织炎症反应的发生,从而发挥对脑卒中后抑郁大鼠抑郁症状的改善作用。
综上所述,西红花苷具有抑制脑卒中后抑郁大鼠抑郁症状的作用,其机制可能为西红花苷通过抑制脑组织TLR4/MyD88/NF-κB信号通路抑制炎症反应,从而抑制抑郁症状的发生。
