基于TLR4/MyD88/TRIF通路探讨芪参合剂对耐药肺炎克雷伯菌脓毒症大鼠的固有免疫调节机制①
2021-02-23王宜艳上海中医药大学附属龙华医院上海200032
王宜艳 陈 伟 (上海中医药大学附属龙华医院,上海 200032)
脓毒症是重症监护病房(intensive care unit,ICU)中最常见的重症疾病之一,有着高发病率和高死亡率[1]。迄今为止,尚无针对脓毒症的特异性疗法。近年来肺炎克雷伯菌(Klebsiellapneumoniae,K.p)逐渐成为引起临床感染的常见致病菌,更是引起脓毒症的主要致病菌[2]。研究表明,其分离率和耐药率逐年上升,ICU中K.p耐药性更是普遍高于非ICU科室,导致ICU脓毒症的治疗难度进一步提高[3-4]。因此只有寻求新的治疗方法才可能改善患者的预后,中医药在治疗脓毒症方面具有独特优势[5]。前期实验证实芪参合剂对耐药K.p脓毒症大鼠的器官功能有保护作用,初步表明可能是通过调节固有免疫实现的。但芪参合剂对耐药K.p脓毒症大鼠固有免疫调节的具体机制尚不明确,本文在整体实验的基础上,结合分子生物学检测,探讨芪参合剂防治脓毒症的新靶点,为脓毒症的临床治疗提供新的实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康SPF级雄性SD大鼠40只,6~8周龄,体重180~230 g,购自上海西普尔-必凯实验动物有限公司,合格证号:2008001683615,许可证号:SCXK(沪)2013-0016,饲养于上海金山公共卫生临床中心实验动物部动物生物安全二级(ABSL-2)动物房。实验大鼠均分笼饲养,自由饮水,室温(20±2)℃,相对湿度为55%~65%,光照适度,通风洁净。
1.1.2药物 中药复方芪参合剂农本方颗粒由生黄芪30 g、炙黄芪30 g、丹参30 g、川芎15 g组成,购自上海中医药大学附属龙华医院中药房。配制成生药浓度为1 g/ml的药液,提前配制分装于4℃保存备用。
1.1.3菌株来源 K.p临床耐药菌株(编号:A0222561)为上海中医药大学附属龙华医院重症监护病房脓毒症患者痰培养标本,由检验科鉴定赠予,仅对替加环素和多黏菌素E敏感。
1.1.4仪器与试剂 基因扩增仪(Applied Biosysterm公司,ViiA7Real-time PCR);酶标仪(美国Biotek公司,Synergy H4);电泳仪基础电源、制胶架、电泳转印槽(Bio-Rad公司);红外成像系统(美国LI-COR公司,2800);谷丙转氨酶(alanine pminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、尿素氮(blood urea nitrogen,BUN)及肌酐(creatinine,Cre)试剂盒(南京建成);TAK242试剂(APExBIO公司,A3850);反转录试剂盒(日本TaKaRa公司,RR037A);扩增试剂盒(日本ToYoBo公司,QPK-201);TLR4小鼠单克隆抗体(Santa Cruz公司,sc-293072);MyD88兔多克隆抗体(CST公司,4283s)、beta-actin兔单克隆抗体(CST公司,4970s);TRIF兔单克隆抗体(Abcam公司,ab180689);NF-κB p65兔多克隆抗体(Servicebio公司,GB13142-1);大鼠IL-6、TNF-α、MIP-2 ELISA、CXCL1 ELISA试剂盒(上海西唐生物)。
1.2方法
1.2.1细菌悬液制备 平板划线复苏细菌后,挑取单个独立菌落至LB肉汤,置于37℃恒温空气摇床,220 r/min振荡过夜(15~18 h),培养至对数生长期后,麦氏比浊法估算LB肉汤细菌悬液的细菌浓度,最后将细菌悬液离心(4℃、4 000 r/min、15 min)弃上清,无菌PBS重悬稀释至1×109CFU/ml用于接种[6]。
1.2.2耐药K.p脓毒症大鼠模型的建立 造模参照文献[7]中描述的方法进行。大鼠称重,3%戊巴比妥钠30 mg/kg麻醉,无菌条件下,在颈部皮肤切4~5 mm垂直切口,暴露气管,模型组、芪参合剂组及TAK242组大鼠用1 ml注射器吸取0.1 ml细菌悬液进行气管内注射,空白组注射0.1 ml生理盐水。缝合皮肤,接种后将大鼠垂直放置,左右轻轻摇晃大鼠约30 s,以便菌液快速布散迁移至肺泡。将其置于温和光控鼠笼[(20±2)℃,12 h光/暗循环]中,允许其自由进食饮水。
1.2.3分组及给药方法 将40只大鼠随机分为空白组、模型组、芪参合剂组和TAK242组,10只/组。空白组与模型组造模6 h后每日灌胃给予生理盐水0.2 ml/只,芪参合剂组造模6 h后以9.375 g/(kg·d)灌胃给予芪参合剂,TAK242组造模6 h后以3 mg/kg腹腔注射给予TAK242,1次/d,干预3 d后取材[8]。
1.2.4大鼠支气管肺泡灌洗液(bronchoalveolar lav-age fluid,BALF)炎症因子及血清生化指标检测 根据文献[9]方法略加调整收集BALF,获取的BALF于4℃、800 r/min离心10 min,收集上清液并分装,-80℃保存用于细胞因子检测,检测步骤严格按照ELISA试剂盒说明书进行。采用头皮针和无菌非抗凝采血管进行腹主动脉采血,针尖斜面向下,进针30°左右,朝向心端方向刺入腹主动脉采血,室温静置2 h,4 000 r/min离心10 min,轻轻吸取上层血清,分装,-80℃保存备用。ALT、AST、BUN、Cre试剂盒进行血液生化指标检测,操作方法严格遵循试剂盒说明书进行。
1.2.5qRT-PCR检测肺组织中TLR4、TRIF、MyD88、NF-κB p65 mRNA表达 3%戊巴比妥钠以30 mg/kg麻醉大鼠,腹主动脉取血致死后取肺组织。称取肺组织,100 mg/只,组织快速研磨机(60 Hz,120 s)匀浆。按照试剂盒说明书,采用 TRIzol法抽提总 RNA,NanoDrop 2000检测RNA样本浓度和纯度,逆转录合成cDNA。反转录条件为37℃ 15 min,85℃ 5 s。qRT-PCR过程使用ToYoBo公司的SYBR®Green Realtime PCR Master Mix试剂盒,所有操作严格按照试剂盒使用说明书进行,采用QuantStudioTMReal-Time PCR Software进行数据分析,溶解度曲线评估PCR引物的可靠性,2-ΔΔCt法计算目的基因相对于内参基因β-actin的倍数比较基因的相对表达差异。β-actin内参引物由上海品时绕生物科技有限设计合成;其余引物由上海闪晶分子生物科技有限公司设计合成,引物序列见表1。
1.2.6Western blot检测肺组织中TLR4、TRIF、MyD88蛋白表达 称取肺组织100 mg/只,试剂盒测定蛋白浓度,以60 μg/10 μl调整蛋白浓度,加入1×SDS-PAGE蛋白上样缓冲液,100℃水浴加热 10 min 进行蛋白变性后分装置于-80℃保存备用。

表1 目的基因引物序列
取等量蛋白进行 SDS-PAGE 电泳,300 mA 70 min冰上转膜, 5%脱脂牛奶-1‰TBST室温摇床封闭2 h,TBST室温摇床洗膜10 min×4次,加入一抗于4℃摇床孵育过夜。再次洗膜后与相应二抗室温摇床孵育1 h,再次洗膜3次后加Millipore显影液,LI-COR红外成像系统显影。以β-actin为内参,Image J软件计算目标蛋白带灰度值。
1.2.7免疫组化法检测肺组织中NF-κB p65蛋白表达 肺组织制作石蜡切片,脱水、微波抗原修复,PBS洗涤3次,滴加3%H2O2暗盒孵育30 min,PBS洗涤3次,滴加山羊血清室温封闭60 min,滴加相应一抗,4℃孵育过夜,PBS洗涤10 min×4次,滴加二抗,室温孵育60 min,PBS洗涤10 min×4次,DAB显色3~6 min,自来水冲洗,苏木素复染3 min,0.1%的HCl中分化数秒,自来水洗3次,氨水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片、烤片、显微镜镜检,图像采集分析。
1.2.8ELISA检测大鼠肺组织TNF-α、IL-6、MIP-2、CXCL1水平 准确称取肺组织100 mg/只,全自动样品快速研磨机获得组织匀浆,5 000 r/min离心5 min,上清用于TNF-α、IL-6、MIP-2、CXCL1的检测。所有细胞因子严格按照ELISA试剂盒说明书进行。

2 结果
2.1BALF炎症因子检测结果及血清生化指标检测结果 表2结果表明,与空白组相比,模型组大鼠BALF中TNF-α、IL-6水平明显升高,差异有统计学意义(P<0.01)。表3结果表明,与空白组相比,模型组大鼠肝肾功能均出现明显损伤,血清ALT、AST、BUN、Cre水平明显高于空白组,差异有统计学意义(P<0.01)。
2.2芪参合剂对大鼠肺组织TLR4通路基因mRNA表达的影响 与空白组相比,模型组、芪参合剂组和TAK242组大鼠肺组织TLR4、MyD88、TRIF、NF-κB p65 mRNA表达明显升高,差异具有统计学意义(P<0.01)。与模型组相比,芪参合剂组和TAK242组大鼠肺组织TLR4、MyD88、TRIF、NF-κB p65 mRNA表达均降低,差异具有统计学意义(P<0.01),见表4。
2.3芪参合剂对大鼠肺组织TLR4、TRIF、MyD88蛋白表达的影响 与空白组相比,模型组大鼠肺组织中TLR4、MyD88、TRIF蛋白表达明显升高,差异具有统计学意义(P<0.01),芪参合剂组和TAK242组与空白组相比,TLR4、MyD88、TRIF蛋白表达差异无统计学意义(P>0.05)。与模型组相比,芪参合剂组和TAK242组大鼠肺组织中TLR4、MyD88、TRIF蛋白表达均降低,差异具有统计学意义(P<0.01),见图1。
2.4芪参合剂对大鼠肺组织NF-κB p65蛋白表达的影响 空白组NF-κB p65显示弱阳性免疫反应,主要在胞浆中可见淡棕色较均匀的阳性染色,胞核中极少或无阳性染色。而模型组NF-κB p65呈强阳性反应,可见大量阳性细胞,胞浆和胞核中均可见明显的深棕黄色强阳性染色,表现出明显的细胞核异位,提示NF-κB p65蛋白已活化。芪参合剂组和TAK242组阳性染色强度较模型组明显减弱,但与空白组相比仍明显增强,可见部分核染呈棕黄色的细胞,且染色不均匀,见图2。
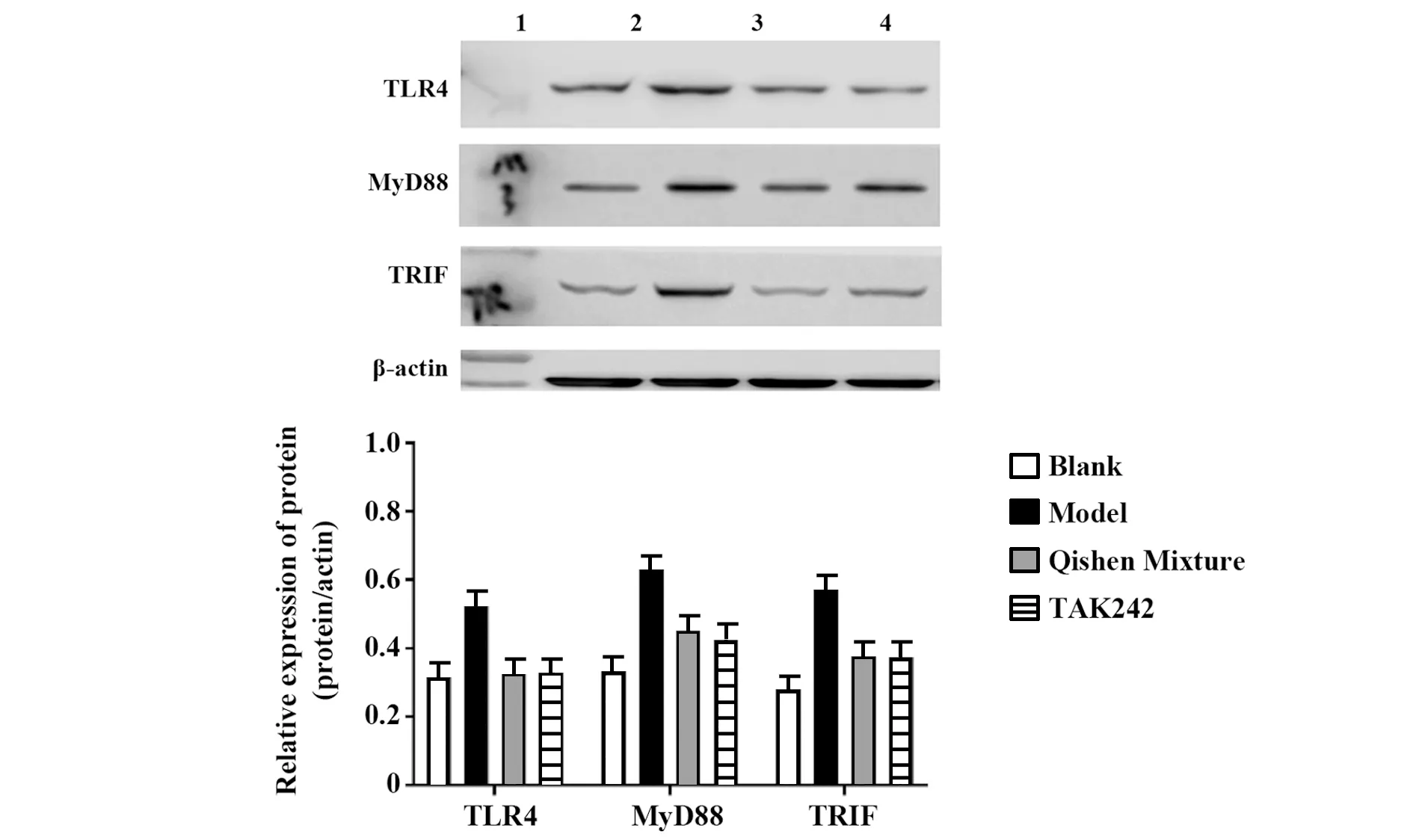
图1 大鼠肺组织TLR4、TRIF、MyD88 Western Blot结果Fig.1 Results of TLR4,TRIF,MyD88 Western blot in lung tissue of ratsNote:1.Blank group;2.Model group;3.Qishen mixture group;4.TAK242 group.
表2 大鼠BALF中TNF-α、IL-6水平比较
2.5芪参合剂对大鼠肺组织细胞因子水平的影响 与空白组相比,模型组、芪参合剂组和TAK242组大鼠肺组织中TNF-α、IL-6、MIP-2、CXCL1水平明显升高,差异具有统计学意义(P<0.01)。与模型组相比,芪参合剂组和TAK242组大鼠肺组织中TNF-α、IL-6、MIP-2、CXCL1水平明显降低,差异具有统计学意义(P<0.01),见表5。
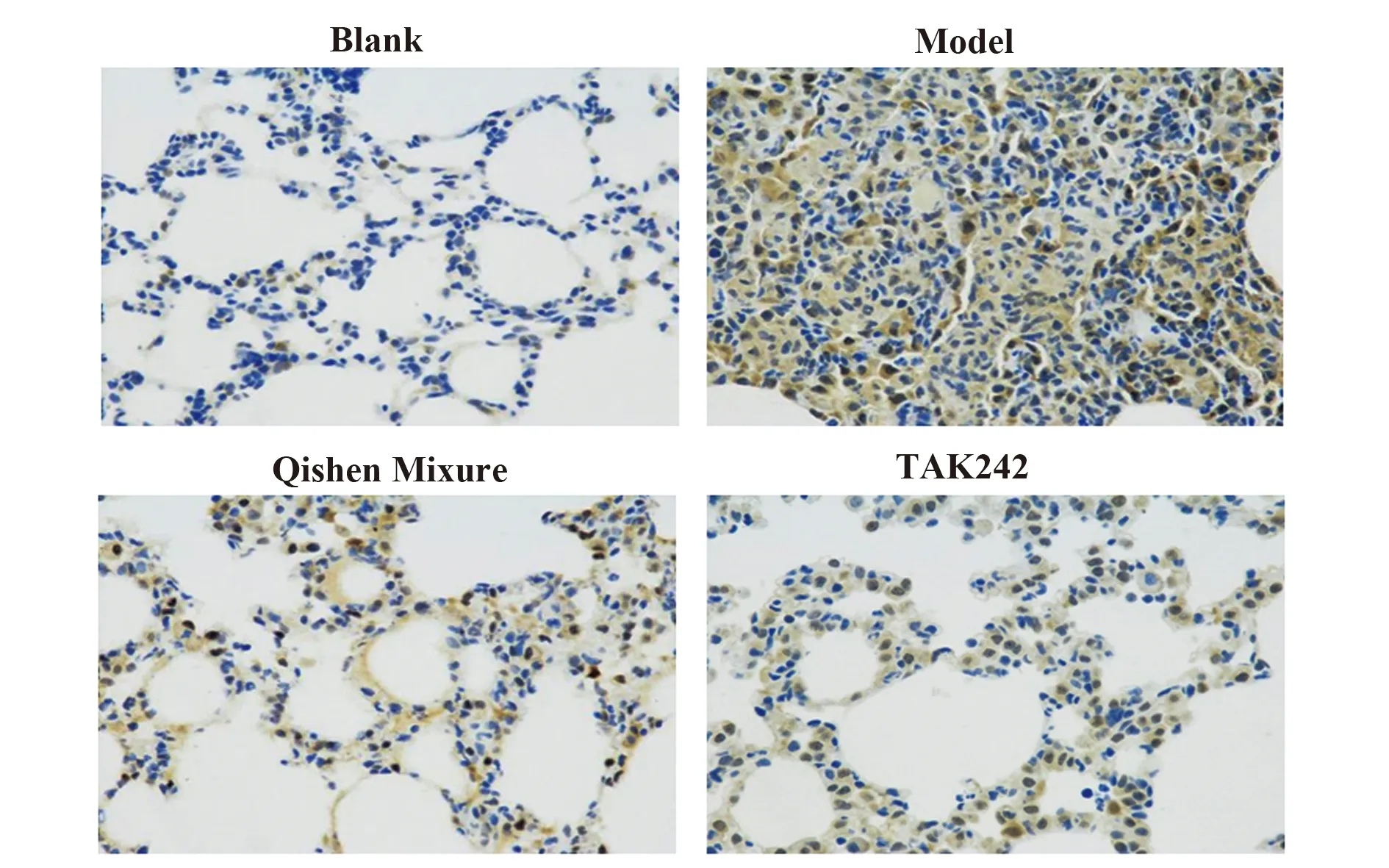
图2 大鼠肺组织NF-κB p65免疫组化结果(DAB显色,×400)Fig.2 Immunohistochemical results of NF-κB p65 in lung tissue of rats (DAB coloring,×400)
表3 大鼠血清生化指标比较
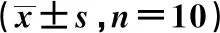
表4 大鼠肺组织TLR4、TRIF、MyD88、NF-κB p65 mRNA表达比较
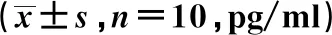
表5 大鼠肺组织TNF-α、IL-6、MIP-2、CXCL1水平比较
3 讨论
炎症和免疫反应是脓毒症的重要特征,在组织损伤、多系统器官功能衰竭和脓毒症死亡的发病机制中发挥重要作用[10]。TLR4对病原体的快速识别在引起脓毒症患者固有免疫应答中发挥关键作用[11]。LPS、TLR4信号转导促使促炎细胞因子家族大量合成和释放,其中TNF-α和IL-6最为显著。趋化因子CXCL1和MIP-2也可通过MyD88依赖性途径合成,MIP-2还可由TRIF依赖性途径直接合成,TLR4通过MyD88依赖性和TRIF依赖性2种途径确保免疫细胞产生高水平的CXCL1和MIP-2,导致强烈的嗜中性粒细胞募集反应,在宿主固有免疫防御微生物感染中至关重要[12]。虽然由细菌引发的炎症反应对于根除细菌病原体是必需的,但过度的炎症反应对宿主有害,会造成严重的组织损伤。因此,抑制TLR4通路的过度激活、保证有效的固有免疫反应对脓毒症治疗可能具有决定性优势。
TAK242是一种环己烯衍生物,是TLR4信号的小分子抑制剂,可以选择性地与TLR4的TIR结构域中的Cys747结合,通过破坏TLR4与其接头分子相互作用抑制TLR4信号转导[13]。目前已明确TAK242可减少多种炎症介质,如NO、TNF-α、IL-1、IL-6、IL-10、IL-1β、MIP-2等的产生以及降低LPS攻击后小鼠的致死率[14-15]。此外,TAK242还可有效地减弱肺中嗜中性粒细胞的激活和积聚,并抑制LPS攻击诱导的NF-κB的DNA结合活性[16]。TAK242还可显著抑制肺组织中TLR4、MyD88的表达和NF-κB的活化[17]。另外,TAK242作为治疗脓毒症的潜在药物已被证明在人体内是安全的[13]。本实验所用芪参合剂组成为生黄芪、炙黄芪、丹参和川芎,方中黄芪能增强和调节机体免疫力,对宿主固有免疫和特异性免疫均有调节作用,可提高机体的抗病能力,且有实验证实黄芪注射液可通过改善脓毒症患者的免疫失衡状态改善脓毒症患者的预后[18-19]。现代药理学研究发现,丹参具有扩张血管、改善微循环、调节宿主免疫功能的作用[20-21]。另外研究证实川芎可通过增强巨噬细胞吞噬功能调节宿主固有免疫[22]。
由于TAK242是TLR4介导的信号转导通路的特异性抑制剂,TAK242抑制LPS诱导的炎症反应可通过TLR4介导的信号转导途径发挥作用,故以TAK242和芪参合剂对脓毒症大鼠进行干预来进一步探索芪参合剂固有免疫调节作用的分子机制。本研究结果表明,模型组大鼠BALF中观察到较高水平的炎症细胞因子,主要脏器功能亦出现明显损害,表现为血清ALT、AST、BUN、Cre水平明显高于空白组,以上结果证实脓毒症大鼠造模成功,为研究耐药菌脓毒症新的治疗方案提供实验基础。本研究中qRT-PCR结果显示,耐药K.p脓毒症模型组大鼠肺组织TLR4、MyD88、TRIF、NF-κB p65 mRNA水平明显升高。Western blot结果显示耐药K.p脓毒症模型组大鼠肺组织TLR4、MyD88、TRIF蛋白表达明显增高;免疫组化结果显示NF-κB p65蛋白水平明显升高且核易位明显,和基因水平变化一致。ELISA结果显示,耐药K.p脓毒症模型组大鼠肺组织细胞因子TNF-α、IL-6、CXCL1、MIP-2水平明显升高。在芪参合剂和TAK242干预后,代表TLR4通路活化相关的蛋白表达和基因转录水平均降低,肺组织中炎症因子TNF-α、IL-6、CXCL1、MIP-2水平亦明显降低,推测芪参合剂可能主要通过抑制TLR4/MyD88/NF-κB和TLR4/TRIF/NF-κB信号通路的活化发挥对K.p脓毒症大鼠的固有免疫调节作用,并减少炎症因子释放,使耐药K.p入侵机体后能发挥有效的固有免疫反应以应对耐药K.p感染,减轻脓毒症患者器官功能损伤,治疗脓毒症。
