柠檬酸钠对肾缺血再灌注损伤模型小鼠肾损伤指标及炎症细胞因子的影响①
2021-02-23武汉市中西医结合医院暨湖北省武汉市第一医院武汉430022
汪 泉 刘 红 (武汉市中西医结合医院暨湖北省武汉市第一医院,武汉 430022)
肾缺血再灌注损伤(ischemia-reperfusion injury,IRI)是一种由适应性免疫和固有免疫共同介导的炎症疾病[1]。IRI的发病机制与细胞凋亡、炎症、坏死、氧化应激等有关,但确切的机制仍不清楚。据报道,由免疫失调引起的炎症可导致肾功能衰竭患者的死亡率显著升高[2]。IRI常见于创伤、休克、移植、肾切除等方面。虽然缺血后再灌注通常有助于恢复由缺血引起的器官功能障碍,但在某些情况下,再灌注可加剧与缺血相关的损伤。最近的研究表明,肾病患者的炎症细胞因子如IL-6、IL-17、IL-10、TGF-β等与病情进展密切相关[3]。上述细胞因子主要由Th17和Treg细胞分泌并调节肾功能衰竭中的免疫激活,但其具体机制及药物干扰作用仍不明确[4]。柠檬酸钠也称枸橼酸钠,是人体的主要中间代谢产物,在代谢和其他细胞过程中起着重要作用。柠檬酸钠结合钙并抑制钙晶体的成核和生长[5]。一项动物实验报道,柠檬酸钠可改善小鼠的肾损伤[6]。目前,柠檬酸钠通常被用作慢性肾衰竭患者血液透析中的抗凝血剂,并且用柠檬酸钠抗凝透析液可以抑制慢性肾衰竭患者的免疫功能障碍[7]。然而,柠檬酸钠在IRI方面的作用仍不明确。本研究建立了IRI小鼠模型,用不同剂量的柠檬酸钠处理IRI模型小鼠,以期探讨柠檬酸钠对IRI小鼠的肾损伤指标及炎症细胞因子的影响及其潜在机制。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级健康雄性C57BL/6小鼠购自徐州医学院实验动物中心,共40只,8~10周龄。随机分为4组:假手术组(Sham)、模型组(Model)、低剂量组(Low dose)和高剂量组(High dose),每组10只。所有小鼠在22~24℃实验室中适应性饲养1周,光照条件为12-12 h光-暗循环,其间提供标准小鼠食物。本研究已获得动物护理和使用委员会批准。
1.1.2试剂 将柠檬酸钠(陕西圣瑞医药科技有限公司);IL-6、IL-17、IL-10和TGF-β ELISA试剂盒(美国R&D公司);中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NAGL)ELISA试剂盒(Bioporto Diagnostics公司);大鼠CD4+分离试剂盒、CD4+CD25+Treg细胞分离试剂盒(德国美天旎生物技术有限公司);抗IFN-γ(2 μg/ml)、抗IL-4(2 μg/ml)、转化生长因子-β(TGF-β,2 ng/ml)、IL-23(20 ng/ml)和IL-6(20 ng/ml)(美国eBioscience公司);MTT(Sigma)。
1.2方法
1.2.1IRI小鼠模型的建立 用50 mg/kg戊巴比妥钠腹膜内麻醉小鼠。于小鼠腹正中做2 cm切口,充分暴露双侧肾蒂,无创动脉夹夹闭双侧肾蒂,可见小鼠肾脏从鲜红色逐渐变为紫黑色,缺血30 min左右时松开动脉夹恢复灌注,小鼠肾脏由暗红色变为鲜红色表明建模成功,丝线缝合切口。假手术组小鼠仅暴露双侧肾脏后关闭切口,不进行缺血再灌注程序。术后所有小鼠自由摄水和食物。
1.2.2柠檬酸钠处理 将柠檬酸钠溶解在蒸馏水中,术前7 d每天对小鼠进行柠檬酸钠溶液灌胃,低剂量组小鼠按照200 mg/kg的剂量对小鼠进行灌胃,高剂量组小鼠按照600 mg/kg的剂量对小鼠进行灌胃。假手术组和模型组小鼠灌胃等体积蒸馏水。
1.2.3样品收集 在实验结束时,将小鼠单独放置在代谢笼中,从每只小鼠的心脏收集血样用于测试血尿素氮(BUN)和血清肌酸酐(Scr)。在各组小鼠给药24 h后对所有动物实施安乐死,将小鼠肾脏快速取出并置于4℃冰箱保存。
1.2.4组织病理检查 将各组小鼠一部分肾组织固定在4%多聚甲醛中,石蜡包埋,并切成2~3 μm切片。然后用HE染色,光学显微镜下观察各组小鼠的肾脏组织病理学变化。
1.2.5ELISA测定 按照说明书,采用IL-6、IL-17、IL-10和TGF-β ELISA试剂盒测定各肾组织样品中细胞因子浓度。用ELISA试剂盒测定血液样本中NAGL的浓度。实验结束后,使用Microplate Reader测定450 nm处光密度(OD),并根据标准品计算样品浓度。
1.2.6细胞分离 为分离Treg和Th17细胞,将小鼠脾脏切成碎片并研磨,过200目钢筛。将脾脏在4℃下2 000 r/min离心,PBS洗涤3次。然后加入小鼠淋巴细胞分离培养基,并将混合物以2 000 r/min离心30 min。样品用PBS洗涤3次并制备脾细胞悬液。使用大鼠CD4+CD25+Treg细胞分离试剂盒按照制造商说明从脾细胞中分离出Treg细胞,流式细胞仪进行分析。使用大鼠CD4+分离试剂盒分离CD4+T细胞。分离的CD4+T细胞在Th17细胞极化条件下刺激3 d,如下:抗IFN-γ(2 μg/ml)、抗IL-4(2 μg/ml)、转化生长因子-β(TGF-β,2 ng/ml)、IL-23(20 ng/ml)和IL-6(20 ng/ml)。使用流式细胞仪检测分离的Th17细胞。该细胞分离方法不会破坏细胞活性。
1.2.7细胞活力测定 通过MTT测定法评估Treg和Th17细胞的生长和活力。将分离的细胞加入含有10% MTT的生长培养基中,并将细胞接种在96孔板中,于37℃、5%CO2环境中过夜培养。DMSO溶解甲瓒晶体,并在490 nm处测定OD值。
2 结果
2.1柠檬酸钠可显著抑制IRI小鼠BUN、Scr和NGAL表达 如图1所示,与假手术组相比,模型组小鼠的血浆BUN和Scr水平显著升高,表示小鼠发生IRI,而柠檬酸钠预处理可明显抑制BUN和Scr水平的升高。另外,与低剂量柠檬酸钠处理组相比,高剂量组小鼠血浆BUN和Scr水平显著降低。模型组小鼠血浆NGAL含量显著升高,而经柠檬酸钠预处理后显著降低。
2.2柠檬酸钠对小鼠组织病理改变的影响 HE染色结果显示,假手术组小鼠的肾组织形态正常,肾小管上皮细胞结构清晰,肾间质无充血水肿(图2)。模型组小鼠的肾组织损伤明显加重,肾小管上皮细胞肿胀,空泡变性,肾小管管腔明显扩张和阻塞,肾间质充血水肿,出现炎症细胞浸润。而经低剂量和高剂量的柠檬酸钠处理后,肾小管管腔扩张情况明显改善,肾间质出血水肿情况减少,炎症细胞浸润明显减轻,上皮细胞空泡、脱落情况减少。

图1 不同组小鼠血浆BUN、Scr和NGAL浓度Fig.1 Concentrations of blood BUN,Scr,and NGAL in different groups of miceNote:The different letters "a,b,c,d" indicate significant differences between groups (P<0.05),the same below.

图2 各组小鼠肾脏组织病理变化(HE染色)Fig.2 Histopathological changes of kidneys of mice in each group (HE staining)
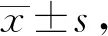
2.3柠檬酸对IRI小鼠炎症细胞因子的影响 ELISA法检测小鼠肾组织的IL-6和IL-17水平,结果显示:模型组小鼠IL-6和IL-17水平显著高于假手术组,柠檬酸钠处理后显著降低(图3)。ELISA法检测细胞因子IL-10和TGF-β的水平,结果显示,与假手术组相比,模型组小鼠IL-10和TGF-β的水平显著降低,而柠檬酸钠预处理后其水平明显升高(图4)。
2.4柠檬酸钠显著降低IRI小鼠Th17细胞并增强Treg细胞活力 MTT法检测不同组小鼠Th17和Treg细胞的活力, 结果表明: 与假手术组相比,模型组小鼠Th17细胞的存活率显著提高,柠檬酸钠预处理显著降低Th17细胞存活率(图5)。另外,与低剂量治疗组相比,高剂量柠檬酸钠对Th17细胞的存活率具有更大的抑制作用。然而,模型组小鼠的Treg细胞活力显著降低,而柠檬酸钠预处理可以剂量依赖方式提高Treg存活率。
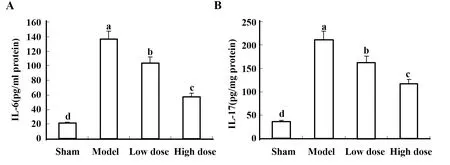
图3 不同组小鼠肾组织中IL-6和IL-17的表达水平Fig.3 Expression levels of IL-6 and IL-17 in kidney tissues of different groups of mice
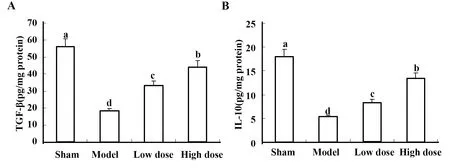
图4 不同组小鼠肾组织中TGF-β和IL-10的表达水平Fig.4 Expression levels of TGF-β and IL-10 in kidney tissues of different groups of mice
图5 MTT法测定不同组小鼠Th17和Treg细胞的活力Fig.5 MTT assay for Th17 and Treg cell viability in different groups of mice
3 讨论
免疫失调参与急慢性肾损伤等多种疾病的发生发展,CD4+T细胞是适应性免疫系统中最重要的因素,其在宿主防御和免疫稳态维持中至关重要[8]。CD4+T细胞可分化成一系列细胞亚群,包括Th1、Th2、Th17和Treg细胞等[9]。其他研究显示,Th17和Treg细胞活力及其细胞因子的分泌在IRI患者中异常,并且与各种肾脏疾病的进展密切相关[10]。柠檬酸钠通常用作抗凝剂来纠正血液透析中血液或尿液的pH值,既往研究表明,柠檬酸钠对慢性肾病有积极的治疗作用,柠檬酸钠抗凝可抑制慢性肾衰竭患者的免疫功能障碍[7]。本研究探讨了柠檬酸钠对IRI模型小鼠肾损伤指标及炎症细胞因子的影响及其作用机制。既往研究显示,BUN和Scr水平在肾衰竭及其他肾脏疾病中明显升高[11]。本研究中观察到了相同的结果,表明模型组小鼠肾损害程度明显提高。此外,柠檬酸钠处理以剂量依赖性方式降低了BUN和Scr的水平,表明柠檬酸钠可能具有改善肾损伤的作用。据报道,NGAL是一种肾小管损伤标志物,通常是急性肾功能衰竭的敏感标志物,并且其水平在IRI患者中明显提高[12-13]。本研究发现,NGAL的含量在模型组中显著增加,在柠檬酸钠预处理组中显著降低,表明柠檬酸钠预处理可有效缓解小鼠的肾功能障碍。
Th17和Treg细胞都与自身免疫疾病和炎症进展有关。Th17和Treg细胞之间的平衡影响疾病的进展。如果平衡从Treg细胞向Th17细胞移动,即Th17/Treg细胞比率升高,则疾病的严重程度会显著升高。Th17细胞通过分泌IL-6和IL-17而发挥促炎作用[14]。而Treg细胞通过分泌TGF-β和IL-10在抑制炎症过程中起关键作用[15]。本研究结果显示,柠檬酸钠预处理显著抑制肾组织中Th17细胞因子IL-6和IL-17的水平。并且,与模型组小鼠相比,柠檬酸钠预处理可显著升高Treg细胞因子IL-10和TGF-β的表达水平。这些结果进一步证实柠檬酸钠可调节IRI小鼠中Th17和Treg的细胞因子表达。
Th17细胞在炎症和组织损伤中发挥重要作用,并参与肾炎、肾小球肾炎和其他肾脏疾病的发生发展[16]。而Treg细胞是一类控制体内自身免疫反应性的T细胞亚群,具有预防多种肾病的作用[17]。本研究中,模型组小鼠Th17细胞活力显著增强,而经柠檬酸钠预处理则可显著降低Th17细胞活力。模型组小鼠Treg细胞活力显著降低,柠檬酸预处理则可显著提高Treg细胞活力。 这些发现证实Th17和Treg细胞的失调与肾损伤程度一致,并且可以通过柠檬酸钠预处理来缓解小鼠的肾损伤。
总之,本研究表明柠檬酸钠通过抑制Th17细胞因子IL-6和IL-17的水平并升高Treg细胞因子IL-10和TGF-β水平来抑制炎症反应,并通过降低Th17细胞并增加Treg细胞活力来缓解小鼠肾缺血再灌注损伤,并且其改善作用呈剂量依赖性方式。因此,柠檬酸钠有望成为肾缺血再灌注损伤等相关肾脏疾病治疗的候选药物。
