尾静脉注射AMPKα 1高表达腺病毒对抑郁症模型大鼠线粒体损伤和代谢的调节作用①
2021-02-23闫海清王桂华王昊亮郭振方宋景贵
闫海清 张 平 王桂华 王昊亮 郭振方 宋景贵
(新乡医学院第一附属医院,卫辉 453100)
抑郁症是一种以显著而持久的情绪低落、快感缺失和行为迟缓为主要临床特征的精神性疾病。目前,全球抑郁症发病率约为10%,且逐年升高,并可能上升为世界第二大疾病,自杀身亡率约为15%,严重威胁患者身心健康和社会团结稳定[1-2]。慢性不可预见性温和刺激动物抑郁症与人类抑郁症病因相似,是一种广泛使用和经过充分验证、并得到国际认可的抑郁症动物造模方法[3]。研究表明,氧化应激是抑郁症神经细胞凋亡、神经退行性改变、神经元可塑性改变的重要原因,氧化应激损害在抑郁症发病过程中起关键作用[4]。抑郁症患者糖代谢异常发生率高达36%,已有研究证明抑郁症与糖代谢异常存在共同的神经内分泌基础,两者互为诱因[5-6]。抑郁症模型中腺苷酸活化蛋白激酶α1(AMP activated protein kinaseα1,AMPKα1)表达明显下调,但AMPKα1高表达对抑郁症的作用及机制尚不清楚[7]。AMPKα1是细胞能量代谢的主要感受器,在维持机体能量代谢平衡中发挥重要作用,已有研究表明其与炎症反应、糖类代谢、脂肪分解和细胞凋亡等生命活动相关[8]。本文研究尾静脉注射AMPKα1高表达腺病毒对抑郁症模型大鼠线粒体损伤和代谢的调节作用,以期为抑郁症的预防和治疗提供参考。
1 材料与方法
1.1材料
1.1.1实验动物 60只Wistar封闭群大鼠购自成都达硕实验动物有限公司。
1.1.2试剂 AMPKα1高表达腺病毒购自上海生工;SOD、MDA和LDH试剂盒购自上海酶联生物;BCA试剂盒购自北京天根生化有限公司。
1.2方法
1.2.1分组、造模及处理 Wistar封闭群大鼠随机分为4组:健康对照组(Control)、模型组(CUMS)、空载体组(CUMS+Ad-NC)和AMPKα1高表达组(CUMS+Ad-AMPKα1),每组15只。除Control组外,其他各组大鼠均采用不可预见温和应激法建立抑郁症模型:随机禁食或禁水 24 h、4℃冷水游泳、昼夜颠倒24 h、夹尾1 min、50 V电击3 min、潮湿垫料 24 h、噪音 2 h,每天随机安排1~2种刺激,同一刺激不可连续出现,孤笼饲养28 d。CUMS+Ad-NC组尾静脉注射腺病毒空载体,CUMS+Ad-AMPKα1组尾静脉注射AMPKα1高表达腺病毒[9-10]。
1.2.2RT-PCR检测mRNA表达 RT-PCR提取总RNA,反转录为cDNA,以β-actin为内参,反应条件为:95℃预变性2 min,95℃变性15 s,64℃退火 30 s,72℃延伸30 s,共40个循环。PGC-1α F:5′-TGCCACCATCAAAGAAGC-3′; PGC-1α R:5′-TCACCAAACAGAAGCAGACT-3′; GLUT4 F:5′-CCCACAGAAGGTGATTGAACAG-3′;GLUT4 R:5′-GATGGCCAGTTGGTTGAGTG-3′。
1.2.3Western blot检测蛋白表达 取组织加入RIPA裂解提取蛋白,BCA试剂盒测定蛋白含量;取30 μl 蛋白电泳分离,转至PVDF膜,脱脂奶粉封闭1 h ;加入对应一抗,4℃孵育过夜;加入二抗孵育4 h,TBST液清洗;ECL显影,以β-actin为内参计算蛋白相对表达。
1.2.4Morris水迷宫实验检测大鼠学习记忆能力 造模第22天将大鼠面向池壁放入水中,记录动物找到水下平台的时间,即为逃避潜伏期时间。若超过 1 min 则引导大鼠找到平台。让大鼠在平台上停留10 s,早晚各1次,持续6 d。在应激造模第28天撤去平台,将大鼠面向池壁放入水中,记录大鼠60 s 内在原平台所在象限停留时间,即为目标象限记忆时间[11]。
1.2.5旷场实验检测大鼠自主探究行为 将大鼠放入底部有25个4 cm×4 cm的黑色旷场反应箱,让其自由活动1 min 后,记录大鼠4 min内的水平活动次数和垂直站立次数。
1.2.6HE染色检测大鼠脑损伤情况 将组织用甲醛固定、石蜡包埋后切片;HE染色后脱水,中性树胶封片,光学显微镜下观察。
1.2.7氧化应激检测 将组织加入生理盐水匀浆离心后,按SOD、MDA和 LDH试剂盒说明书分别测定SOD、MDA、和LDH含量。

2 结果
2.1AMPKα1高表达腺病毒促进抑郁症模型大鼠AMPKα1表达 与Control组相比,CUMS组大鼠AMPKα1 mRNA及蛋白表达显著下调,说明抑郁症抑制大鼠AMPKα1呈低表达;与CUMS组相比,CUMS+Ad-NC组AMPKα1 mRNA、蛋白表达变化无统计学意义,说明空载体不影响抑郁症大鼠AMPKα1表达;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠AMPKα1 mRNA、蛋白表达显著上调,说明AMPKα1高表达腺病毒可促进抑郁症大鼠AMPKα1表达(P<0.01,图1A)。
2.2AMPKα1高表达腺病毒改善抑郁症大鼠学习记忆能力 与Control组相比,CUMS组大鼠逃避潜伏期时间显著延长,目标象限记忆时间显著缩短,说明抑郁症抑制大鼠记忆力严重受损;与CUMS组相比,CUMS+Ad-NC组大鼠逃避潜伏期时间和目标象限记忆时间变化无统计学意义,说明空载体对抑郁症大鼠记忆力无影响;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠逃避潜伏期时间显著缩短,目标象限记忆时间显著增加,说明AMPKα1高表达腺病毒可改善抑郁症大鼠的学习记忆能力(P<0.01,图1B)。
2.3AMPKα1高表达腺病毒促进抑郁症大鼠自主探究行为 与Control组相比,CUMS组大鼠水平活动次数和垂直站立次数显著减少,说明抑郁症可抑制大鼠自主探究行为;与CUMS组相比,CUMS+Ad-NC组大鼠水平活动次数和垂直站立次数差异无统计学意义,说明空载体对抑郁症大鼠自主探究行为无影响;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠水平活动次数和垂直站立次数显著增加,说明AMPKα1高表达腺病毒能可促进抑郁症大鼠的自主探究行为(P<0.01,图1C)。
2.4AMPKα1高表达腺病毒减轻抑郁症大鼠脑损伤 Control组大鼠大脑海马和前额叶皮质神经元形态规则,结构完整,细胞间隙正常,排列整齐有序;CUMS组大鼠细胞排列散乱,神经元缺失明显,胞核染色较深,部分胞体呈空泡状;CUMS+Ad-NC组与CUMS组组织形态相似;CUMS+Ad-AMPKα1组神经元结构基本正常,细胞间隙缩小,损伤情况得到明显缓解(图2)。
2.5AMPKα1高表达腺病毒减轻抑郁症大鼠细胞线粒体损伤 与Control组相比,CUMS组大鼠Bcl-2蛋白表达显著下调,Bax、Caspase-3和Caspase-9蛋白表达显著上调,说明抑郁症大鼠线粒体明显损伤;与CUMS组相比,CUMS+Ad-NC组大鼠Bcl-2、Bax、Caspase-3和Caspase-9蛋白表达变化无统计学意义,说明空载体不影响抑郁症大鼠线粒体损伤;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠Bcl-2蛋白表达显著上调,Bax、Caspase-3和Caspase-9蛋白表达显著下调,说明AMPKα1高表达腺病毒减轻抑郁症大鼠线粒体损伤(P<0.01,图3)。
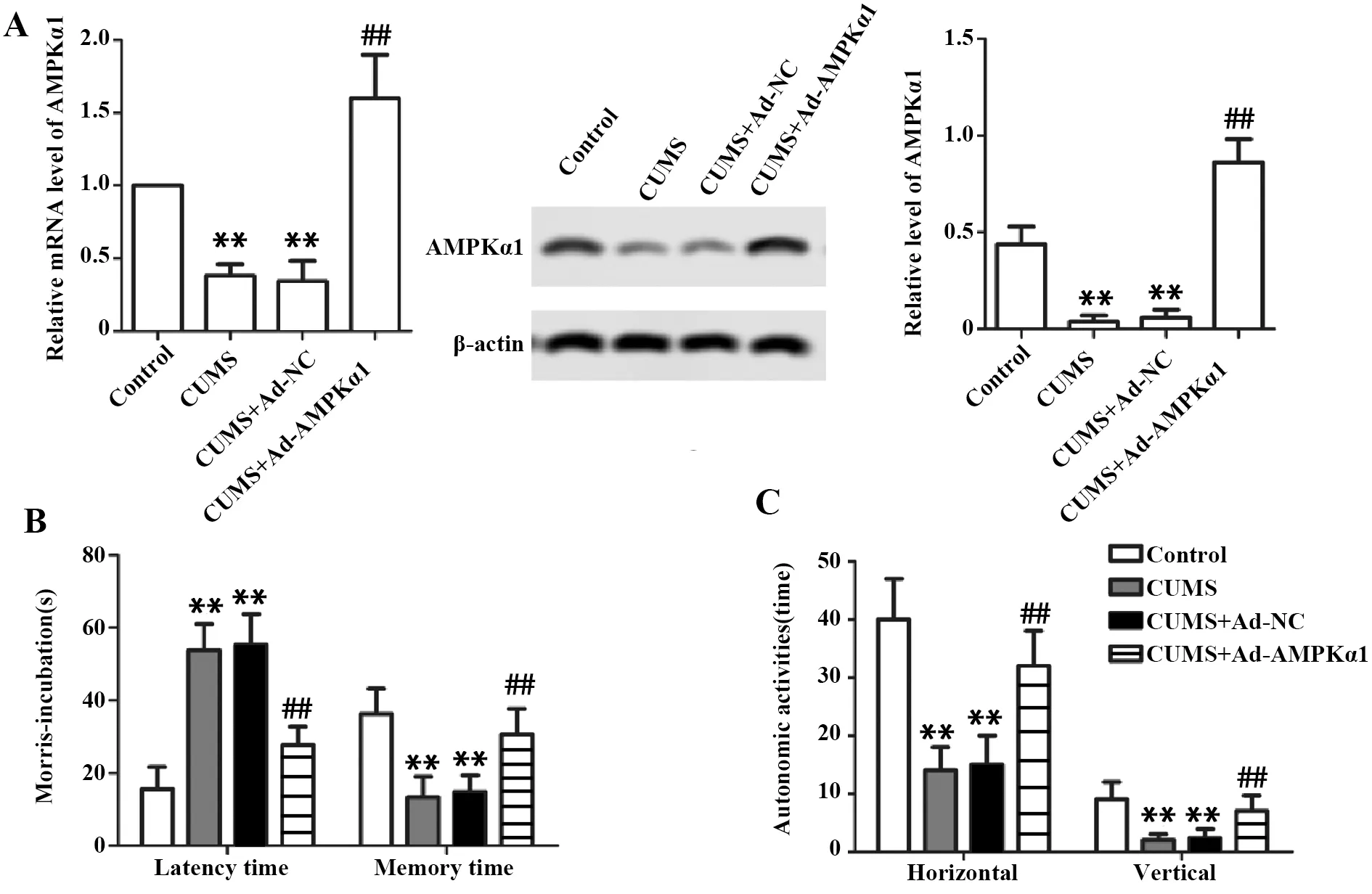
图1 抑郁症大鼠AMPKα1表达、记忆力和自主探究行为Fig.1 AMPKα1 expression,memory and self-exploration behavior in rats with depressionNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
2.6AMPKα1高表达腺病毒抑制抑郁症大鼠细胞氧化应激 如图4所示, 与Control组相比, CUMS组SOD含量显著下降,LDH和MDA含量显著上升,说明抑郁症引起大鼠氧化应激;与CUMS组相比,CUMS+Ad-NC组大鼠LDH、SOD和MDA含量变化无统计学意义,说明空载体不影响抑郁症大鼠氧化应激;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠SOD含量显著增多,LDH和MDA含量显著减少,说明AMPKα1高表达腺病毒可减轻抑郁症大鼠氧化应激(P<0.01)。
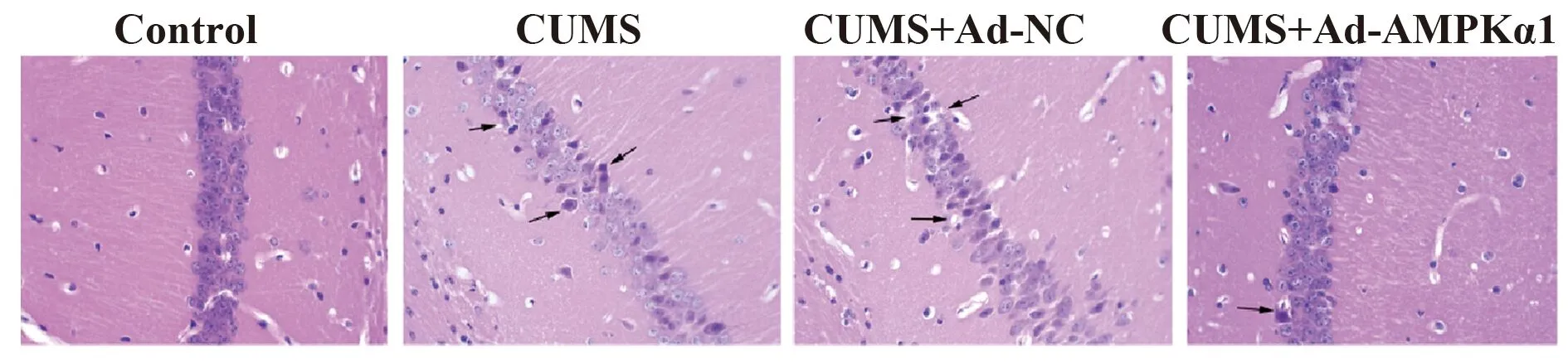
图2 大鼠海马区HE染色(×200)Fig.2 HE staining of rats hippocampus(×200)
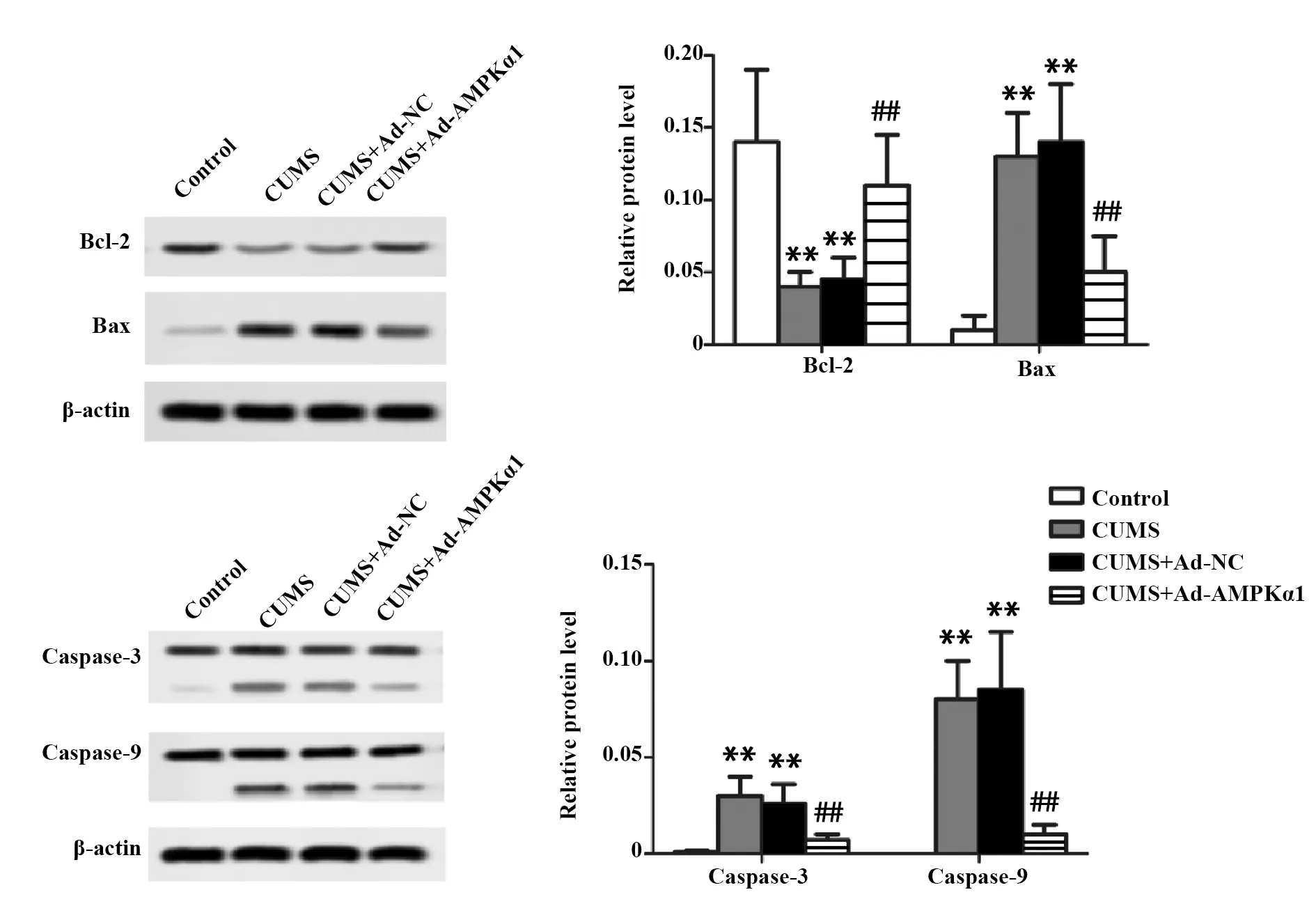
图3 线粒体损伤程度Fig.3 Degree of mitochondrial damageNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
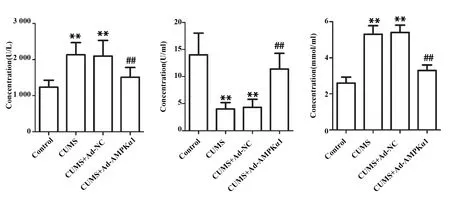
图4 试剂盒检测LDH、SOD和MDA含量Fig.4 LDH,SOD and MDA contents were detected by kitNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
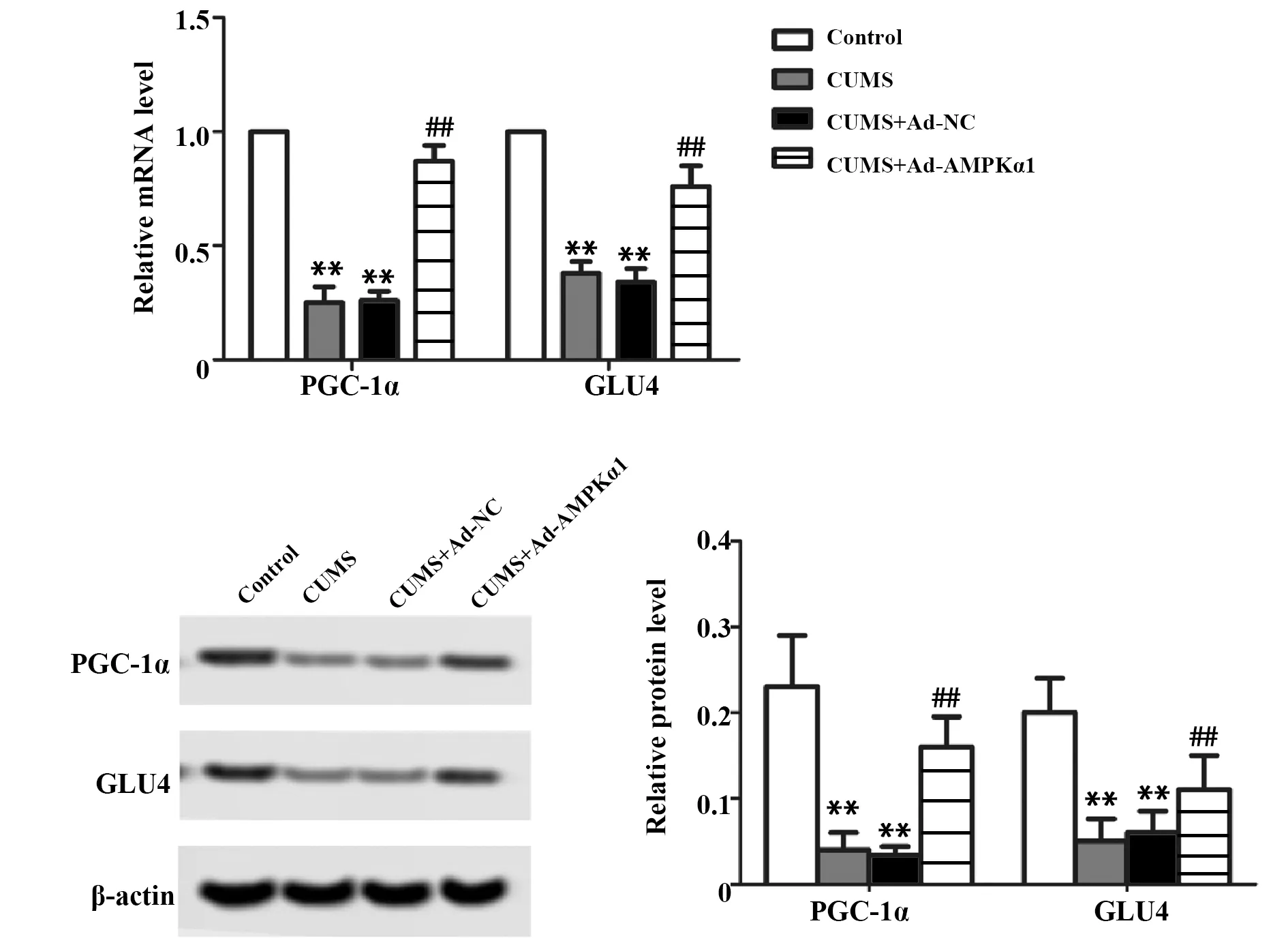
图5 各组大鼠的糖代谢检测Fig.5 Glucose metabolism in rats of each groupNote:Compared with control group,**.P<0.01;compared with CUMS+Ad-NC group,##.P<0.01.
2.7AMPKα1高表达腺病毒增强抑郁症大鼠细胞糖代谢 与Control组相比,CUMS组大鼠PGC-1α和GLUT4 mRNA、蛋白表达显著下调,说明抑郁症抑制大鼠糖代谢;与CUMS组相比,CUMS+Ad-NC组大鼠PGC-1α和GLUT4 mRNA、表达变化无统计学意义,说明空载体不影响抑郁症大鼠糖代谢;与CUMS+Ad-NC组相比,CUMS+Ad-AMPKα1组大鼠PGC-1α和GLUT4 mRNA、蛋白表达显著上调,说明AMPKα1高表达腺病毒可增强抑郁症大鼠糖代谢(P<0.01,图5)。
3 讨论
抑郁症具有高患病率、高致残率和高自杀率等特点,是由社会环境、自身遗传、个体性格、生物化学等多种因素共同作用而产生的情绪低落、快感缺失、行为迟缓、学习记忆下降的精神疾病。因此,记忆能力和行为是抑郁症评价的重要指标之一。本研究通过Morris水迷宫实验和旷场实验发现,AMPKα1高表达腺病毒可显著减少抑郁症大鼠逃避潜伏期时间,显著增加抑郁症大鼠目标象限记忆时间、水平活动次数和垂直站立次数,说明AMPKα1高表达腺病毒可改善抑郁症大鼠学习记忆能力,并促进抑郁症大鼠自主探究行为。
海马和前额叶是大脑执行情绪和认知的关键区域,海马主要负责生物体的学习和记忆,前额叶皮质主要负责感觉认知、情绪调节和功能执行[12]。SHIRAYAMA等[13]研究发现海马和前额叶与抑郁症的发生密切相关,且重度抑郁症患者的海马和前额叶皮质区较健康志愿者体积明显减小。本文通过海马和前额叶皮质HE染色发现,AMPKα1高表达腺病毒可缓解抑郁症细胞排列散乱,神经元缺失和胞体空泡状等现象,从而缓解脑损伤。
线粒体是细胞有氧呼吸的主要场所,其产生的能量在维持细胞正常功能中发挥重要作用,一旦线粒体受损,则会干扰细胞的正常功能[14]。CZARNY等[15]研究发现,抑郁症会导致氧化应激和低效DNA损伤修复,进而导致线粒体功能障碍;GONG等[16]研究发现慢性轻度压力抑制小鼠海马、皮质和下丘脑中线粒体呼吸,并导致脑中线粒体超微结构受损,提示抑郁症可诱导线粒体受损。XU等[17]通过研究发现,小鼠胚胎成纤维细胞中AMPKα1缺陷可促进细胞增殖和线粒体损伤。因此,AMPKα1过表达有望减缓抑郁症引起的线粒体损伤。本研究发现AMPKα1高表达腺病毒可显著上调抑郁症大鼠Bcl-2蛋白表达,并显著下调抑郁症大鼠Bax、Caspase-3和Caspase-9蛋白表达,说明AMPKα1过表达腺病毒可减缓抑郁症引起的线粒体损伤。
氧化应激是自由基在体内失衡而产生的一种负面作用。VAVAKOVA等[18]研究发现氧化应激通过自由基、非自由基分子和活性氧等在重度抑郁症的病理生理学中起重要作用;MAURYA等[19]发现包括重度抑郁症在内的神经变性/神经精神病症的发病机理中起重要作用,因此,氧化应激在抑郁症发生中起关键作用。COLOMBO等[20]研究发现在人脐静脉内皮细胞中AMPKα1可调节其氧化应激能力。AMPKα1高表达有望调节抑郁症患者的氧化应激能力。本研究发现AMPKα1高表达上调抑郁症大鼠SOD含量,并下调抑郁症大鼠LDH和MDA含量,说明AMPKα1高表达腺病毒减轻抑郁症大鼠氧化应激。
生物体的精神状态和糖代谢水平密切相关[21]。夏青春等[22]研究发现抑郁症患者的空腹血糖和餐后2 h内血糖水平均显著高于健康对照组,且葡萄糖耐量异常发生率高于对照组。因此,抑郁症患者存在糖代谢异常。BODE等[2]研究发现AMPKα1过表达可显著降低糖尿病患者血糖浓度,AMPKα1过表达有望改善抑郁症大鼠细胞糖代谢异常。本研究发现AMPKα1高表达可上调PGC-1α和GLUT4表达,说明AMPKα1高表达腺病毒可改善抑郁症大鼠糖代谢。
综上所述,尾静脉注射AMPKα1高表达腺病毒可改善抑郁症模型大鼠学习记忆能力,促进自主探究行为,缓解脑损伤及线粒体损伤,减轻氧化应激,并改善糖代谢,从而缓解抑郁症,为抑郁症治疗提供新的治疗方案。
