植物-基质人工湿地系统净化Zn残留废水的实验研究
2021-02-23曹雯婕陈银萍柯昀琪李晓辉吴仁杰
曹雯婕,陈银萍,杨 波,柯昀琪,李晓辉,吴仁杰
(兰州交通大学 环境与市政工程学院,兰州 730070)
随着全球工业的飞速发展,重金属对水体的污染程度日益加重.传统的处理方法存在二次污染和成本高等缺陷[1].人工湿地是一种人工建造的安全高效的生态处理技术,植物和基质都是其重要组成部分.大量研究表明,基质在重金属去除中起主要作用.一方面,大部分重金属通过基质拦截过滤和生成氢氧化物沉淀等方式被去除;另一方面,基质为植物和微生物提供了良好的生长载体[2].虽然植物对去除重金属方面起的作用较小[3],但它同样重要,植物可以通过根系直接吸收重金属,同时植物根系产生的氧气促进了微生物的活性,植物根分泌的有机物为微生物的繁殖代谢提供了碳源,间接有助于重金属的分解去除[4].冯旭等[5]研究表明,回流立式组合人工湿地对多种重金属混合废水中Zn的平均去除率为51.92%.招文锐等[6]研究中,铅锌选矿废水经宽叶香蒲(TyphalatifoliaL.)人工湿地处理后Zn的净化率高达97.3%,因此,可以将人工湿地技术应用到含Zn废水的处理中.
当前人工湿地对有机废水脱氮除磷的研究较多[7],且主要集中于高效基质的选择[8],而对于植物-基质搭配构建的湿地系统对重金属的去除及植物-基质可能存在的协同作用鲜见报道.粉煤灰富含二氧化硅和氧化铝等物质,比表面积大,表面多孔,廉价易得,对废水中的Zn具有很强的去除能力[9],但大多数研究往往通过改性增强粉煤灰的吸附性能[10],极少研究其与植物的协同作用.水葫芦(Eichhorniacrassipes)[11]和灯芯草(Juncuseffusus)[12]对Zn均有很好的去除效果,谭彩云等[13]研究表明,水葫芦对Zn的净化吸收主要集中在前2天,认为水葫芦可以在较快的时间内完成Zn的净化,有助于缩短人工湿地的处理周期,提高净化效率.另外,湿地植物有利于系统的水力传输.有研究报道经3~5个月的进水处理后,与不种植物的对照组相比,种有灯芯草的湿地系统渗透能力好,废水渗入基质的速度很快[14].水芹菜(Oenanthejavanica)抗逆性强且耐低温[15],可以保证湿地系统冬季的平稳运行.研究表明不同生活型植物组合对污染物的处理效果优于单一植物[16].陈金发等[17]发现芦苇(Phragmitesaustralis(Cav.)Trin.exSteu)+水葫芦和灯芯草+水葫芦+菹草(Potamogetoncrispus)的这两个组合对污水中BOD、COD、氨氮以及Zn、Cu、Pb等具有良好的去除效果.因此,将粉煤灰、河沙及混合基质与灯芯草、水芹菜和水葫芦搭配构建成小型人工湿地系统,对比分析不同基质系统对废水中Zn的去除效果,探讨植物与基质间可能存在的交互作用,同时对比3种植物对Zn的吸收富集效果,以期为处理含Zn废水人工湿地的构建提供选材参考.
1 材料和方法
1.1 植物与基质的选择
实验植物选用灯芯草、水芹菜和水葫芦.人工湿地基质分3种:粉煤灰(H)、河砂(S)和体积比为1∶1的粉煤灰+河砂(S+H).3种植物购自兰州市某种植基地,粉煤灰购于兰州长盛源粉煤灰公司,河砂购自兰州市黄河河砂市场,土壤取自兰州市周边农田,基质的基本理化性质详见表1.
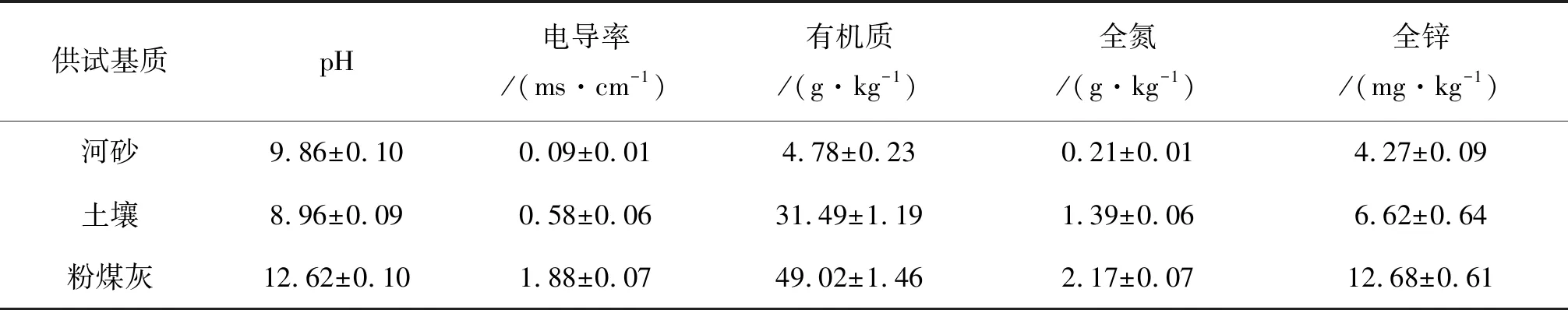
表1 供试基质的理化性质(平均数±SE)
1.2 模拟废水的配制
结合本课题组前期实验结果及其他研究[18],模拟废水中的Zn的浓度设为100 mg·L-1.将ZnCl2(分析纯)溶于去离子水中,配成100 mg·L-1的模拟含Zn废水,pH为7.0~7.3,电导率为0.020 6 ms·cm-1.
1.3 实验方法
1.3.1 实验装置
塑料水桶的规格为0.34 m×0.22 m×0.18 m(长×宽×高),最底层放置5 cm厚的砾石,砾石直径为3~5 cm,砾石上放置一层约100目的薄窗纱,防止上层基质下落阻塞砾石间隙;薄窗纱上放置约12 cm厚的湿地基质;最上层铺一层8 cm厚的土壤,土壤为过10目筛的均匀黄土,防止进水冲散基质和阳光直射粉煤灰.出水口位于装置底部,直径为1.00 cm,同时安装高位水箱用于进水(见图1).
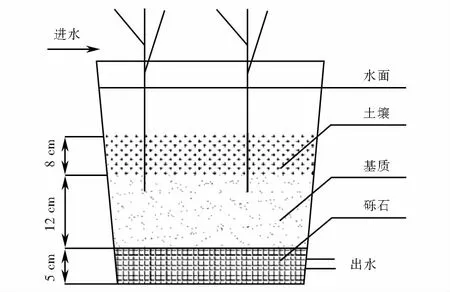
图1 实验装置示意图Fig.1 Schematic diagram of experimental equipment
1.3.2 实验运行
开始正式实验前先连续进清水一周,确保系统不漏水,同时实验组栽入数量相同,长势相近的3种植物,每个塑料箱内种2株水芹菜,2苗水葫芦,2簇
灯芯草(20株/簇),进行植物的稳定性培养,并设计空白对照组,实验重复3次,具体如下:
1) 实验组Ⅰ:栽入湿地植物,即系统S-Ⅰ、H-Ⅰ、S+H-Ⅰ;
2) 对照组Ⅱ:不种植物,即系统S-Ⅱ、H-Ⅱ、S+H-Ⅱ.
等到系统运行稳定后(7 d)加入模拟废水进行Zn的去除实验,进水Zn浓度为100 mg·L-1.第1天上午9:00进8 L废水,基质淹没高度约7 cm,待水质清澈后取水样做初始分析,第3天上午9:00放水,一部分直接测定pH和电导率,另一部分用于分析Zn浓度,取样后排尽桶中的水,重新进水,采用同样的方法,在第5、7、9、11和13天取水样进行分析,在13 d采集植物样品和基质进行测定,做3次重复.
1.3.3 实验装置运行后基质的性质
待湿地系统运行平稳,13 d后对基质的理化指标进行测定(见表2).
1.4 指标测定及方法
出水Zn浓度采用火焰原子吸收法,具体方法参照《水和废水监测分析方法》[19];基质含全Zn量参见彭菊的方法[20].
将植物样品洗净后,地下和地上部分分开,在105 ℃条件下杀青30 min,75 ℃烘干至恒重,磨碎后过0.25 mm尼龙筛,聚乙烯密封袋保存.称取1.000 g
干燥植物样品置于锥形瓶,加入10 mL浓HNO3与3 mL HClO4,在电热板上消解后采用原子吸收法测定植物地上部分和地下部分含Zn量[21].
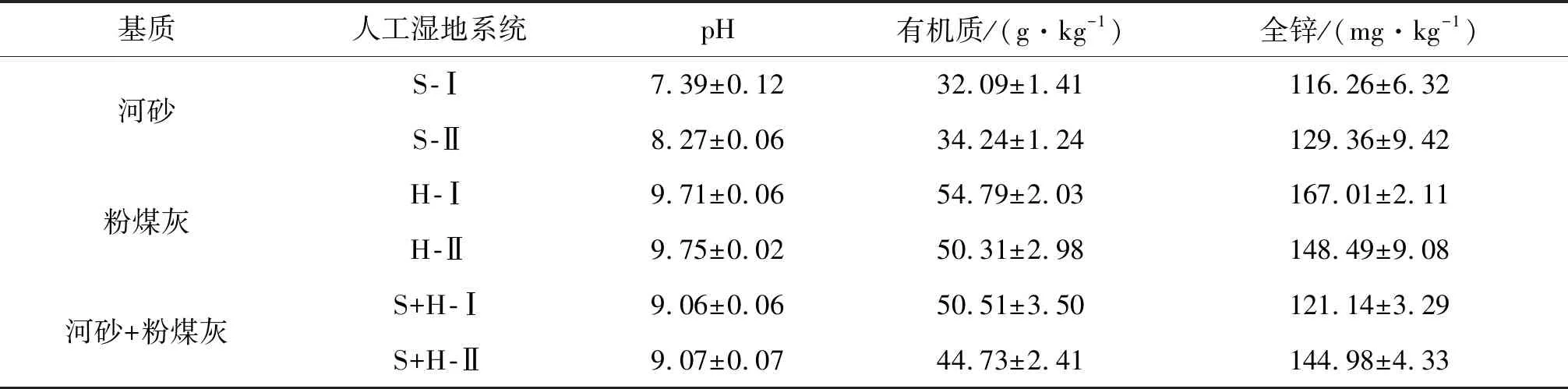
表2 正式进水13 d后基质的理化参数(平均数±SE)
将基质置于105 ℃烘箱中烘干至恒重,研磨过筛后采用重铬酸钾氧化-外加热法测定基质中有机碳质量分数[22];分别采用pH计和电导率仪(DDS-11A)测定水样、基质的pH和电导率,用电导率仪(DDS-11A)测定植物样品相对电导率(REC)[23],硫代巴比妥酸法测定丙二醛(MDA)质量比[24],定期观察并记录植物的生长状况.
有机质含量QOM按照式(1)进行计算.
QOM=QSOC×1.724[25],
(1)
式中:QSOC为基质中有机碳质量比,g·kg-1.
植物转运系数kTF按照式(2)进行计算.
kTF=ω1/ω2[26].
(2)
式中:ω1为植物地上部分的重金属质量比,mg·kg-1;ω2为植物地下部分(根系)的重金属质量比,mg·kg-1.
1.5 数据分析
采用SPSS 19.0对数据进行统计和方差分析,用Microsoft Excel 2013画图.
2 结果与讨论
2.1 不同基质湿地系统对废水中Zn的净化效果
不同基质湿地系统Zn去除率均大于95%,最高可达98.82%,出水Zn浓度均低于5 mg·L-1,达到《污水综合排放标准》的二级标准(GB 8978-1996).6种系统去除率的多重比较结果显示:S+H-Ⅰ>H-Ⅰ>S+H-Ⅱ>S-Ⅰ>H-Ⅱ>S-Ⅱ,且差异显著(P<0.05)(见图2),可见,在有相同植物、不同基质之间,S+H基质系统对Zn去除效果最好,其次是H.S+H-Ⅰ系统运行最为平缓稳定,运行期间去除率均高于98%,出水Zn浓度低于2 mg·L-1,达到上述标准的一级标准,表明混合基质净化效果明显优于单一基质,基质与植物协同作用更有利于废水中Zn的去除.
人工湿地基质对重金属离子的截留作用在废水净化中占主导地位[27],本研究中无植物系统Zn去除率均高于95%,说明基质为人工湿地去除Zn的主要场所,Zn通过基质的截留作用和生成Zn(OH)2沉淀等方式被去除.有植物系统Zn去除率均显著高于无植物系统(P<0.05)(见图2),表明基质与植物在去除废水中Zn时存在协同作用;植物通过稳定床体表面,增强了系统抗冲击负荷的能力,使出水水质保持稳定;同时,Zn是植物生长代谢过程中的必需元素[28],因此植物可以对Zn进行吸收富集,植物也会通过根系分泌物与Zn的物理、化学作用去除Zn[29].本研究中植物系统由挺水植物和浮水植物共同形成,二者也可能协同微生物增强了湿地对Zn的去除,提高了系统稳定性,有利于其长期运行.
不同基质系统Zn去除率均随时间延长降低,第7 d系统运行趋于平稳(见图2).这是由于系统为间歇式进水,Zn的去除主要通过河砂和粉煤灰的截留吸附完成.第1 d的去除率最高,但运行初期系统不稳定,水流对基质冲击力较强,导致基质颗粒随出水流出,而基质是在第1 d吸附的基础上又吸附了第3 d进水中的Zn,所以基质吸附积累的Zn的量更大了,从而使出水中检测出较大量的Zn,导致去除率降低.之后,随着基质系统逐渐稳定,随水流出的基质颗粒大大减少,大量Zn被基质吸附,去除率逐渐稳定,因此在第7 d之前Zn去除率不断降低,第7 d系统对Zn的吸附也达到平衡,各系统Zn去除率趋于一个稳定的数值.
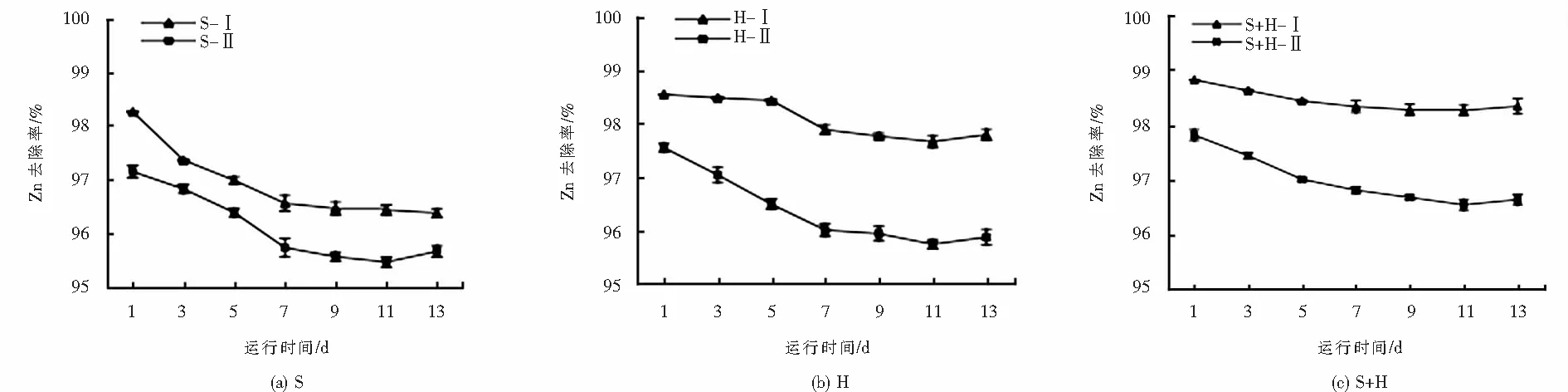
图2 不同基质湿地系统对重金属Zn的去除率Fig.2 Removal of heavy metal Zn by constructed wetlands with different substrates
2.2 不同基质湿地系统出水pH及电导率变化
pH是衡量出水水质的重要指标.Zn的形态随pH发生变化,在酸性条件下存在形态为Zn2+;随pH的升高生成Zn(OH)2沉淀;pH>11后,生成溶解的[Zn(OH)3]-和[Zn(OH)4]2-[18].另外,pH也会影响植物的生长状况,从而对废水中Zn的去除产生影响.本研究中,出水pH均大于进水pH(7.0~7.3),不同基质系统出水pH差异显著,H和S+H基质的出水pH明显高于S基质(P<0.05)(见图3).这是由于H基质的pH偏高,说明基质自身的理化性质会对出水pH造成影响.S+H-Ⅰ基质的pH始终低于S+H-Ⅱ(见图3(c)),这与其余两种基质正好相反(见图3(a)和3(b)),这是由于植物在生长过程中分泌的有机酸中和了部分碱度,说明植物在S+H基质中进行了良好的生长代谢.S出水pH持续下降,S-Ⅰ和S-Ⅱ趋势基本一致,在第13 d,S-Ⅰ和S-Ⅱ分别降至7.79和7.55,且仍未出现稳定趋势(见图3(a)).H出水由较大的pH缓慢下降,H-Ⅰ在第7天下降速率变大,随后在第11 d趋于平稳,H-Ⅱ出水pH基本均匀降低,H-Ⅰ和H-Ⅱ的pH在第13 d分别降到了10.61和10.30,且出现稳定趋势(见图3(b)).S+H-Ⅰ中pH持续下降,在第9 d运行稳定后停留在9.42左右;S+H-Ⅱ中pH持续下降,第7 d稳定在9.60左右(见图3(c)).综上所述,S+H系统出水水质稳定,且S+H基质更适合植物生长.表明,混合基质可以叠加或互补不同基质的优势,基质的不同性质可以为植物和微生物提供更加多样的生存环境,以提升系统对Zn的去除效果[30].
电导率可以用来判断水溶液中的杂质多少,出水中所含的基质颗粒物和植物根系向水中分泌的多种代谢产物都会影响出水电导率的大小.6种系统的出水电导率均显著高于进水电导率(P<0.05)(见图3),可能是水流流经人工湿地时,基质中盐离子、植物根系分泌物和基质中微生物的分泌物溶进水中,导致电导率增大[31].在系统运行初期,有植物系统的出水电导率均低于无植物系统,说明植物通过稳定床体,减弱了水流对基质的冲刷,但随运行时间延长,各系统运行趋于稳定.S-Ⅰ的出水电导率持续下降,S-Ⅱ在第7 d趋于平缓(见图3(a));H-Ⅰ的曲线平缓稳定,第9 d开始缓慢下降,H-Ⅱ在运行前期快速降低,第11 d相对趋于平稳(见图3(b));S+H-Ⅰ和S+H-Ⅱ的出水电导率在运行前期快速降低,第7 d趋于平稳(见图3(c)).总体来看,各基质在第13 d出水电导率差异不大,均稳定在0.4~0.5 ms·cm-1之间.在系统运行初期,H和S+H系统的出水电导率显著高于S系统(P<0.05),张翔凌[31]对不同基质处理污水的出水电导率研究发现,钢渣基质出水电导率远高于进水,而沸石、页岩、蛭石、陶瓷滤料、砾石、生物陶粒等6种基质出水电导率与进水基本保持一致,说明基质自身性质会对出水电导率产生影响,这与本研究结果一致.
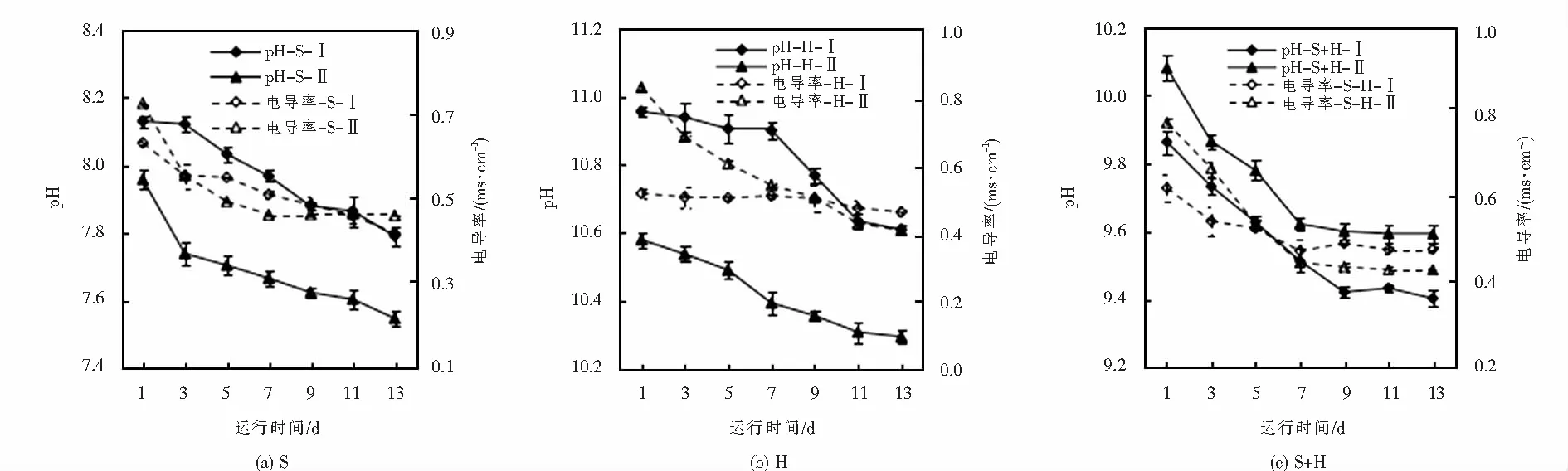
图3 不同基质湿地系统出水pH及电导率Fig.3 pH and electrical conductivity of effluent from constructed wetlands with different substrates
2.3 不同基质湿地系统中植物的生长状况
实验期间水芹和水葫芦在H基质中部分叶片出现枯黄;灯芯草在H基质中生长状况良好,植物长高;3种植物在S和S+H基质中生长正常.水芹菜在H基质中株高显著高于S基质(P<0.05),灯芯草在S+H基质中株高显著高于S基质(P<0.05),水葫芦在3种基质中的株高虽无显著差异(P>0.05),但3种植物均是H和S+H基质中的株高大于S基质(见图4(a)),表明3种植物适合在碱性条件下生长.水芹菜和水葫芦在S+H中的鲜重达到最大,灯芯草在S+H中的鲜重高于S中的鲜重(见图4(b)),由此判断S+H最适合植物生长,从而有助于植物对Zn的去除.3种植物在H中的干重均低于其它2种基质(见图4(c)),说明H影响了植物干物质的积累,不利于植物生长发育.

图4 不同基质对三种湿地植物生长的影响(平均值±SE)Fig.4 Effect of different substrates on the growth of three wetland plants(mean±SE)
植物在重金属胁迫下,活性氧的生成与清除平衡被破坏,从而导致膜脂、蛋白质等生物大分子过氧化,MDA是其产物之一.MDA作为膜脂过氧化的程度的重要指标,常表示植物受逆境胁迫的严重程度[32].REC也是衡量植物膜损伤程度的重要指标(见图5).由图5可以发现,H基质中3种植物的地上和地下部分的REC和地下部分的MDA及水葫芦地上部分的MDA均显著高于S基质(P<0.05),说明H基质对植物造成了膜脂过氧化损伤,这与观察到的植物生长状况一致.S+H基质中三种植物地上部分REC、水芹地下部分REC、水芹菜和灯芯草地下部分的MDA及水葫芦地上部分MDA均显著低于H基质,说明混合基质有效缓解了H对植物造成的损伤,有利于植物生长(见图5).三种基质系统中灯芯草MDA含量显著低于另外两种植物,特别是地下部分(见图5(c)和5(d)),相应地植物生长状况的结果显示,灯芯草的生长和干物质的积累也显著高于另外两种植物(见图4(a)和(c)),表明灯芯草可以有效抵抗模拟废水中的Zn胁迫,适合种植于处理含Zn废水的湿地系统中,这与徐德福等[33]和李瑞玲等[12]的研究结果一致.
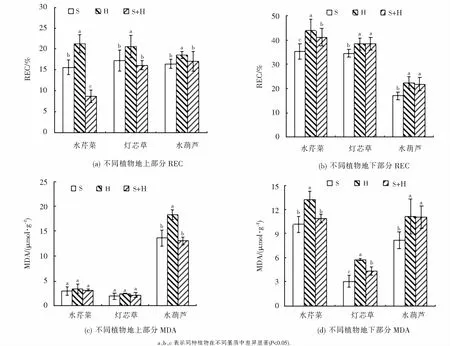
图5 各基质中不同植物体内REC和MDA的量Fig.5 REC and MDA content of different plants in different substrates
2.4 不同基质湿地系统中植物对废水中Zn的富集能力
不同基质系统中,三种植物地下部分对Zn的富集量均高于地上部分,这与Weiss等[34]的研究结果一致;水葫芦的富集量显著高于灯芯草和水芹菜(P<0.05),说明水葫芦对Zn富集效果很好,这与前人的结论一致[11];三种植物体内的Zn含量在S、H和S+H基质中依次增加,说明这三种植物在相对偏碱性的条件下对Zn的吸收效果更好(见图6(a)).不同基质系统中,灯芯草表现出最强的重金属迁移能力,在S和S+H中的TF分别为0.96和0.97,未超过1可能是由于实验周期较短,在H中TF为0.88,这主要是由于基质pH过大影响植物生长状况,进而减弱了植物对重金属的转运效果;水芹菜和水葫芦的TF相对较小,李法云等[35]发现沈阳冶炼厂厂区及其附近周围分布的水芹菜对Zn的TF高达1.02,与本研究的结论不一致,这主要是植物在重金属含量较高的环境中长期适应的结果;水葫芦具有发达的根系,须根长达40~50 cm,其对重金属的去除主要依靠根部,吸收值是茎叶部的几十至几百倍[13],因此TF较小.
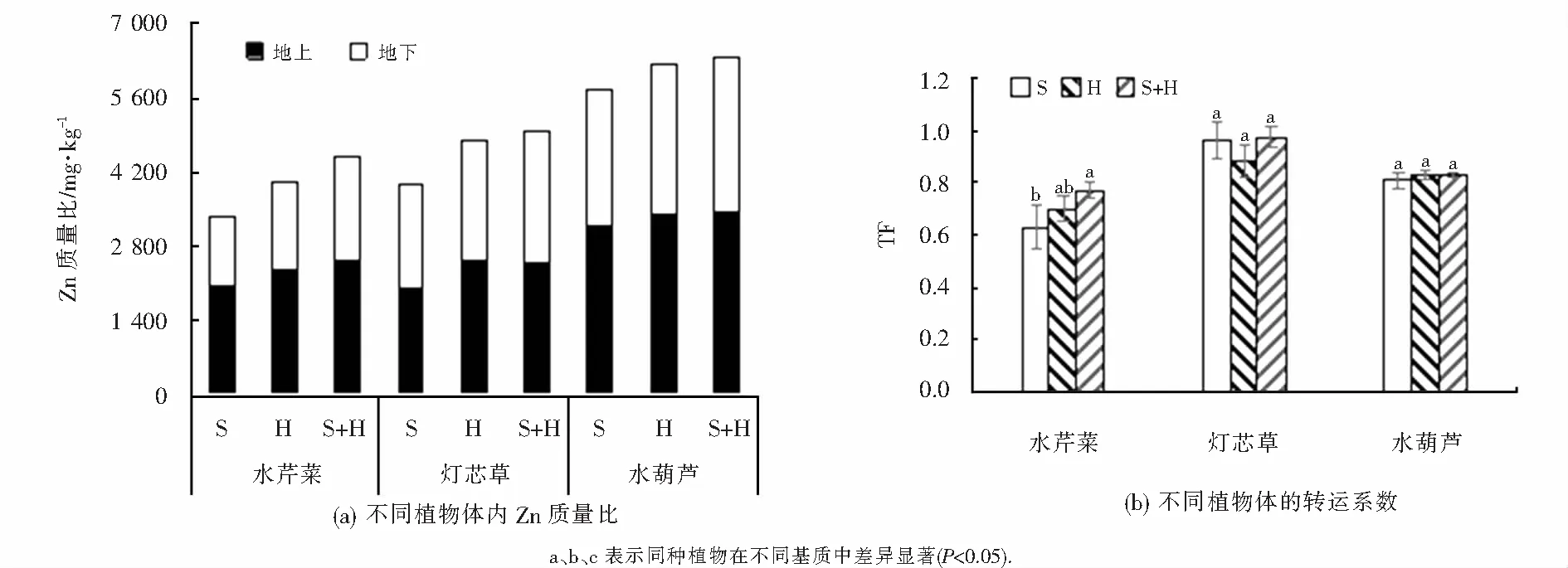
图6 不同基质中植物不同部位Zn含量及转运系数(平均值±SE)Fig.6 The content of Zn in different parts of plants and translocation factor in different substrates(mean±SE)
3 结论
1) 不同基质湿地系统对Zn去除率均高于95%,有植物系统对Zn的去除效果显著高于无植物系统.
2) S+H-Ⅰ对Zn的去除效果最好,达到98.82%,且出水水质稳定,植物生长良好,本试验中评价为较佳的小型模拟湿地系统,表明混合基质净化效果明显优于单一基质.但该系统出水pH较高,在今后的研究中仍需改进.
3) 水芹菜、灯芯草、水葫芦均能有效吸收Zn,且地下部分Zn的富集量高于地上部分;水葫芦的吸收能力最强,灯芯草的抗逆性最好,且向地上部分迁移Zn的能力最强;三种植物在相对偏碱性的条件下对Zn的吸收效果更好.
