化学链技术在低碳制氢领域的研究进展
2021-02-22郑浩孙朝曾亮
郑浩,孙朝,曾亮
(1.天津大学化工学院,绿色合成与转化教育部重点实验室,天津,300072;2.中南大学能源科学与工程学院,湖南长沙,410083)
氢气具有清洁环保和能量密度高的优点,是未来的清洁能源载体[1−3]。随着燃料电池和氢能源汽车的发展以及全球碳中和目标的提出,基于传统化石能源的低碳制氢技术变得更加重要,对于能源领域的发展具有重要意义[2−3]。制氢原料来源多样,相应的制氢工艺路线有多种选择,目前氢气主要为基于天然气重整和煤气化的碳基灰氢,这些过程在采用碳捕集技术后可实现碳中性蓝氢的制取,而未来的无碳绿氢主要来源于可再生能源。当反应原料为天然气时,可以选择蒸汽重整、干气重整、部分氧化和自热重整制氢等工艺,目前以甲烷蒸汽重整工艺为源头的制氢工艺在世界市场占据主导地位[4−5]。由于我国富煤贫油少气的资源禀赋,煤气化制氢工艺发展迅速,在大规模集中式制氢方面有成本优势。基于天然气和煤等化石燃料制取灰氢工艺较为成熟,但整体流程长,设备投资高,能耗水耗高,不符合未来分布式低碳氢能的发展趋势。
以甲烷蒸汽重整制氢为例,该工艺通过高温蒸汽重整反应(反应1)和中低温水气变换反应(反应2)来分别实现合成气的获取和氢气的富集,最后通过物理/化学吸收方法或变压吸附来实现H2和CO2等组分的分离。通过反应1可以看出,甲烷蒸汽重整反应是一个强吸热反应,需要外部提供大量的热,并且为了抑制反应过程中产生的积碳,需要增大通入蒸汽的比例,明显增加了整体能耗和水耗[6]。由于甲烷重整反应和水煤气变换反应的可逆性,使得该过程受到热力学平衡的限制。同时,当采用燃料与空气燃烧(反应3)来提供热量时,其产生的CO2需要额外的分离工序来控制碳排放。虽然可以通过向反应体系中加入纯氧来实现自热重整,但相应的空气分离装置投资和操作成本高,不适于中小规模分布式制氢布局。
现有煤制氢工艺与天然气自热重整工艺类似,需要首先通过水煤气和部分氧化反应产生高温合成气,煤的高碳含量决定了气体中H2与CO物质的量比较低,需要继续通过中低温水气变换反应提高H2含量,最后在流程末端进行CO2和H2的分离,同样存在能耗大、平衡转化率低、CO2捕集成本高和气体分离复杂等不足。为了克服上述问题,研究人员将化学链(chemical looping)技术应用到低碳制氢过程,化学链制氢技术可以在实现制氢的同时将产物近零能耗原位分离[4,7−10]。本文作者对三床化学链制氢工艺进行总结,分析近年来化学链制氢技术和循环载体材料的开发进展,为新型高效的化学链制氢工艺开发提供理论指导。

1 化学链制氢过程
1.1 化学链自热重整制氢过程

图1 三床化学链制氢示意图Fig.1 Schematic of three-reactor chemical looping hydrogen generation
利用化学链概念可以重新设计反应路径,实现反应与分离过程集成与强化。图1所示的双床化学链系统可以根据氧载体与原料反应的化学计量比和产品选择性,分别进行化学链重整制取合成气/氢气或化学链燃烧捕集二氧化碳,其中,化学链重整对应的总反应为吸热的蒸汽重整反应1,而化学链燃烧的总反应为放热的燃烧反应3。化学链过程将总反应分解为在不同空间或时间内进行的2个或多个子反应,通过循环利用固态氧载体(通常为金属氧化物)在系统中传递物质和能量,分别实现原料的转化与产物的原位分离[3,11]。图1所示的三床系统是化学链自热重整制氢的一种方式,在还原床(燃料反应器)中烃类被氧载体转化为CO2和H2O,在氧化床(蒸汽反应器)中被还原的氧载体与水反应制取氢气并部分再生,在燃烧床(空气反应器)氧载体完全再生并放出热量供系统自热运行。以甲烷自热重整制氢为例,该三床系统对应总反应4,利用化学链燃烧为化学链重整提供热量,实现二氧化碳的近零能耗分离,直接制取高纯度蓝氢,简化传统工艺中所需的水气变换、空气分离、二氧化碳分离等多个单元操作,高度集成强化了热化学低碳制氢过程。
氧载体一般是由金属氧化物组成,不断循环于各个反应器之间,从而实现氧原子和反应热的传递。采用化学链技术是为了避免传统蒸汽重整、部分氧化和自热重整技术的不足,同时实现高效获取目标产物,因此,氧载体应具有较高的燃料转化率和产品选择性。这些性能与氧载体的热力学性质是密切相关的,而且化学链过程大多在高温下进行,因此,可以通过Ellingham 图对氧载体进行初步筛选。图2所示为镍、铁、钨及其相关氧化物的Ellingham 图,根据氧化物的平衡氧势或氧化反应的吉布斯自由能随温度变化对氧化物的热力学性质进行分类和研究[11−14]。处于水蒸气生成线以下的反应,其氧化物的生成自由能变大于水蒸气的生成自由能变,因此,可以与水蒸气反应制氢。而处于甲烷氧化线以上的反应,其氧化物的生成自由能变小于甲烷氧化的自由能变,因此,可以被甲烷还原。可见,只有处于水蒸气线以下,甲烷线以上的氧化物才具有较强的制氢能力。而处于其他位置的金属氧化物或氢气平衡产率过低或无法使甲烷完全转化。综合考虑图1所示的化学链制氢过程的需求并结合Ellingham 图,用于化学链重整制氢的A 类金属氧化还原对主要包括W/WO2/WO2.72和Fe/FeO/Fe3O4等体系。用于化学链燃烧的B 类金属氧化物主要包括NiO,Fe2O3和Mn3O4等,B类金属氧化物具有强氧化能力,从而可以实现在完全氧化放热的同时捕集CO2,其中还原Ni 可以作为烃类重整催化剂,已被广泛用于化学链转化天然气的研究。

图2 化学链制氢氧载体Ellingham图Fig.2 Ellingham diagram of various metal oxides for hydrogen generation
氧化铁价格低廉,携氧能力强,而且Fe2O3/Fe3O4和Fe3O4/FeO 分别具有强弱不同的氧化能力,因此,在化学链制氢系统中得到了广泛的应用。图3所示为氧化铁与氢/水平衡线图和铁基化学链制氢操作线图(850 ℃)。从图3可知:氧化铁的平衡线和操作线可以用于化学链制氢过程分析。根据FeOx和H2/H2O 的相图可知:在一定反应温度下,氧载体不同氧化态之间相互转化时其所对应的气体平衡浓度不同,因此,可以得到平衡线图(图3(a))[15]。因为燃料反应器中只有比平衡浓度更高的还原气体浓度才能实现氧载体的还原,所以还原反应器的操作线应该处于在图3(b)中白色区域。根据氧载体和燃料反应过程中氧的物料平衡关系可知:操作线为直线,直线斜率的绝对值由氧载体和还原气体的物质的量比决定。图3(b)中,虚线表示的是气固并流接触的最佳操作线,实线表示气固逆流接触状态的操作线,实线与Y轴交点是固体出口的载体转化率,实线与X轴的交点是气体出口的燃料转化率。

图3 氧化铁与氢/水平衡线图和铁基化学链制氢操作线图(850 ℃)[15]Fig.3 Equilibrium line of iron oxide and hydrogen/water and operation line of iron-based chemical looping hydrogen generation(850 ℃)[15]
由图3(b)可知:当还原床采用氧化铁气固并流操作时,为了使燃料完全氧化为CO2和H2O,铁基氧载体的价态需要保持在Fe2O3与Fe3O4间,不仅晶格氧利用率低,而且Fe3O4无法与水蒸气反应制取氢气,因此不适用于三床化学链制氢系统。相比而言,采用气固逆流操作方式的还原床设计可以在反应器顶部利用Fe2O3的强氧化能力,确保燃料的完全氧化,而在反应器底部,新鲜的燃料避免了与CO2和H2O的混合,其强还原能力利于FeO/Fe的生成。如图3(b)所示,在确保燃料完全氧化的前提下,气固逆流还原操作的氧化铁还原度是并流操作下氧化铁转化率的近5倍,大大降低了固体循环量,利于三床化学链制氢系统放大,同时为氧化床制氢提供了可能。而氧化床中的主要反应为H2O 与Fe/FeO 反应生成H2,同时铁被氧化为Fe3O4。如果氧化床产品气体中水蒸气比例过高,其冷凝分离及再次升温汽化中的能耗将增大,因此,水蒸气制氢的转化率是衡量氧化床操作性能的一个重要指标。从图3(b)还可以看出:在同样还原铁进料的情况下,逆流氧化操作优于并流氧化操作,可以将水蒸气利用率由27%提高至47%。
基于上述化学链制氢过程分析,IGT的研究人员[16]开发了可连续操作的循环流化床HYGAS 工艺,其中燃料床和空气床均为两级流化床设计,燃料气体(煤基合成气)与氧载体在两级间逆向流动,不仅大大提高了燃料和氧载体的转化率,而且强化了气固间的热量传递。俄亥俄州立大学循环移动床装置[17]如图4(a)所示,该装置为250 kW的高压合成气化学链制氢示范装置,采用三床反应器系统,实现了系统的连续自热运行。东南大学循环流动床装置[18]如图4(b)所示,该装置采用多级流化床设计,还原床理论上存在2 个平衡级(提升管内气固并流与鼓泡床内气固混流),在实现甲烷完全转化的同时,Fe2O3可以被还原为FeO。
综上,三床制氢系统是化学链燃烧与化学链重整2 个过程的有机结合(见图1),其中化学链燃烧采用强氧化能力的Fe2O3-Fe3O4进行燃料的完全氧化放热,供系统自热运行及外部供热发电,并用于捕集CO2,而化学链重整采用氧化能力适中的Fe3O4-FeO-Fe 进行氢的高效制取及原位分离,因此,整体系统内的氢气收率取决于烃类原料中的化学能向化学链重整和化学链燃烧2个子过程的分配。由于热力学平衡、系统内氧平衡及动力学过程等方面的限制,现有技术在确保CO2捕集纯度的同时,甲烷最多只能将Fe2O3还原为FeO,这意味着传统的三床反应器设计与操作制氢效率仅为66%,而铁基化学链制氢系统的理论效率可达78%,因此,如何提高当前三床系统的制氢效率使之进一步接近理论效率是工艺创新突破的关键。

图4 三床化学链制氢系统Fig.4 Three-reactor systems of chemical looping hydrogen generation
1.2 吸收增强式化学链重整过程
吸收增强式化学链重整(sorption enhanced chemical looping reforming,SECLR)是另一项高度集成的先进自热重整技术,可以直接高效地将燃料转化为高纯度氢气,同时降低碳捕集及制氢成本,如图5所示。SECLR 是吸收增强式重整制氢技术与化学链燃烧技术的有机整合,主要包括重整、煅烧和空气3个反应器。吸收增强重整制氢通过引入钙基二氧化碳载体(吸收剂,CaO)原位脱除蒸汽重整中产生的二氧化碳(反应5),从而推动反应1和2的平衡向产氢方向移动,实现氢气的富集与分离;而化学链技术利用镍基氧载体(NiO)提供晶格氧和重整催化活性位(还原态Ni)来实现燃料重整(反应6)。SECLR 将上述2 个过程整合于同一个重整反应器内,可以实现反应热的有效利用。在煅烧反应器中,碳酸钙经高温分解得到纯二氧化碳气体(反应5 逆反应),省去后续的分离单元操作,同时,钙基二氧化碳载体得到再生并循环。在空气反应器中,镍基氧载体可与空气反应进行再生(反应7),同时放出大量热量为焙烧和重整过程供热。SECLR 技术利用可循环的金属氧化物,分别实现了氢气、二氧化碳和空气的原位分离,不仅大大降低了气体分离能耗,而且实现了过程的自热运行,更在高温下打破重整反应热力学平衡限制,推动反应平衡向氢气生成方向移动,节省了水蒸气用量,直接得到高纯度氢气,大大强化了低碳制氢过程。


图5 吸收增强式化学链重整制氢Fig.5 Sorption-enhanced chemical looping reforming for hydrogen generation

吸收增强式重整(SER)概念是基于勒夏特列原理,在受平衡控制的蒸汽重整反应中,通过从反应系统中选择性移除一部分反应产物CO2,可以提高燃料的转化率和反应速率以及氢气的选择性和产率[19]。目前,吸收增强蒸汽重整反应主要在小型固定床反应器中进行测试,通过在反应吸收和再生2种模式间切换气体实现。BALASUBRAMANIAN等[20]采用CaO吸收剂在固定床反应器上进行吸收增强式甲烷蒸汽重整,考察了温度、水碳比、吸收剂催化剂比例和原料气中甲烷含量等多项反应参数,结果显示550 ℃下反应速率很高,反应接近热力学平衡,一步得到了纯度超过95%的氢气。DOU 等[21]利用CaO 和镍铝尖晶石负载的镍基催化剂在固定床反应器中进行甘油重整,发现原位去除CO2可以大大提高H2的纯度,并降低CO2,CO和CH4的浓度。LI等[22]将2个并联的固定床反应器用循环模式组合,进行甲烷吸收增强蒸汽重整,该流程采用Ni催化剂和CaO-Ca12Al14O33吸收剂可以连续制得纯度超过90%的氢气。固定床操作在工业放大过程往往受到高温机械气体切换阀、床层内气固传质传热等方面的限制,研究人员为了突破这些限制,采用循环流化床系统设计开发了CO2受体工艺(图6(a))[23]和HyPr-RING 工艺(图6(b))[24],用于煤气化过程强化。在CO2受体工艺中,加入蒸汽的流化床作为气化反应器,在800~850 ℃和10×101.325 kPa 下进行操作。焙烧过的石灰石或白云石吸收剂作为CO2受体从气化器顶部进入,放热的碳酸化反应为吸热的气化反应供热,并驱动水气变换反应向正向进行,因而增高了产物气中的氢气含量,气化反应器得到含约20% COx的富氢产物。将从气化反应器底部排出的吸收剂移入再生反应器,在1 010 ℃及10×101.325 kPa 下焙烧再生,焙烧所需的能量由焦炭残渣燃烧供给。在再生反应器中,空气既作为流化气又作为氧化剂使用,再生后的吸收剂在气化反应器内循环,从而完成整个操作循环。CO2受体工艺已经在一套设计产能为40 t/d 试验装置上累计运行13 000 h,证明了该高温循环反应系统的可行性。HyPr-RING 工艺与CO2受体工艺的区别在于气化反应器的操作条件不同。HyPr-RING 工艺采用较低的操作温度(650 ℃)和较高的操作压力(30×101.325 kPa),在热力学上有利于碳酸化反应的进行,从而提高了氢气的产量。
目前,关于SECLR 的实验工作较少,主要原因在于反应系统复杂,需要3 个反应器协同运行,且反应器操作条件(温度、压力、物料流动)难以控制。PIMENIDOU等[25]在固定床反应器中考察了用吸收增强式化学链重整技术转化餐饮废油脂制氢。选取了Ni 基催化剂和白云石CO2吸收剂,在600 ℃和常压下,得到高纯氢气(>95%),但氢气纯度在几次循环后下降明显。RYDÉN 等[26]模拟吸收增强式化学链甲烷重整,以CaO 为吸收剂,使用流化床反应器,在600~750 ℃温度区间和常压条件下,得到纯度高于98%的氢气,同时超过95%的CO2被捕集。同时,对吸收增强式化学链煤气化制氢技术包括ALSTOM的复合燃烧−气化工艺(图7(a))[27]和GE 的多燃料气化−燃烧制氢工艺(图7(b))[28]也进行了放大验证。这些工艺与HyPr-RING工艺相似,主要区别是分别采用CaSO4和氧化铁作氧载体,通过引入化学链燃烧供热从而省去空气分离装置。当3个连通的流化床反应器同时交换2种循环载体颗粒时,反应器的设计、操作和控制均需要一套完整的系统理论方法指导。其中焙烧反应器的设计不仅需要考虑二氧化碳吸收剂的焙烧再生及可能的水合活化,而且需要按反应和热量需求分配固体产物的去向,目前尚无系统的设计与实验验证。
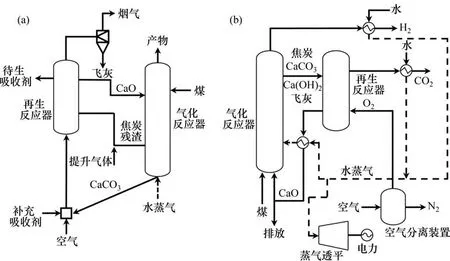
图6 CO2受体工艺示意图[23]和HyPr-RING工艺示意图[24]Fig.6 Schematic diagram of CO2 sorbent[23]and schematic diagram of HyPr-RING[24]

图7 ALSTOM复合燃烧−气化工艺示意图[27]和GE多燃料气化−燃烧制氢工艺示意图[28]Fig.7 Schematic diagram of ALSTOM hybrid combustion−gasification[27]and schematic diagram of GE multi−fuel gasification-combustion hydrogen generation process[28]
2 化学链制氢载体
2.1 铁基氧载体
铁基氧载体具有来源广泛和价格低廉等优势,应用前景广阔。铁的原子核外电子排布为3d64s2,使得其具有多种价态,包括+3、+2 和0 价。由于铁的氧化物在不同价态之间转变时所表现出的不同的氧化能力以及金属Fe 优异的水解离能力,使得铁基氧载体广泛应用于化学链过程。但是,铁基氧载体面临反应性和选择性差以及抗烧结能力不佳等问题,并且当铁基氧载体被还原后,使用空气再生氧载体时通常会富集对CO2生成具有高活性的表面亲电氧物种,进而影响选择性。
对于目前在化学链领域应用的铁基氧载体来说,其通常可分为两类,即合成的铁基氧载体和天然铁矿石基氧载体。合成的铁基氧载体主要分为负载型和复合氧化物型氧载体。负载型氧载体主要通过改变载体来调节金属分散度和抗烧结能力,并改变助剂以进行表面或体相改性以优化其反应性和抗积碳性能[29]。对于复合氧化物型氧载体,以ABO3钙钛矿为例,可以通过对A 和B 位离子的取代来调控其反应性能。天然矿石基氧载体主要是赤铁矿和钛铁矿[30]。天然矿石通常需要在高温煅烧后用于化学链过程。尽管矿石的主要成分是铁基氧化物,但矿石的性质可能会由于矿石产地的变化而发生变化[30]。
单纯氧化铁在化学链过程中的应用已经得到了广泛研究[31]。TREVISANUT 等[32]将Fe3O4用于化学链制氢过程,发现在20 个循环后,吸附在氧载体上的焦炭质量分数控制在1%。然而,在反应过程中氧化铁可能会被燃料还原为不稳定的碳化铁,从而随着循环次数的增加而造成积碳的产生和累积。MA等[33]研究了化学链反应中氧化铁的形貌和结构变化。经过多次循环后发现,氧载体的表面由于氧化铁在转化过程中的不稳定性而烧结和还原。同时,Fe 离子在氧化和还原的过程中不断地迁移,因此,氧载体的机械完整性和强度也受到了影响。相比于单纯氧化铁颗粒,负载型的氧载体其各方面性能更好。KIDAMBI 等[34]制备了具有不同Fe2O3负载量的Fe2O3/Al2O3氧载体,发现氧化铁的颗粒粒径随氧化铁负载量的减少而减小,负载为100%的氧化铁颗粒粒径是50%负载量氧载体的3.3倍。对于负载型氧载体,Al2O3作为载体可以更好地分散氧化铁并提高氧载体的耐烧结性[35],Fe2O3/Al2O3氧载体已被广泛用于甲烷重整和醇重整化学链过程。但是,Fe2O3/Al2O3氧载体在化学链过程中也面临反应活性差、积碳和烧结等问题。HUANG 等[36]向氧载体中加入不同比例的氧化镍,发现镍的添加可以有效地减轻氧化铁氧载体反应性差的问题,并且KANG 等[37]发现加入质量分数为1%镍还可以增加金属与载体之间的相互作用,从而可显著提高CO 的选择性并降低H2与CO 物质的量比。
Fe2O3/Al2O3氧载体上的积碳主要有2 个原因:一是Al2O3为酸性载体,可以导致积碳的产生;二是氧化铁有限的氧迁移能力不能及时清除反应过程中产生的碳物种。因此,Fe2O3/Al2O3氧载体积碳的消除可以从这2 个方面考虑。ZHU 等[38]向Fe2O3/Al2O3氧载体中添加K2CO3,并将其用于化学链制氢过程。性能测试表明,掺杂K2CO3的Fe2O3/Al2O3氧载体在甲烷体积分数为40%时没有出现明显的积碳,并保持稳定,而未掺杂的Fe2O3/Al2O3氧载体的积碳随时间显著增加。由于添加了K2CO3,蒸汽氧化阶段的H2纯度也得到了提高。具有较强的氧迁移能力和储氧能力的CeO2被添加到Fe2O3/Al2O3氧载体中以抑制积碳的形成。采用溶胶凝胶法制备了掺杂质量分数为5% CeO2的Fe2O3/Al2O3氧载体,其晶相包括CeAlO3,Al3Fe5O12和AlFeO3,CeAlO3可以活化和分解CO2,从而提供活性表面氧来消除积碳[39]。ZHU 等[40−41]研究Fe2O3-CeO2这2 种金属氧化物复合氧载体用于化学链甲烷水蒸气重整制氢,发现循环反应过程中生成的CeFeO3钙钛矿结构有利于氧载体晶格氧的迁移和扩散,从而提高了氧载体的反应性能。
除了Al2O3载体外,MgAl2O4载体在负载型铁基氧载体中也有应用,DE VOS等[42]用喷雾干燥法制备了Fe 基氧载体,并以MgAl2O4为载体的氧载体成功避免了采用Al2O3为载体时的失活问题,说明MgAl2O4为载体的氧载体适合化学链制氢过程。BUELEHS 等[43]开发了一种以CH4和CO2为原料制备CO的超级干气重整反应,通过采用Ni/MgAl2O4作为甲烷重整催化剂、Fe3O4/MgAl2O4作为氧载体和CaO/Al2O3作为CO2吸附剂,提高了二氧化碳的转化率,并实现了一氧化碳的高选择性生产。
对于负载型氧化铁氧载体来说,其性能与氧化铁颗粒的粒径密切相关,因此,获得小粒径的氧化铁颗粒便显得尤为重要。人们普遍通过载体来获取小颗粒。LIU 等[44]利用SBA-15 载体的限域效应实现了氧化铁颗粒的高分散,被限制在SBA-15 内的氧化铁颗粒(Fe2O3@SBA-15)和未负载的氧化铁颗粒的粒径分别在3~5 nm和50~100 nm之间。在氧化还原循环后,Fe2O3@SBA-15氧载体的粒径增加了5~8 nm,而未负载的Fe2O3的粒径在1~10 μm之间。Fe2O3@SBA-15 氧载体在低温下可实现近100%的CO 选择性,其转化率约为未负载Fe2O3的1.69倍,证明氧化铁颗粒粒径的减小显著改善了其反应性能。
铁基复合氧化物型氧载体具有特定的晶体结构,主要包括尖晶石、钛铁矿和钙钛矿结构氧载体。复合氧化物与2种金属氧化物机械混合的区别在于,复合氧化物中添加的组分可以通过稳定催化剂结构、改变催化剂电子结构以及在表面形成缺陷来提高催化剂的活性。同时,复合氧化物多为晶体结构有缺陷的非化学计量化合物,使得在氧化还原反应中表现出优良的氧离子和电子转移能力。尖晶石型复合氧化物因其成本低、耐高温和化学性质稳定的特点,长期用于烃类的完全和选择性氧化。EVDOU 等[45]对不同A 位的尖晶石型铁基氧载体在化学链过程中的应用进行了测试,发现氧载体的性能和稳定性随A 位金属的不同而发生显著变化。CuFe2O4氧载体在保持稳定性的同时,表现出最强的甲烷反应活性,参与反应的晶格氧量最大。与CuFe2O4相比,NiFe2O4和ZnFe2O4的初始反应活性中等,并且在5 个循环中失活明显,但是其具有不同的失活原因。NiFe2O4是由于氧载体的烧结失活,而ZnFe2O4是因为氧载体在循环后产生相分离,变成氧化铁和金属Zn而失活。
天然钛铁矿氧载体在化学链过程中表现出良好的性能,QIN 等[46]将其应用于化学链重整过程,并充分分析了反应过程中钛铁矿的形貌变化,从而对钛铁矿在化学链过程的应用有更清晰的认识,为钛铁矿氧载体的发展提供指导。由扫描电子显微镜结果可以知道,Ti-Fe 复合氧化物在700 ℃下氧化处理后在表面形成纳米带,并且随着循环次数的增加,氧载体变得多孔。钛铁矿的多孔结构使其机械性能变差,同时,纳米带的形成也会导致相分离产生。为了解决钛铁矿的机械性能和相分离的问题,CHUNG 等[47]将铝基骨架引入钛铁矿氧载体,铝基骨架的存在使得氧载体在3 000次循环下仍然保持较强的活性和稳定性。
由于钙钛矿的组成元素、化合价态、化学计量比和氧空位的灵活性,使得其在三元催化、碳氢化合物的完全氧化和燃料电池领域占据重要地位。镧系钙钛矿是化学链过程中使用最为广泛的钙钛矿型氧载体。MIHAI 等[48]将LaFeO3氧载体用于化学链甲烷部分氧化过程,发现氧载体的粒径随着制备过程中络合剂的选择而变化,从而最终影响氧载体的循环稳定性。对于LaFeO3钙钛矿,通常采用Sr 或Ce 离子对A 位离子进行取代,而B位离子的取代主要采用过渡金属元素。HE 等[49−53]对钙钛矿的改性工作进行了系列研究,探究了钙钛矿A和B位离子取代对钙钛矿氧载体反应性能的影响。他们发现LaFeO3钙钛矿中Sr 对A 位离子的取代使得氧载体的氧空位增加,并且抑制了甲烷的裂解[49]。同时,Co 对LaFeO3钙钛矿中B 位离子的取代使得氧载体的给氧能力、抗积碳能力和产氢能力均得到加强,并且可以在20 个循环中稳定运行[50]。在掺杂的基础上,他们还探究了微观结构的改变对钙钛矿氧载体活性的影响,采用模板法制备了三维有序大孔的LaFe0.9Ni0.1O3氧载体,将三维有序大孔结构与钙钛矿B位掺杂结合起来,发现镍的取代提高了供氧能力,同时也促进了甲烷的解离,三维有序大孔氧载体的开放孔道和大比表面积减小了传质阻力并为反应提供了高活性位点[51]。
除了ABO3−δ型钙钛矿外,ZHAO 等[52]还将AA′BB′O6−δ型钙钛矿应用于化学链甲烷水蒸气重整制氢,结果表明LaSrFeCoO6双层钙钛矿型氧载体表现出比单一的LaFeO3和LaCoO3氧载体更加优越的性能,在通水阶段,氢气产量为444 mL(相对于每克Fe+Co)。在此基础上,ZHAO等[53]利用微乳液法制备了La1−xSrxFeCoO6(x=0,0.2,0.4,0.6,0.8,1.0),发现A位离子的替换对双层钙钛矿氧载体的性能产生了影响,x为0.4 的氧载体显示出了最优的产氢性能。HE 等[54]将镧锶铁钙钛矿和氧化铁结合起来,发现该氧载体具有良好的循环稳定性。实验表明,采用氧化铁−镧锶铁复合氧化物作为氧载体的氧化床中水蒸气制氢的转化率可以提高到单纯铁基氧载体的理论转化率的3.8倍。
大多数钙钛矿研究的重点是采用正一价的碱金属或正二价的碱土阳离子代换A 位点,只有少数考虑在不改变钙钛矿晶体结构类型的前提下,采用与A离子相同价态的金属离子来取代A离子。此外,关于钙钛矿材料中晶格氧迁移与A或B阳离子取代之间的关系的研究也比较少,ZHANG等[55−56]采用Ce3+对LaFeO3钙钛矿进行A位掺杂,在不破坏LaFeO3晶型的情况下调变Fe—O 键性质,在提高LaFeO3表面反应活性的同时,增强晶格氧迁移性能,从而对氧载体水蒸气氧化阶段氢气纯度等性能进行有效调变。H2O−程序升温氧化和H2O−脉冲实验结果显示,通过在LaFeO3的A 位点上进行适当比例的Ce3+取代,可以削弱H2O裂解步骤中的H—O键的强度从而提高对H2O裂解的表面反应性,同时也提高了甲烷部分氧化步骤的晶格氧转化率。从电导率弛豫测试结果,发现与LaFeO3和CeFeO3相比,La0.5Ce0.5FeO3上的表面氧交换和体相氧迁移能力均得到了提高。
2.2 钨基氧载体
氧化钨材料具有较高的熔点(>1 000 ℃),因此其抗烧结能力较强。从图2可以看出氧化钨位于Ellingham 图的部分氧化区内,也就是说,氧化钨制备合成气在热力学上是可行的。通过热力学计算得出,WOx对合成气的选择性较高(>90%),并且从WO3-W 的还原过程可知,总给氧能力较强。与Fe2O3,SnO2,V2O5和MoO2氧化物相比,固定床甲烷重整测试结果表明WO3对CO 的选择性最强,对CO2的选择性最弱[57]。计算和实验都证明了钨基氧载体具有广阔的应用前景,但缺乏相关研究的主要原因是其反应活性较差。为了解决氧化钨氧载体面临的问题,研究人员针对载体和助剂对活性和稳定性的影响进行了深入研究。KODAMA等[58]发现ZrO2的加入使得WO3反应活性得到大幅提高。SIM等[59]对该体系进行了进一步探究,发现可以通过同时加入CeO2和ZrO2来抑制积碳和碳化钨的形成,从而有效提高了氢气纯度。
为了进一步提高晶格氧的利用率和甲烷的转化能力,CHEN 等[60]制备了Ni 改性的WO3基氧载体(图8)。镍的引入不仅削弱了W—O 键的强度,提高了氧传输速率,同时表面存在的镍在还原之后还可以起到催化甲烷反应的作用。通过X 射线衍射和其他表征,对WO3在还原过程中的反应机理进行了深入探究。WO3-WO2.96和WO2.96-WO2.72使甲烷完全氧化,WO2.72-WO2和WO2-W 则使甲烷部分氧化。Ni0.5WOx/Al2O3氧载体中,镍离子的引入可以削弱W—O 键的强度和提高晶格氧的可用性,从而提升总甲烷转化率和合成气产量。虽然镍的引入明显提升了氧化钨氧载体的反应性能,但是其同时也面临循环稳定性差的问题。为了实现提高氧化钨氧载体的活性同时还能在循环过程中保持氧载体的结构稳定性,LIU 等[61]制备了FeyWOx/SiO2氧载体并将其应用于化学链过程。铁的加入极大地提升了氧载体的性能,并且在还原过程中,铁和钨之间的强相互作用促使了铁钨合金的形成,抑制了相分离的发生,从而确保了结构稳定性。氢气程序升温还原表征表明,氧化钨的还原温度随着铁的添加而降低,证明了铁的添加减弱了W—O键,增加了晶格氧的利用率。在氧载体中,铁以Fe2+的形式存在,有利于部分氧化产物选择性的提高,氧化钨中铁的添加为氧化钨氧载体的开发提供了新的策略。

图8 Ni对WOx的表面和体相改性示意图[60]Fig.8 Schematic diagram of surface and bulk modification of WOx by Ni[60]
2.3 镍基氧载体
镍基氧载体是研究广泛的一种氧载体,其具有高反应活性和较大反应速率等优点,但是镍基氧载体存在积碳严重和易烧结等不足,从而限制着镍基氧载体的发展。JOHANSSON等[62]采用冷冻造粒法制备了Ni 基氧载体,发现以MgAl2O4为载体的氧载体有较高的甲烷转化率和良好的抗积碳性能。DE DIEGO 等[63]对比了沉积−沉淀法和干浸法,发现沉积−沉淀法制备的氧载体有较强的抗积碳能力。ZAFAR 等[64]合成了SiO2负载的NiO 氧载体,结果表明SiO2与NiO 会形成惰性硅酸盐化合物,导致多次循环后载氧能力降低。同时,α-Al2O3较γ-Al2O3负载的NiO 有更强的反应活性,原因是γ-Al2O3可以与NiO 形成NiAl2O4[12]。RYDÉN 等[65]将NiO分别负载在MgAl2O4,α-Al2O3和γ-Al2O3上,发现NiO/MgAl2O4和NiO/α-Al2O3的稳定性很好,其物理和化学结构均未发生改变,而NiO/γ-Al2O3虽丧失了孔结构但活性依然较高。ANTZARA等[66]对比了采用ZrO2,TiO2,SiO2,Al2O3和MgAl2O4为载体的NiO 氧载体性能,发现以ZrO2为载体的氧载体在甲烷转化和稳定性方面具有最优的表现。上述实验表明,通过改变制备方法和载体可以实现氧载体性能的调控。将镍离子限制在稳定的结构(例如钙钛矿)中也是降低碳沉积的一种策略,因为钙钛矿结构具有较强的氧迁移能力,并且可以更好地平衡碳的生成和消除速率。梁皓等[67]探究了Fe和Co掺杂的BaNi1−x−yFexCoyO3氧载体用于化学链甲烷水蒸气重整制氢,发现适当含量的Fe和Co取代B 位Ni 离子,提高了BaNiO3氧载体的反应性能,900 ℃下甲烷转化率可达98%,氢气产量可达277 mL(相对每克Ni)。此外,该团队还探究了A和B位同时掺杂的LaxK1−xNiyCo1−yO3钙钛矿型氧载体用于化学链甲烷水蒸气重整制氢,发现A和B位离子同时替换提升了氧载体的制氢性能,700 ℃下甲烷转化率可达99%[68]。
2.4 二氧化碳载体
目前已有多种二氧化碳载体或吸收剂的研究,包括Na2ZrO3,Li4SiO4和CaO 等[69]。其中,CaO 具有CO2吸收能力强、自然界储量丰富,碳酸化过程快等特点,是最常用的CO2吸收剂[69−70]。然而,这种材料的缺陷是高温再生会致使吸收剂失活,循环使用时稳定性不佳[71−72]。如果吸收剂再生不完全,将会导致在下一循环中氢气纯度下降。在吸收剂再生模式中,要完全恢复吸收剂的活性,需要经过很多步骤。再生的方法很多,包括变压法、变温法、吹扫气剥离法、取代脱附法以及反应再生法。许多研究者通过向CaO 中加入其他耐高温材料,或者增大其表面积和颗粒分散度来增强CaO 的吸收能力和稳定性。目前,大多数研究着重于以甲烷为原料的流程测试,以醇类为原料的研究较少。HE等[73]用类水滑石前驱体得到的Co-Ni催化剂和焙烧过的白云石吸收剂的混合物来进行吸收增强式乙醇蒸汽重整,在550 ℃下得到了摩尔分数为99%的氢气,且CO 的摩尔分数仅为1%。GUNDUZ等[74]将MCM-14负载的Ni或Co催化剂和CaO 吸收剂应用于吸收增强式乙醇重整,发现在600 ℃和水与乙醇物质的量比3.2 条件下可得到94%的氢气。CUNHA 等[75]制备了K-Ni-Cu-水滑石复合材料,用于吸收增强式乙醇蒸汽重整制氢,在500 ℃和水与乙醇物质的量比10 条件下,吸收剂饱和前,可得到99.8%(干基)的高纯氢气。一些研究者利用适当的CaO前驱体[76−78],蒸汽水合CaO和用乙醇水溶液或KMnO4溶液来提高CaO 材料的循环稳定性[79−82],但吸收剂失活、再生的深层原理目前还不明确。
研究人员还尝试将催化剂和吸收剂结合在同一个颗粒上。SATRIO 等[83]合成了具有层状结构的圆形小球,小球具有高活性的石灰或煅烧白云石的核,外面包覆着多孔的氧化铝保护层,层中负载着Ni 基催化剂。在甲烷重整反应中,并在600 ℃以及101.325 kPa 条件下,该催化系统的H2产率为95%,纯度为75%;而在同样的操作条件下没有CO2吸收剂存在时,氢气产率仅为82%。MARTAVALTZI等[84−85]采用浸渍法制备了NiO-CaOCa12Al14O33多功能催化剂和Ni/CaO催化剂。这种常规的制备方法会造成Ni 颗粒在吸收剂载体上不均匀分散,且当Ni 负载量增大后对CO2的吸收能力有负面影响。WU等[86]考察了类水滑石衍生物多功能催化剂,该催化剂具有较大的Ni 金属分散度和可逆的CO2吸收能力。Ca 与Al 物质的量比为3 的Ni-CaO-Al2O3催化剂显示出了比传统CaO和Ni/Al2O3混合物更好的催化性能。
3 结语与展望
常规的含碳燃料重整与气化制氢流程长,既耗费资金又不节能,且产品为灰氢,伴生二氧化碳排放重。化学链过程通过金属氧化物的反应−再生循环,可以同时实现二氧化碳分离和氢气生产,有望发展为廉价、清洁和高效的新型低碳制氢方法。化学链制氢的过程开发与技术放大需要高性能氧载体与合适的反应系统匹配,本文有针对性地分析总结了该领域的研究进展。
1)化学链制氢技术的核心是循环载体材料的选择与开发。氧载体的反应原理通常涉及氧离子和空位的产生和再结合,还有其在体相中的扩散以及与表面吸附物质的反应。化学链制氢氧载体的物理机械强度和化学反应性能受操作温度直接影响,为了提高氧载体的循环稳定性和寿命,操作温度不应过高,但是氧载体的体相氧传递速率和表面反应活性温度会随着温度的改变而改变,而降低温度对氧载体的体相氧传递和表面反应活性均提出了严苛的要求。在处理烃类原料时,铁、钨等氧化物暴露出了自身的问题,如对烃类催化转化能力较弱,时空收率低,过度还原时积碳问题严重,还原床内形成的积碳被传递到氧化床中时会造成CO的伴生,影响产品氢气纯度。与传统蒸汽重整工艺相似,对于新型化学链制氢工艺而言,Fe和Ni基催化剂/氧载体普遍易因活性物种烧结和积碳而快速失活,是开发高效稳定复合氧载体的主要挑战[87−88]。针对金属氧化物对烃类转化的动力学性能差的问题,可利用外来金属进行体相掺杂与表面修饰,从而可以在实现提高氧载体表面反应的同时,对氧载体的体相氧迁移能力以及携氧能力进行调控。通过合理设计氧载体,可以控制将晶格氧输送到表面催化部位的速率,从而匹配氧载体氧化和还原速率。同时,可以改变氧载体的性质以改善其表面催化功能以及调节晶格氧物种,以使副产物的产生最小化。
2)负载型氧载体和复合金属氧化物型氧载体是目前常见的氧载体类型。不同类型的载体、助剂和制备方法被用来优化负载型氧载体的化学链制氢性能,但其不可避免地会面临积碳等问题。针对氧载体的积碳问题,可以通过减少氧载体中的酸中心和促进晶格氧的转移2种方式来抑制碳沉积的形成,目前研究人员重点通过提高氧载体晶格氧传输能力的方式来减少积碳的产生。对于复合金属氧化物型氧载体,钙钛矿氧载体是研究最广泛的类型,其优异的结构使得其具有优良的性能[56,89]。通过添加一定量的助剂,例如向钙钛矿型氧载体的A 位添加Sr 以获取更多的氧空位,以及向氧化铈中添加离子半径较小的氧化锆以引起晶格畸变,可降低氧离子扩散的活化能,有利于晶格氧的迁移和扩散,因而可以及时消除表面上的碳沉积,避免氧载体失活。除了修饰氧载体之外,还可以通过优化反应条件来抑制碳沉积物的产生。钙钛矿型氧载体存在储氧能力差的问题,可以通过设计核−壳结构的氧载体,将钙钛矿等反应活性较强的金属氧化物和氧化铈等储氧能力强的氧化物有效地结合起来,或通过添加助剂的形式以提高携氧性能。氧载体的发展将继续向基于双金属甚至多金属氧载体的方向发展,通过不同类型金属的匹配来实现良好的产氢性能。从系统操作方面,向反应气氛中添加适量的蒸汽或二氧化碳,或在产生碳沉积物后立即进入氧化阶段,可以在一定程度上避免碳沉积物或抑制由碳沉积物引起的氧载体失活。
3)反应−再生系统设计在决定化学链制氢过程性能方面也起着至关重要的作用。固定床、流化床和移动床是化学链制氢过程开发中常见的操作模式。固定床反应器可以处理气液态燃料,但需要在高温下频繁进行气体转换及与其匹配的机械阀装置。化学链反应器设计应根据不同原料和产品的特点,选择合适的气固接触方式和反应器类型,可连续操作的循环流化床和循环移动床是大型化学链制氢反应器的发展方向。还原床在设计时应充分考虑燃料的不同性质,比如氧化床内反应为微放热,对气固间传热要求不高,可以考虑采用移动床反应器设计。当采用固体燃料时,不仅反应复杂程度加大,体系内气体流速不断变化,而且对反应热的需求也大大增加,可以考虑采用流化床设计。为了增强反应动力学,还应考虑引入H2O和CO2等中介气体及催化活性组分,同时根据组分转化过程的特点设计不同的床层结构,以提高燃料的转化效率和产物的选择性。同时,反应−再生系统还应考虑选择合适的阀型用以控制固态氧载体的循环速率,确保循环系统内的压力平衡,同时防止不同反应器间的气体混合。氧载体在氧化还原循环过程中的机械强度会逐渐变弱,在设计反应器时需要考虑如何移除磨损的氧载体,避免其对床层压降与固体循环的影响。
4)化学链制氢涉及金属氧化物材料、催化科学、反应工程、颗粒技术等多学科交叉,其工艺开发与过程放大应注重理论与实验相结合。氧载体材料开发应从分子层面的量子化学计算出发,关注表面与体相动力学性能的提升与机理研究,指导材料的理性设计与开发;而新工艺开发也应结合材料特性,建立热力学平衡、反应动力学、气固流体力学等多尺度模型,与小试和中试试验有机结合,为技术落地提供良好的理论与实践基础。化学链制氢原料来源广泛,三床化学链系统适用于天然气、煤等化石能源的蓝氢生产工艺开发,而双床化学链系统可拓宽基于可再生能源的绿氢技术路线[90−94]。总之,化学链制氢技术是一种先进的热化学低碳制氢技术,应协同加强循环载体材料和反应器系统的基础研究与应用放大,加快过程开发。
