聚电解质自组装膜及其固定化酶研究
2021-02-22张鑫刘袖洞
张鑫,刘袖洞
开发与应用
聚电解质自组装膜及其固定化酶研究
张鑫,刘袖洞*
(大连大学 环境与化学工程学院,辽宁 大连 116622)
聚电解质层层自组装是利用分子间的静电、氢键、共价键等相互作用将高分子组装成膜的技术,具有膜组分及厚度可控、操作简便、不需要特殊复杂设备等优点,在医学、生物技术、器件制备、表面改性等诸多领域有着广泛应用。简述了层层自组装成膜驱动力、增长模式、影响因素以及自组装膜制备材料、方法等方面进展;总结了聚电解质自组装膜作为载体固定化酶及其用于生物催化转化的研究与应用进展。
聚电解质; 自组装膜; 固定化酶; 酶催化
聚电解质层层自组装(layer-by-layer self- assembly,LbL)是Decher等[1]于20世纪90年代初提出的一种制备高分子薄膜的技术。这种组装制膜的技术一经问世就受到广泛的关注,因为它具有条件温和、操作简单、膜厚度及组分可控、无须特殊设备等诸多优点。其制备的基本过程是把一个基片在一个阴离子聚电解质溶液和一个阳离子聚电解质溶液中交替浸泡,因为阴阳离子之间的静电吸附作用,阴阳离子聚电解质就会在基片上“一层一层”地组装成膜。经过多年的发展,现已成为应用非常广泛的高分子薄膜制备技术, 既可以在硅片、石英、玻璃、ITO(Indium tinoxide)导电玻璃片、塑料薄片和聚酰胺薄片等二维平面结构[2];又可以在二氧化硅(SiO2)、聚苯乙烯(PS)、二氧化钛(TiO2)和碳酸钙(CaCO3)等微球或生物细胞等三维立体结构[3]上组装成膜,用于生物技术、医学和电子等领域,如:构筑抗凝血表面以提高医疗器械的血液相容性、组装高分子膜/空心微胶囊作为药物控释体系、制备精密的电子或光学器件等。
1 聚电解质层层自组装简介
1.1 聚电解质层层自组装成膜驱动力
聚电解质层层自组装所形成的薄膜是高分子链相互穿插的膜结构。膜组装过程在体系中的熵值增加,而焓变程度较小,这是因为有溶剂分子及小分子量离子的释放,所以层层自组装的反应驱动力是熵增而不是焓变[4,5]。层层自组装技术依靠的是分子之间的亲和作用力组合,因为所选用的材料差异,自组装的材料之间的亲和驱动力也分不同的类型,比较常见的有以下几种类型:
1)静电驱动力[6],利用阴、阳离子聚电解质之间的静电引力相互吸附缠绕在一起,可根据两种高分子的加入顺序不同来控制多层膜的结构。该种方法有着许多优点:适用于各种形状和大小的基底、制备过程简便等。但是该方法也有缺点:制备的多层膜在强酸、强碱、高盐浓度等极端条件下不够稳定,膜的结构容易发生不可逆变化甚至是破坏。但是,膜的这种不稳定性也可加以利用,例如,通过调节离子强度、pH等溶液参数来调控膜结构,用于控制物质的释放[7]。
2)氢键驱动力[8],通过两种高分子之间形成的氢键组合在一起,形成多层膜结构。比静电驱动力作用稍弱。可以实现让不带电荷的材料适用于膜自组装;可使具有低玻璃转换温度的聚合物嵌入组装层[9]。而且以氢键作为驱动力会使自组装膜在温和的pH条件下具有一定的环境应激性。
3)共价键驱动力[10],与其他作用力相比,共价键有较强的键能,它通常是依靠组装单元之间的化学反应(如形成酯键、酰胺键等)来形成的。两种高分子化合物之间通过共价反应结合在一起,在基片上交替反应、沉积,构成多层膜结构,因此由共价键制备的自组装膜稳定性较好[7]。
4)生物大分子识别功能形成的驱动力[11],与其他作用力相比,有一定的局限性,主要是酶、DNA、蛋白质等生物物质,通过分子间特异性识别功能构筑出的多层膜。
1.2 聚电解质自组装多层膜的增长模式
在聚电解质多层膜的组装过程中,膜层会出现两种增长模式:指数增长[12-13]和线性增长[14]模式。指数增长指的是每个膜层质量吸附并不恒定,是随着膜厚度的增加而呈现指数型增加,增长模式快速,但是表面粗糙度较大。这种生长模式是由于吸附过程中至少有一个聚电解质在多层膜构筑过程中不断扩散,容易“进”“出”多层膜。线性增长指的是膜层质量和厚度会随着膜层数的增加而呈现出线性增加的趋势。线性增长的多层膜,相邻层间有穿插和渗透,增长模式缓慢并且表面形貌比较光滑。这两种增长方式可应用于在同一聚电解质多层膜内部创造出不同的分隔区,该方法将在药物运输及控制释放速率中有巨大的潜力[15-16]。
1.3 聚电解质自组装膜的材料
根据聚电解质分子主链或侧链中所带离子基团的种类和数量不同,常分为阴离子型聚电解质,阳离子型聚电解质,以及同时含有阴阳两种基团的高分子,即两性聚电解质。常见的聚阴离子有海藻酸钠(SA)、聚乳酸(PLA)、聚(苯乙烯磺酸钠)(PSS)、聚丙烯酸(PAA)、透明质酸钠(HA)等。常见的聚阳离子有聚烯丙胺盐酸盐(PAH)、聚乙酰亚胺(PEI)、壳聚糖(CS)、聚(二甲基二烯丙基氯化铵)(PDADMAC)等。两性聚电解质包括羧甲基壳聚糖、蛋白质、核酸等。聚电解质根据材料来源的不同可分为合成聚电解质和天然聚电解质[17]。
合成聚电解质材料来源广泛、可修饰性强,工业应用较多。例如,在带相反电荷的渗透膜表面组装合成聚电解质,可以改善膜的分离性能、亲水性和抗污染性等[18]。郭雪等[19]采用阳离子聚甲基丙烯酸N,N-二甲氨基乙酯(PDMAEMA)和阴离子聚丙烯酸(PAA),在荷负电的聚酰胺(PA)反渗透膜表面层层自组装制备出PDMAEMA/PAA复合膜,通过增加膜表面亲水性,提高了乙二醇脱水效率。王佳倩等[20]以聚乙烯亚胺(PEI)的乙醇溶液作为电解质溶液,采用部分嵌入式静电自组装法对聚酰胺反渗透膜进行改性,通过改变反渗透膜表面电性,显著提高了膜的通量。姬存睿[21]等以阳离子聚氮杂环丙烷和阴离子聚-4-苯乙烯磺酸钠,在聚丙烯腈基膜上用层层自组装和界面聚合制备双选择层正渗透膜,提供了一种新的正渗透膜工艺。职瑞[22]等以聚乙烯亚胺(PEI)为阳离子聚电解质,聚(4-苯乙烯磺酸钠)(PSS)为阴离子聚电解质,在聚丙烯腈(PAN)超滤膜上采用层层自组装和界面聚合的方法制备了具有双层分离层的复合纳滤膜。
而天然聚电解质材料多具有良好的生物相容性,加上成膜条件温和,更适合于生物医药领域应用。例如,陈静怡[23]等以天然聚电解质海藻酸钠和壳聚糖为囊材,以积雪草苷为模型药物,利用薄膜分散法制备阳离子模板脂质体和吸附脂质体,再将海藻酸钠和壳聚糖自组装成膜包埋脂质体得到新型药物载体。Han[24]等将万古霉素(VAN)接枝的氧化海藻酸钠(OSA)和壳聚糖包覆的牛血清白蛋白纳米粒(CBSA NPs)层层组装到多孔钛支架上,并且插入了骨形态发生蛋白-2(BMP2),成功构建了具有抗菌和促细胞生长双重功效的药物支架。蔡杰慧[25]等采用离子交联法制备载盐酸小檗碱的海藻酸钙/壳聚糖盐酸盐(ALG-Ca/CHI)模板微球,再将羧甲基纤维素钠(CMC)和CHI组装其上制得载盐酸小檗碱微球。
Xu[26]等通过基底在MMT 溶液和 PLL-GS 溶液中的交替层层组装制备了蒙脱石/聚-L-赖氨酸-硫酸庆大霉素的有机-无机混合多层膜(MMT/ PLL-GS)8。实验发现多层膜逐渐降解的原因是因为细菌感染或胰凝乳蛋白酶(CMS),表现出的性质是按需要程度各自释放,性能是具有抑制生物膜形成和长期抗细菌黏附。
1.4 聚电解质自组装膜的制备
制备层层自组装膜常用的方法是浸泡自组装法,它的优点是操作过程简单,不需要特殊设备就可以制备多层膜,但是缺点是制备效率过低。为了提高多层膜的制备效率,又发展出了喷涂技术及旋涂技术两种制备层层自组装膜的方法[19]。
1)浸泡自组装法
图1[27]所示为通过浸泡自组装法制备多层膜的过程。
该过程具有以下优点:a.可以在任何带电荷的基材上进行组装,且对基材的形状大小没有要求,可以根据实际需求进行改性并且可以使用多种水溶性的聚电解质材料;b.操作简单,整个组装过程中不需要复杂的仪器,可应用于大规模的工业生产;c.便于控制多层膜的膜厚,由于每层的浸泡时间一致,因此每一种聚电解质形成的单层厚度一致[19]。
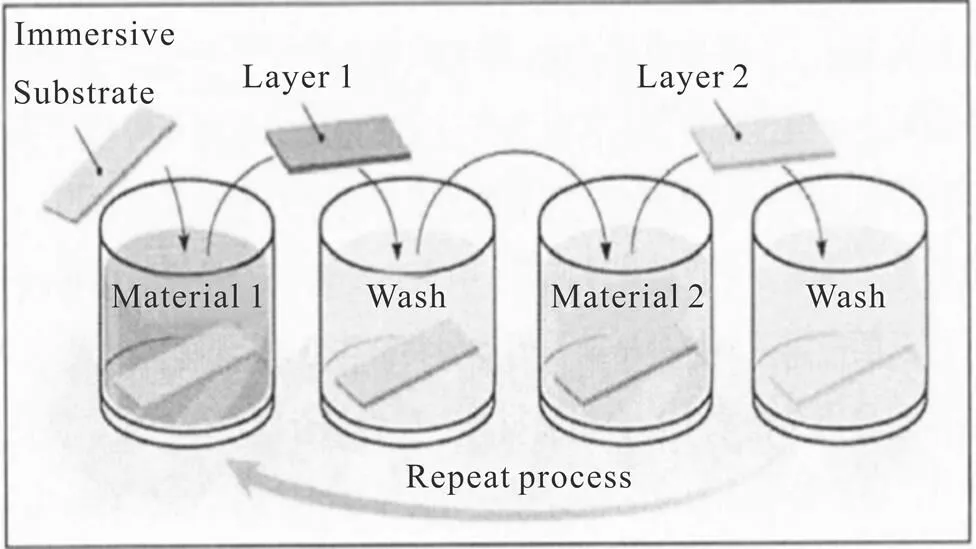
图1 浸泡组装多层膜示意图
2)喷涂自组装法
层层自组装的另一种方法是喷涂自组装技术(Spray assembly)(图2)。喷涂自组装法形成的膜的表面特性、均一性、形态和浸泡自组装法形成的膜相似,喷涂时间、溶液浓度、喷涂速度等因素决定了膜的厚度,由于溶液受到重力的影响,喷涂形成的膜不均一,可以在喷涂时通过旋转基片使形成的膜更均一。喷涂自组装技术也可以形成多层膜,速度比浸泡组装法快。
自动喷涂自组装和卷对卷自组装可以连用,通过自动化操控可控制成膜质量且节省时间,因此被广泛应用与工业中。[28]
3)旋涂自组装法
旋涂自组装技术(Spinassembly)是通过旋转基底来沉积材料的一种层层自组装方法(图3)。一种是先将材料溶液组装在静止的基片上,然后基片旋转完成;另一种是在旋转的基片上完成自组装[29]。该方法缩短了自组装的时间,一般只需要30 s左右。而且,标准的旋转镀膜机适用于平面的基底,旋转装置可以实现自动化。研究报道,聚合物的浓度和接触角相同的情况下,同样用自动化的旋转装置和浸泡机器自组装多层膜,旋涂组装多层膜更光滑、更薄[30]。还有一种旋涂自组装的方式为“高重力组装”,其通过可控吸附的旋转速度,且速度是浸泡自组装的5倍,此外,聚合物之间的结合呈现为指数型增长,而浸泡自组装呈现为直线型增长,膜的粗糙程度降低了5~10倍[31]。
2 聚电解质自组装膜用于固定化酶的研究
聚电解质自组装膜因具有膜厚度可调控、制备效率高和操作简便等优点,所以备受科研人员的重视,且在生产生活中已经有了较多的应用,例如:在多孔基膜上进行涂覆,制备具有致密表层的PAA及PEI复合膜,用于气体分离、反渗透、渗透汽化等领域的分离[32];制备了壳聚糖-聚丙烯酸、透明质酸(HA)-壳聚糖(CS)等自组装膜用于生物医药领域的医用膜、药物缓释膜,防止纤维蛋白的吸附[33],增强抗血栓性、促进伤口愈合。
另外,聚电解质自组装膜还可以作为载体用于固定化酶催化反应。
利用酶或者生物有机体(全细胞、细胞器、组织等)作为催化剂的生物催化技术,是当前国际公认最绿色的化学转化技术之一,可以大量减少原材料的消耗和污染物排放,不但缓解环境问题,而且成本也会降低,产生显著的经济效益。
目前,酶催化技术已经替代一些传统化学反应,大量应用于纺织、造纸、石油、食品、饲料、洗涤等行业生产过程中。但是,游离酶对所处的环境十分敏感,在高温、强酸、强碱、高离子强度及有机溶剂中稳定性较差,而且不易回收再利用,混入产品后纯化困难,不易分离,极大限制了酶在更多领域的应用[34]。为此,人们研发了固定化酶技术,即通过物理或化学手段,将酶固定在载体表面或内部完成酶催化反应,成为解决上述问题的一个有效手段[35]。尽管只有20% 的工业生物催化过程利用了固定化酶,但它是酶工业化应用的发展的重要方向[36]。
固定化酶的载体形式有很多,主要是基于各种无机或有机高分子材料的微球/微囊或膜[37]。例如,固定化酶膜反应器(EMRs)可以将酶的催化功能和膜的分离功能结合起来,实现反应和分离耦合,既利于反应平衡向产物侧偏移,并简化工艺过程,降低生产成本。
自组装法也适用于固定化各种类型的酶蛋白[38]。雷文茜等[39]以聚丙烯酸(PAA)和聚乙烯亚胺(PEI)为构筑单元,运用层层自组装技术制备了聚电解质多层膜,能够简单有效地通过毛细作用力将溶菌酶负载并固定于多层膜中,为制备基于抗菌蛋白的抗菌涂层提供了新的方法。彭京蒙[40]等采用层层自组装法制备普鲁士蓝薄膜,同时基于戊二醛交联法在薄膜上固定葡萄糖氧化酶,从而构建一种高灵敏度、低成本的葡萄糖生物传感器。普鲁士蓝立方结构有利于薄膜催化活性的提高,而戊二醛交联法可有效用于酶的固定并保持酶的活性,从而提高传感器的灵敏度和稳定性。Huang等[41]用层层自组装技术对生物活性物质进行了固定化。采用带负电的电纺CA膜作为基体,带负电荷的海藻酸钠和带正电荷的溶菌酶-壳聚糖-有机累托石复合材料固定于基体表面,提高了对大肠杆菌和金黄色葡萄球菌的抗菌效果。
层层自组装法作为一种重要的薄膜制备技术,可以在不同大小和形状的基底上操作。通常,分为两种,一种是平板膜,一种是微囊膜;“平板膜”是在膜基上进行自组装形成的薄膜,“微囊(或微囊膜)”是以胶体粒子等为模板进行自组装形成的薄膜。
2.1 自组装平板膜固定化酶
对于酶催化而言,因为酶是多电荷大分子,因此静电吸附是酶固定化的最简便的方法之一。在膜的不同位置(表面或内部)进行酶固定化能使反应物和产物通过催化载体,反应进行的同时若能及时分离出产物,此种酶固定化方法意义重大。
Joseph N[38]等报道了过氧化物酶-聚苯乙烯磺酸钠(POD-PSS)复合物与聚丙烯胺(PAH)在聚碳酸酯膜(PC)上交替组装得到多层酶膜用于生物催化的研究。结果表明:在PC膜上组装的酶膜的活性要高于在无孔载体上组装的酶膜的活性。
Guedidi[42]等采用层层自组装法在聚丙烯腈(AN 69)膜基上进行了尿素酶(545 kDa)和胰蛋白酶(23.8 kDa)的固定化研究。大尺寸的尿素酶仅固定在膜的外表面而小尺寸的胰蛋白酶固定在膜的孔内部和外表面。结果表明,酶固定在膜的中间层时具有较高的稳定性;酶固定在膜外表面时具有较高的催化活性。
李辉[43]等利用静电层层自组装方法在固体基底(云母片) 上制备了阳离子聚丙烯酰胺(CPAM)/漆酶自组装膜,CPAM/漆酶自组装膜的活力随着自组装层数的增多呈线性增长;漆酶在自组装膜中排列有序;固定化漆酶的最适温度为 50 ℃,比游离漆酶高5 ℃,热稳定性明显提高。
韩平平[44]等在荷负电的磺化聚醚砜(SPES)基膜上组装荷正电的聚(二烯丙基二甲基氯化铵)(PDDA),实现第一层组装;进而利用静电吸附作用在PDDA层上组装荷负电的α-葡萄糖转苷酶(αG),得到固定化酶薄膜(SPES-PDDA-αG);最后,对αG酶组装层进行戊二醛交联处理或第二层PDDA组装,分别得到两种类型的固定化酶薄膜,记为SPES-PDDA-αG-GA 和SPES-PDDA-αG-PDDA。结果表明:酶位于组装层的最外层具有更高的酶活,而酶位于中间层时则表现出更高的稳定性。
孙伯旺[45]等将聚(甲基丙烯酸-衣康酸)(IA-MAA)、聚乙烯吡咯烷酮(PVP)和N,N-二甲基甲酰胺混合得到铸膜液;采用流延法制成平板膜;将带有膜液的平板膜沉浸在凝胶浴中,固化成膜。本发明的固定化载体为相转换法制备的聚(甲基丙烯酸-衣康酸)膜,通过壳寡糖改性和戊二醛活化后高效地固定化脂肪酶,该方法操作简单、材料本身性能稳定,可大大提高酯交换反应的选择性,具有良好的工业应用前景。
娄倩芳[46]等以聚丙烯腈平板膜(PAN)为载体,采用吸附法固定化海藻糖合成酶粗酶液。通过单因素法探讨最佳固定化条件,并分析固定化酶酶学性质。结果表明,与游离酶相比,固定化酶热稳定性提高。在目前已报道的固定化海藻糖合成酶催化反应中副产物含量最低。
2.2 自组装微囊膜固定化酶
通过LbL法将聚电解质(或无机颗粒等组装单元)沉积到可被去除的胶体颗粒组装模板上,最后有选择性地将该胶体颗粒分解或溶解——层层自组装微囊的制备[5]。
LbL层层自组装方法制备的微囊具有高度的可控性,例如通过改变环境条件和组装次数可精确控制囊壁厚度及通透性,不同的模板粒子可控制载体的尺寸大小。因此利用LbL微囊进行大分子的包埋,例如蛋白质及其他具有生物活性的材料,在纳米技术和医药领域中引起了极大的影响——它为该系统作为微米及纳米载体用于药物传递、控制释放和生物催化提供了可能[7]。
Yu等采用层层自组装法制备高载酶微囊,以介孔硅(MS)作为牺牲模板。通过层层组装聚赖氨酸(PLL)和聚谷氨酸(PGA),组装一定层数,最后利用HF/NH4F缓冲液(pH5.0)去除硅核得到载酶的(PLL/PGA)微囊[47]。该方法对酶固定化有重大影响(1)它能够通过调节盐浓度和溶液pH值将包埋的酶释放出来;(2)它使包埋到微囊中的酶的尺寸扩展到40 nm;(3)它解决了酶固载到固体表面所带来的酶易脱附的问题;(4)它并不局限于可结晶的或是通过中空聚电解质微囊的壳层性质来影响其包埋的酶。
Abdekhodaiea等[48]利用壳聚糖-海藻酸钙为壁材,采用内源乳化法对葡萄糖氧化酶进行了包埋,并针对其对癌细胞的作用进行了体外及体内研究,体外研究表明,在葡萄糖糖化酶的负荷水平相同的情况下,直径较小的葡糖糖氧化酶微球比直径较大的葡糖糖氧化酶微球能杀死更多的癌细胞,这是因为直径较小的葡糖糖氧化酶微球能产生更多的H2O2。
侯晨等[49]以碳酸钙微球为模板合成了结构强韧的有机-无机磁性杂化微囊固定化酶。在该聚合物微囊中引入磁性Fe3O4纳米颗粒具有重要意义:既为微囊提供了刚性支架,避免聚合物微囊的塌陷、褶皱而且对固定化酶的回收和再利用提供了便利。通过对固定化酶的性质进行研究,发现该微囊固定化酶具有诸多优点:较高的酶催化反应活力、酶包裹率和储存稳定性,同时也表现出优良的动力学行为和重复使用性。
Choong Hey Ng[50]用十六烷溶解脂肪酶,再用海藻酸钙胶珠固定化脂肪酶,此方法可以使0.5 mmol丁酸和1.5 mmol丁醇发生原位酯化反应生产0.16 mmol丁酸丁酯。十六烷作为有机相促进酯化反应的进行。传统的水相胶珠只产生痕量的丁酸丁酯,两相的胶珠就提高了产率且可以同时进行发酵和酯化反应。
本课题组采用乳化内部凝胶法制备海藻酸钙-壳聚糖自组装微胶囊膜载体,固定化脂肪酶,其酶活可达14 280 U·g-1,比游离脂肪酶的酶活提高40%。这说明游离酶载实际催化反应对外部环境较为敏感,失活严重,而固定化脂肪酶可提供一个保护外壳,缓冲外界环境对脂肪酶的破坏,尽可能地保留酶的最大活性。
3 结语与展望
诸多因素会影响到聚电解质层层自组装过程,包括聚电解质溶液的离子强度、pH、涂覆时间、涂覆层数等。目前国内外许多学者已经深入研究了聚电解质的成膜机理、材料、影响因素等,但是,由于聚电解质材料组成和结构具有明显差异性,且阴阳离子聚电解质组合方式众多,再加上工艺参数的影响、应用目的的不同、膜材料与包埋物之前的相互作用等多方面因素,导致制备的聚电解质自组装膜的结构和性能有很大差别,需要大量实验摸索最佳的制膜条件与过程,较难实现结构与性能的有效调控。
此外,传统的自组装法制膜制备的周期复杂且耗时长,往往需要涂覆十几层乃至几十层聚电解质,且单层涂覆时间超过30 min,难以进行工业化生产。静电层层自组装过程的驱动力为正负电荷的静电吸引作用,因此可通过辅助电场改进组装方法,简化组装过程。
酶固定化使酶得到了更充分广泛的利用,载体材料的选择是酶固定化的关键所在。保证酶高效应用的关键步骤是在保持酶生物活性不变的前提下,将酶高度有序、稳定地固定在固体基底上。为了酶更好的应用于工业化,还需对酶构建层层自组装膜深入研究,从而为工业生产提供可行性依据,创造更多有价值的产品。
[1] 关英, 张拥军, 张文静, 等. 层层自组装膜的研究: 从基础到生物医学领域中的应用[J]. 高分子通报, 2013 (1): 40-52.
[2] ZIMNITSKY D, JIANG C, XU J, et al. Substrate-and time-dependent photoluminescene of quantum dots inisde the ultrathin polymer LbL film[J]., 2007, 23 (8): 4509-4515.
[3] FUJII A, MARUYAMA T, OHMUKAI Y, et al. Cross-linked DNA capsules templated on porous calcuim carbonate microparticles[J].:2010, 356 (1): 126-133.
[4] 张仲达, 杨文芳. 层层自组装技术的研究进展及应用情况[J]. 材料导报, 2017, 31 (5): 40-45.
[5] BERTRAND P, LEGRAS R, JONAS A M, et al. Ultrathin polymer coatings by complexation of polyelectrolytes at interfaces: suitable materials, structure and properties[J]., 2015, 21 (7): 319-348.
[6] JIA Q, HU Z X, JI W, et al. Adsorption of PTCDA and C-60 on KBr (001): electrostatic interaction versus electronic hybridization[J]., 2016, 18: 11008-16.
[7] 张春红. 层层自组装聚电解质膜及杂化微囊固定化酶的研究[D]. 天津大学, 2013.
[8] SCHUSTER P, WOLSCHANN P. Hydrogen bonding: from small clusters to biopolymers[J].. 1999, 130: 947-60.
[9] KHARLAMPIEVA E, KOZLOVSKAYA V, SUKHISHVILI S A. Layer‐by‐Layer Hydrogen‐Bonded Polymer Films: From Fundamentals to Applications[J].. 2009, 21: 3053-3065.
[10] LIN J B, WU J, JIANG X K, et al. Dynamic covalent self-assembly of monobi-and trimacrocyles from hydrogen bonded preorganized templates[J].. 2009, 27: 117-22.
[11] WANG Q Q, WANG H M, FAN X, et al. Biological recognition with bio-inspired smart nanopores and nanochannels based on polymer membrane[J]., 2015, 7: 2147-67.
[12] PODSIADLO P, MICHEL M, LEE J, et al. Exponential Growth of LBL Films with Incorporated Inorganic Sheets[J]. NANO LETTERS, 2008, 8 (6): 1762-1770.
[13] LIU G, ZOU S, FU L, et al. Roles of Chain Conformation and Interpenetration in the Growth of a Polyelectrolyte Multilayer[J]., 2008, 112 (14): 4167-4171.
[14] LADAM G, SCHAAD P, VOEGEL J C, et al. In Situ Determination of the Structural Properties of Initially Deposited Polyelectrolyte Multilayers[J]., 2000, 16 (3): 1249-1255.
[15] SCHOELER B, POPTOSHEV E, CARUSO F. Growth of Multilayer Films of Fixed and Variable Charge Density Polyelectrolytes: Effect of Mutual Charge and Secondary Interactions[J]., 2003, 36 (14): 5258-5264.
[16] LONGCHAMP D M, KASTANTIN M, HAMMOND P T. High-Contrast Electrochromish from Layer-By-Layer Polymer Films[J]., 2003, 15 (8): 1575-1586.
[17] VILLIERS M M, OTTO D P, STRYDOM S J, et al. Introduction to nanocoatings produced by layer-by-layer (LbL)self-assembly[J]., 2011, 63 (9): 701-715.
[18] CHEN D D, WU M D, LI B C, et al. Layer-by layer-assembled healable antifouling films [J]., 2015, 27 (39): 5882-5888.
[19] 郭雪. 层层自组装复合膜的制备及其渗透汽化性能研究[D]. 天津工业大学, 2019.
[20] 王佳倩, 王书浩, 沈红梅, 等. 部分嵌入式静电自组装改性聚酰胺反渗透膜[J]. 高校化学工程学报, 2019, 33 (2): 475-482.
[21] 姬存睿, 王旭东, 张慧慧, 等. 双选择层复合正渗透膜制备及其表征[J]. 水处理技术, 2018, 44 (9): 51-55.
[22] 职瑞, 王磊, 王佳璇, 等. 双分离层复合纳滤膜的制备及其性能[J]. 环境工程学报, 2018, 12 (6): 1600-1608.
[23] 陈静怡, 任翔, 彭倩, 等. 层层自组装法制备脂质体为模板的积雪草苷镶囊[J]. 武警后勤学院学报(医学版), 2018, 27 (2): 116-120.
[24] HAN L, WANG M, SUN H, et al. Porous titanium scaffolds with self-assembled micro/nano-hierarchical structure for dual functions of bone regeneration and anti-infection[J]., 2017, 105 (12): 3482-3492.
[25] 蔡杰慧, 杨英全, 许丹妮, 等. 层层自组装载盐酸小檗碱微球的制备及释药性研究[J]. 广州化工, 2018, 46 (16): 58-61.
[26] XU Q, LI X, JIN Y, et al. Bacterial self-defense antibiotics release from organic-inorganic hybrid multilayer films for long-term anti-adhesion and biofilm inhibition properties[J]., 2017, 9 (48): 19245-19254.
[27] 朱晓楠. 自组装制备渗透汽化脱盐膜[D]. 北京: 北京化工大学, 2014.
[28] 张芳芳. 聚电解质多层膜基片流动ELISA系统的研究[D]. 北京化工大学, 2016.
[29] CHO J, CHAR K, HONG J D, et al. Fabrication of highly ordered multilayer films using a spin self-assembly method[J]., 2001, 13 (14): 1076-1078.
[30] SEO J, LUTKENHAUS J L, KIM J, et al. Effect of the layer-by-layer (LbL) deposition method on the surface morphology and wetting behavior of hydrophobically modified PEO and PAA LbL films[J]., 2008, 24 (15): 7995-8000.
[31] JIANG C, LIU X, LUO C, et al. Controlled exponential growth in layer-by-layer multilayers using high gravity fields[J]., 2014, 2 (34): 14048-14053.
[32] LENK W, MEIERHAACK J. Polyelectrolyte multilayer membranes for pervaporation separation of aqueous-organic mixtures[J]., 2002, 148 (1): 11-16.
[33] SAMANTA H S, RAY S K. Controlled release of tinidazole and theophylline from chitosan based composite hydrogels[J]., 2014, 106: 109-120.
[34] 吴蓉, 董其惠, 孙伊伊, 等. 吸附-纤维素覆膜联合固定化酶[J]. 高等学校化学学报, 2019, 40 (9): 1888-1896.
[35] RODRIGUES, RAFAEL C, ORTIZ, et al. Modifying enzyme activity and selectivity by. immobilization[J]., 2013, 42 (15): 6290.
[36] 靳春鹏, 彭海航, 许慧娜, 等. 酶的固定化专利技术分析[J]. 饲料研究, 2016 (4): 37-41.
[37] JOCHEMS P, SATYAWALI Y, DIELS L, et al. Enzyme immobilization on/in poly-meric membranes: status, challenges and perspectives in biocatalytic membr-ane reactors (BMRs)[J]., 2011, 13 (7): 1609-1623.
[38] JOSEPH N, AHMADIANNAMINI P, HOOGENBOOM R, et al. Layer-by-layer preparation of polyelectrolyte multilayer membranes for separation[J]., 2014, 5 (6): 1817-1831.
[39] 雷文茜, 任科峰, 陈夏超, 等. 动态多孔海绵结构多层膜负载溶菌酶用于抗菌涂层的研究[J]. 高分子学报, 2017 (5): 744-751.
[40] 彭京蒙, 储震宇, 石磊, 等. 自组装普鲁士蓝膜修饰丝网印刷电极构建高灵敏生物传感器[J]. 南京工业大学学报(自然科学版), 2016, 38(4): 39-45.
[41] HUANG W, XU H, XUE Y, et al. Layer-by-layer immobilization of lysozyme-chitosan-organic rectorite composites on electrospun nanofibrous mats for pork preservation[J]., 2012, 48(2): 784-791.
[42] GUEDIDI S, YUREKLI Y, DERATANI A, et al. Effect of enzyme location on activity and stability of trypsin and urease immobilized on porous membranes by using layer-by-layer self-assembly of polyelectrolyte[J]., 2010, 365: 59-67.
[43] 李辉, 付时雨, 彭林才, 等. 漆酶的层层自组装固定化及其酶学性质[J]. 华南理工大学学报(自然科学版), 2011, 39(09): 158-164.
[44] 韩平平,张春红,田春勇,等. 高分子/酶层层自组装平板膜固定化酶研究[J].中国科技论文, 2015, 10 (06): 621-625.
[45] 孙伯旺, 陈方慧, 王明亮, 等. 一种聚(甲基丙烯酸-衣康酸)改性膜及其制备方法和应用: CN201910148928.7[P]. 东南大学, 2019.
[46] 娄倩芳, 李由然, 石贵阳. 聚丙烯腈膜固定化海藻糖合成酶的研究[J]. 食品与生物技术学报, 2019, 38 (2): 15-21.
[47] YU A, WANG Y, BARLOW E, et al. Mesoporous Silica Particles as Templates for Preparing Enzym-Loaded Biocompatible Microcapsules [J]., 2005, 17: 1737-1741.
[48] ABDEKHODAIE M J, CHENG J, WU X Y. Effect of formulation factors on the bioactivity of glucose oxidase? encapsulated chitosan-alginate microspheres: In vitro investigation and mathematical model predicetion[J]., 2015, 125: 4-12.
[49] 侯晨. 磁性酚类仿生粘附复合材料的制备及固定化脂肪酶研究[D]. 甘肃: 兰州大学, 2016.
[50] NG C H, YANG K L. Lipase in biphasic alginate beads as a biocatalyst for esterification of butyric acid and butanol in aqueous media[J]., 2016, 82: 173-179.
Self-assembled Membrane With Polyelectrolytes and Its Application in Enzyme Immobilization
,
(School of Environmental and Chemical Engineering, Dalian University, Dalian Liaoning 116622, China)
The layer-by-layer self-assembly of polyelectrolyte is a technology that uses the interaction of static electricity, hydrogen bonds, covalent bonds between molecules to assemble polymers into membranes. It has the advantages of controllable membrane composition and thickness, simple operation, and no need for special complex equipment, so it has a wide range of applications in many fields, such as medicine, biotechnology, device preparation, surface modification and so on. In this paper, the research progress in the driving force, growth mode, influencing factors, preparation materials and methods of self-assembled membranes was briefly described; the research of polyelectrolyte self-assembled membrane as a carrier immobilized enzyme and its application in biocatalytic conversion were summarized.
Polyelectrolyte; Self-assembled membrane; Enzyme immobilization; Enzyme catalysis
国家自然科学基金 (项目编号:21276033);辽宁省百千万人才工程资助项目(项目编号:辽百千万立项【2017】6号)。
2020-09-02
张鑫(1997-),男,研究生在读,硕士,陕西渭南市人,2020年毕业于大连大学学校化学专业,研究方向: 聚电解质自组装膜及酶固定化。
刘袖洞(1972-),男,教授,博士,研究方向:高分子材料及生物催化。
TQ050.4+25
A
1004-0935(2021)01-0020-07
