玉米花丝多糖的提取制备与抑菌作用研究
2021-02-22于小磊
于小磊, 孟 鑫, 丁 楠, 金 萍
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
玉米须多糖是禾本科植物玉蜀黍的花柱和柱头(称玉米须) 所含有的多聚糖,其大部分由已糖和戊糖聚合而成,在酸溶液中的最终水解产物为阿拉伯糖、木糖、半乳糖等。 玉米须多糖具有免疫活性,可降血糖、降血压、抗癌、抗菌等(陈圣阳等,2016)。 我国是玉米生产国之一,在我国现有的0.93 亿公顷耕地之中, 玉米面积约为0.21 亿公顷,占耕地面积的1/5。 所以玉米花丝资源非常丰富,且花丝容易采集,费用低,玉米花丝多糖在医药、食品工业中都有广泛应用,具有多种药理作用。 本文旨在优化从玉米花丝中提取花丝多糖的方法, 并对花丝多糖的抑菌作用进行研究。
1 材料与方法
1.1 材料与试剂 玉米花丝 (锦州医科大学农场);纤维素酶(北京奥博星生物技术有限公司);无水乙醇、95%乙醇、丙酮、无水乙醚、氯仿、异戊醇、三氯乙酸、甲醇、氢氧化钠、氯化钠均为分析纯;葡萄糖(食用级)、营养琼脂(北京陆桥技术有限责任公司);牛肉膏、半固体琼脂、琼脂粉(北京奥博星生物技术有限责任公司);胰蛋白胨(F802型);新鲜马铃薯(市售)。
1.2 仪器与设备 Sigma-3K15 高速冷冻离心机(德国);BL-320S 电子天平(日本岛津);微量移液器 (大龙医疗设备有限公司);RE-300 型旋转蒸发器 (上海亚荣生化仪器厂);SHB-III 型循环水式多用真空泵 (郑州长城科工贸有限公司);HH数显水浴锅 (金坛市金城国胜试验仪器厂);LDZX-40SC 型立式压力蒸汽灭菌器(上海申安医疗器械厂);DHP060 型恒温培养箱 (上海试验仪器厂有限公司);SW-CJ-2F(D)型生物洁净工作台(苏州市华宇净化设备有限公司)。
2 试验方法
2.1 工艺流程 玉米花丝多糖分离提取:玉米花丝→粉碎→酶法破壁→水浴提取→过滤→除杂质(醇沉,离心分离)→称重→纯化(离心分离)。
玉米花丝多糖抑菌作用: 配制浓度→制作培养基→活化菌种 (接种肉汤→斜面→肉汤)→平板划线→挑取单个菌落→摇动培养→平板涂布→量抑菌圈直径。
2.2 操作步骤
2.2.1 花丝粉碎破壁 先用剪刀将花丝按5 ~7 cm剪成数段,初步粉碎。再用榨汁搅拌机进行最后粉碎,最终成 1 ~ 2 mm 的粉状。 其中,新鲜花丝只进行初步粉碎(丁卫军和楚占营,2016)。 称取1.5 g花丝,按相应比例加水,使花丝充分浸透,配制成溶液。为使新鲜花丝与干花丝(半老花丝、老花丝)多糖含量相同, 须知道新鲜花丝干燥失水后的得率。 新鲜花丝400 g 干燥后得干花丝52.98 g,计算得率:52.98 g/400g=13%。 即100 g 新鲜花丝中多糖含量相当于13 g 干花丝的含量。
酶解破壁:向上述溶液中加入12%的纤维素酶,50 ~ 60 ℃ 水浴 2~ 3 h。 期间剧烈振荡,使花丝破壁充分。
2.2.2 多糖提取正交试验设计 在玉米花丝多糖的提取中,选择花丝种类、水和花丝的比例、水浴温度以及水浴时间4 个因素,各取3 个水平,进行4 因素 3 水平正交试验设计 L9(34)(表1)。 平行做两次提取率计算,然后对结果进行分析,并确定出最优方案。

表1 正交试验因素水平
2.2.3 多糖的分离纯化 分离: 将花丝多糖的浸提液用60 目尼龙网过滤,弃掉残渣,取滤液。合并滤液, 利用旋转蒸发仪浓缩至1/2 ~1/3 体积;4000 g/min 离心(6861 r/min)10 min,弃沉淀,取上清液;加入等体积的无水乙醇,振荡混匀,静置于冰上 10 min;5000 r/min 离心 10 min,弃上清液,取沉淀;加入4 mL 95%乙醇,摇匀,5000 r/min 离心10 min;取沉淀,加入2 mL 蒸馏水溶解,再加4 mL 95%乙醇,4000 r/min 离心 10 min;取沉淀,加入2 mL 无水乙醇洗涤, 摇动混匀,4000 r/min 离心10 min;取沉淀,加入 2 mL 丙酮:乙醚(1:1),摇动混匀,4000 r/min 离心 10 min;取沉淀,加入 2 mL蒸馏水溶解,再加入2 mL 三氯乙酸(或氯仿:异戊醇=24:1)洗涤,摇动混匀,4000 g/min 离心 10 min;取上清夜, 等体积加入95%乙醇, 摇动混匀,5000 r/min 离心10 min。 此时所得沉淀即为花丝粗多糖(张翠香等,2017)。 收集沉淀,干燥,称重,去皮,计算质量(谭志灿等,2015)。
纯化: 收集粗多糖溶液于锥形瓶中, 剧烈振荡,分装 10 mL 离心管,3000 r/min 离心 6 min,上清液转入新的锥形瓶中, 沉淀加入4 mL 无水乙醇,聚集到一管内,6000 r/min 离心 10 min(姚秋萍和姬青松,2015)。 收集沉淀,标记为 F。
甲醇分级沉淀: 纯化上清液, 并收集沉淀物(马福敏和刘玉玲,2016)。 每 10 mL 离心管装入4 mL 粗多糖溶液(上述上清夜),方法见表2。对于沉淀 A、B、C(同 F),用无水乙醇剧烈振荡后,洗入10 mL 离心管中,6000 r/min 离心 10 min, 最终分别并入一管。 对沉淀物进行沉重、去皮,得纯化后多糖质量(王博等,2016)。 4 种多糖(F、A、B、C),按20、40、60、80、100、120 mg/mL 配制多糖浓度。

表2 甲醇分级沉淀法
2.2.4 抑菌试验 菌种活化:在无菌操作下,将未开封的菌种开封,加入生理盐水微溶,挑取一环于营养肉汤中;已开封且用石蜡保存的,倒出石蜡,挑取 2 环于营养肉汤中,37 ℃、24 h 培养。再反复接种肉汤、斜面,37 ℃、24 h 培养,增强菌种活力与纯度(吴盼盼等,2015)。真菌从玉米叶上剪下,用生理盐水溶解浸泡,再培养(真菌27 ℃培养48 h)(李月等,2017)。
抑菌部分:在无菌操作下,挑取一环肉汤中的菌液,平板划线于琼脂平板上,37 ℃培养24 h。从平板上挑取单个菌落, 置营养肉汤中,37 ℃摇动培养 24 h,制成菌悬液(李月等,2017)。 先以沙门氏菌做尝试,确定有抑菌效果的多糖及浓度。同时用0.85%的灭菌生理盐水将菌悬液稀释10 倍至1×10-1稀释度(周海嫔等,2018)。 用微量移液器吸取0.1 mL 上述菌悬液加入营养琼脂培养基表面,用L 棒涂抹均匀,制成含菌平板。 取直径5 ~6 mm的无菌滤纸片放入不同多糖的不同浓度中浸泡10 min, 用无菌镊子取出浸泡过的滤纸片贴在含菌平板上(王凯等,2015)。事先标记好与多糖及浓度相对应的记号,每皿贴3 片(φ75),并做一次平行试验。 然后用保鲜膜密封,置37 ℃培养箱倒置培养24 h,测定滤纸片的抑菌圈的大小,确定有效的具体多糖及具体浓度。 对照用无菌水和花粉多糖(浓度为50 mg/mL)各做一平板(GuO 和Beta,2013)。 剩下的菌按此多糖和浓度,再进一步细化浓度,重复上述方法作抑菌试验。测定滤纸片的抑菌圈大小,比较抑菌效果。
3 结果与分析
3.1 正交试验 极差的大小可以反映各因素对花丝多糖提取的影响程度。 根据表3 的极差分析,可排出各因素的顺序:B(水和花丝的比例)>C(水浴温度)>A(玉米花丝的种类)>D(水浴时间)。 因素 B第一水平为最好,即水和花丝比例为1:6,超过这个比例多糖的提取率不会提高。 因素C 以第三水平为最好,低于这个温度(60 ℃)多糖的提取效果会变差,超过此温度易使多糖变性。 因素A 以第三水平为最好, 新鲜花丝和半老花丝的提取得率不高。 因素D 以第二水平为最好, 即较为合适,多于或少于这个时间,并不会使多糖得率提高。因此,玉米花丝多糖提取的优化条件为:B1C3A3D2。
3.2 抑菌试验 成品多糖呈棕黄色凝结状。 F 种加水后浑浊,棕色,壁上有粉粒未溶,静置后分层,上层为棕黄色清液,下层为大量沉淀。A 种加水后溶解,微浑浊,土黄色,静置,底部有少量沉淀析出。B 种加水后全溶,乳白色泛黄,静置,底部有极微量沉淀析出。 C 种加水后全溶,乳白色微黄,静置,无沉淀析出。
3.2.1 4 种玉米花丝多糖对沙门氏菌的抑菌结果花粉多糖的抑菌圈直径为11.5 mm, 花丝多糖的抑菌效果与其差异并不大, 而无菌水的抑菌圈直径为5 mm,无抑菌效果。 其中滤纸片直径5 mm。另外,4 种玉米花丝多糖对沙门氏菌的抑菌结果见表4。F 种、A 种多糖无效果,抑菌圈直径均为滤纸片直径,即5 mm。但是B 种、C 种多糖对抑菌有显著效果。 浓度效果虽差异不大,但在40 mg/mL浓度具有明显分界,此后抑菌圈直径都稍有增大。将 B 种、C 种多糖浓度细分至 20、30、40 mg/mL,用此做剩下7 种细菌和4 种真菌的抑菌试验。

表3 正交试验结果

表4 玉米花丝多糖对沙门氏菌的抑菌结果(抑菌圈含滤纸片直径) mm
3.2.2 玉米花丝多糖B 对各细菌的抑菌结果 由表5 可知,B 种玉米花丝多糖对革兰氏阳性菌和革兰氏阴性菌都有抑菌效果, 并且随着多糖浓度的提高,抑菌能力明显增强。 其中对痢疾志贺氏菌的抑制作用好于其他菌,其次为绿脓假单胞菌。 而对变形杆菌和枯草芽孢杆菌的抑制作用稍差。 表中未明显表明, 玉米花丝多糖B 对革兰氏阴性菌的抑制作用要好于革兰氏阳性菌, 但革兰氏阳性菌(沙门氏菌、痢疾志贺氏菌)对花丝多糖更敏感。

表5 玉米花丝多糖B 对各细菌的抑菌结果(抑菌圈含滤纸片直径) mm
3.2.3 玉米花丝多糖C 对各细菌的抑菌结果由表6 可知,C 种玉米花丝多糖对革兰氏阳性菌和革兰氏阴性菌都有抑菌效果, 并且随着多糖浓度的提高,抑菌能力明显增强。其中对枯草芽孢杆菌和绿脓假单胞菌、 金黄色葡萄球菌的抑制作用明显,其余菌稍差,大肠杆菌次之。 表6 未能表现出花丝多糖C 对革兰氏阳性菌和革兰氏阴性菌哪种抑制作用更明显,均有敏感菌。
3.2.4 玉米花丝多糖B 对各真菌的抑菌结果由表7 可知,B 种玉米花丝多糖对各种玉米常见真菌病菌均有抑菌效果, 并且随着多糖浓度的提高,抑菌能力明显增强。 其中花丝多糖B 对丝黑穗病菌真菌抑制作用较好,其余真菌对B 种多糖不敏感。 在20 mg/mL 浓度下,玉米花丝多糖B 对各真菌的抑菌结果为: 丝黑穗病菌>玉米小斑病菌>玉米大斑病菌>玉米条锈病菌。
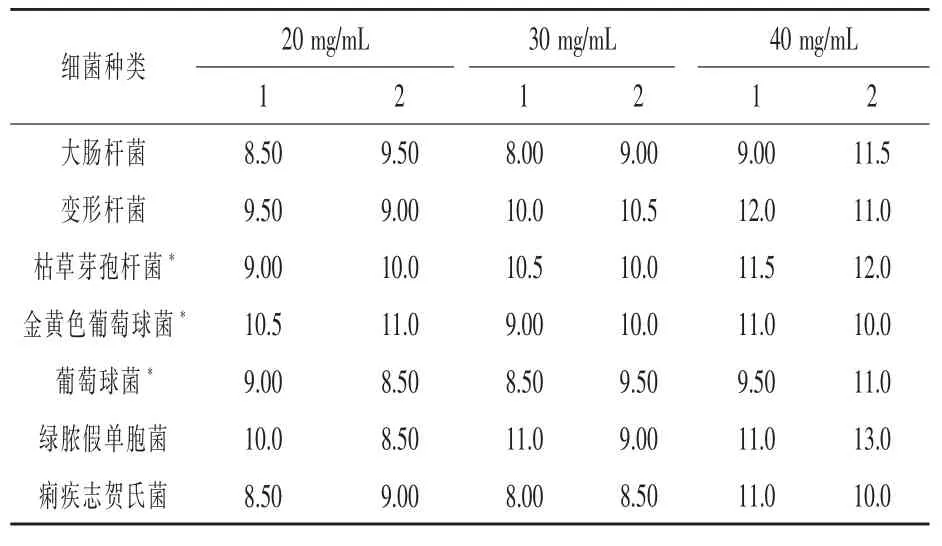
表6 玉米花丝多糖C 对各细菌的抑菌结果(抑菌圈含滤纸片直径) mm

表7 玉米花丝多糖B 对各真菌的抑菌结果(抑菌圈含滤纸片直径) mm
3.2.5 玉米花丝多糖C 对各真菌的抑菌结果由表8 可知,C 种玉米花丝多糖对各种玉米常见真菌病菌均有抑菌效果, 并且随着多糖浓度的提高,抑菌能力明显增强。 其中花丝多糖C 对玉米小斑病菌抑制作用较好,其余真菌对C 种多糖不敏感。 在20 mg/mL 浓度下,玉米花丝多糖C 对各真菌的抑菌结果为: 玉米小斑病菌>玉米条锈病菌>丝黑穗病菌>玉米大斑病菌。

表8 玉米花丝多糖C 对各真菌的抑菌结果(抑菌圈含滤纸片直径) mmmm
玉米花丝多糖对细菌和真菌都有抑菌作用,广谱抗菌。 但相对于真菌,多糖对细菌的抑菌效果更强。
4 结论
本试验结果表明, 玉米花丝多糖提取的最佳方法为:采用老花丝,花丝与水比例为1:6,60 ℃水浴2.5 h,提取率为3.65%。 玉米花丝多糖对细菌有明显的抑制作用, 对真菌也有一定的抑制作用。 其中,以40%甲醇浓度,4000 r/min 和45%甲醇浓度,5000 r/min 进行离心分离的多糖对细菌和真菌的抑制效果较好。
