基于脑白质纤维密度成像研究胼胝体神经纤维密度随年龄变化的规律
2021-02-18张丽岩王舒皓
张丽岩 王舒皓
胼胝体是位于大脑纵裂底部最大的连合纤维,由连合左右半球皮质的纤维构成,主要与基本的认知能力有关,包括记忆力、注意力、语言和智力等。胼胝体从儿童期开始,经历青少年期直到成年,随着年龄的增长一直在增长[1]。胼胝体退变常常表现为语言明显缺乏逻辑、分析问题及解决问题的能力低下、社交及认知功能障碍。随着年龄的增长或疾病所致胼胝体的损害,个体可有情绪改变和意识障碍表现。进入老年期后胼胝体的体积开始缩小,其内部纤维出现减少,进而出现各种衰老的症状[1-4]。病理过程包括随着神经纤维的减少、脱髓鞘化的发生、神经纤维长度变短、排列紧密程度下降以及细胞外间隙的扩大等老化进程,成人脑白质也将随之发生相应的变化[2-5]。
弥散张量成像(diffusion tensor imaging,DTI)技术的应用使得针对白质纤维尤其是胼胝体的研究有了新的进展。但DTI技术有局限性,存在不能识别交叉纤维和空间分辨率低等其他问题,在判断及研究白质纤维方面只能做到半定量。脑白质纤维密度成像(track-density imaging,TDI)技术是在DTI技术上发展而来,在技术应用方面解决了交叉纤维的识别问题,同时能够提供定量的纤维密度测定,可以量化单位体素内神经纤维的密度,为研究白质纤维提供了新的方法。在以往的研究中通过大鼠的胼胝体成像验证了TDI的可行性与可靠性,但在正常人群的衰老方面尚未见相关应用的报道。为此,本研究采用3.0 T MRI对胼胝体进行研究,对不同年龄组别人群进行胼胝体体积的定量测定,同时比较DTI及TDI技术,进而反映衰老进程中的纤维密度变化的规律。
方 法
1.入组人员
在排除5名具有运动伪影者后,我们招募了131名健康志愿者(69名男性,62名女性)用于该研究。志愿者的年龄为21~79岁,平均(48.6±17.1)岁。排除标准包括可能产生痴呆的结构异常,如脑梗死、肿瘤、硬膜下血肿、脑外伤、癫痫、酒精中毒、精神疾病或其他可能影响大脑功能的全身性疾病。所有志愿者都是右利手。根据年龄分为6组:20岁组(20~29岁,n=24),30岁 组(30~39岁,n=22),40岁组(40~49岁,n=22),50岁组(50~59岁,n=21),60岁组(60~69岁,n=22),70岁组(70~79岁,n=20)。在MRI扫描之前从志愿者处获得使用数据的书面知情同意书。
2.MRI检查方法
使用3.0 T MR扫描仪(MAGETOM,Verio,Siemens Healthcare,Erlangen,Germany),具有32通道头部线圈。成像序列包括常规MR序列(T1加权成像,T2加权成像)和DTI序列。T1 3D轴向图像:视野(FOV)230 mm,重复时间/回波时间(TR/TE)1 500 ms/2.96 ms,翻转角9°,体素大小0.9 mm×0.9 mm×0.1 mm,层 厚1 mm。DTI:6个b值(b=0、500、1 000、1 500、2 000、2 500 s/mm2)和30个方向,FOV 230 mm,TR/TE 3 900 ms/109 ms,体素大小1.8 mm×1.8 mm×2 mm,矩阵变化128×128,层厚2 mm,层数25。
3.TDI图像处理
基于多方向弥散图像从光纤束跟踪图案生成超高分辨率TDI图像。TDI被重建为0.1 mm亚体素的高空间体素分辨率,并且与穿过相应体素的纤维束成比例。计算TDI图的步骤:①预处理;②通过多组织约束球面反褶积产生纤维取向分布(FOD)估计图,其具有从所有受试者估计的群响应函数;③将FOD图像登记到FOD模板,然后利用SIFT(scale-invariant feature transform,即尺度不变特征变换)和MRtrix包(http://www.mrtrix.org/)进行后处理和重建。最后,基于多个方向,生成0.1 mm相等的体素空间分辨率的纤维束密度(TDI)图(图1、2)。
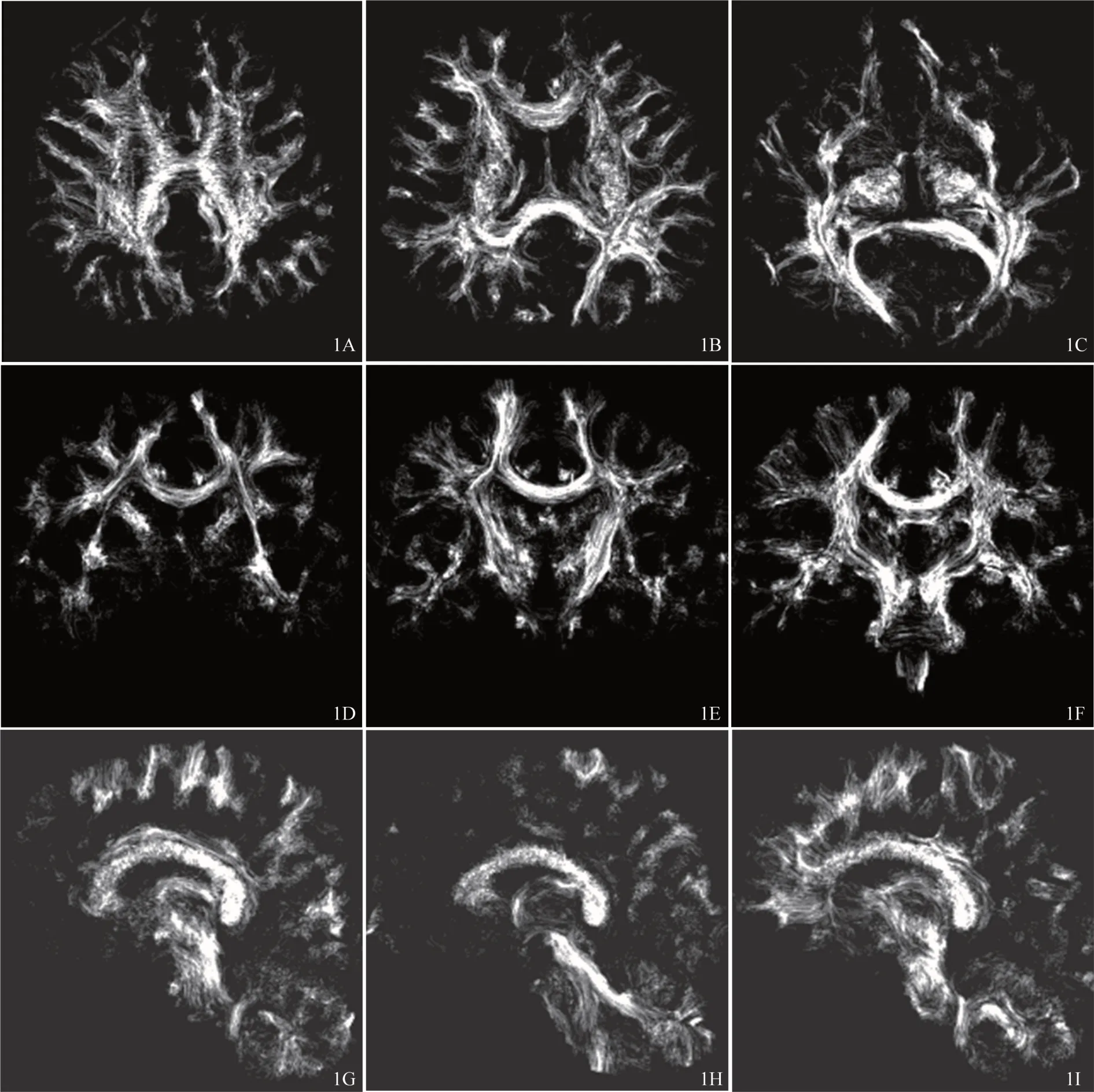
图1 受试者(31岁男性)经MRtrix package软件重建到0.1 mm的TDI横断位(A~C)、冠状位(D~F)和矢状位(G~I)方向3个层面图像
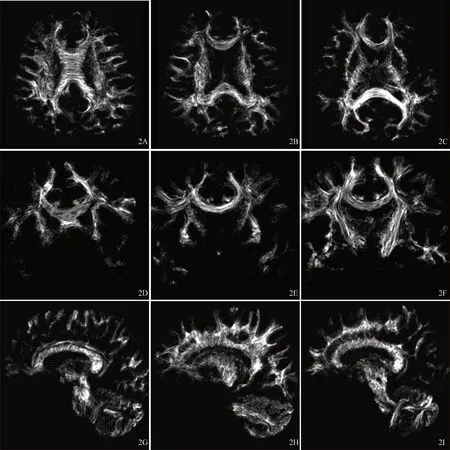
图2 受试者(61岁男性)经MRtrix package软件重建到0.1 mm的TDI横断位(A~C)、冠状位(D~F)和矢状位(G~I)方向3个层面图像
T1W MPRAGE上概述的ROI转移到TDI并使用Slicer软件(www.slicer.org)进行测量。提取CC并将其分割成根据Hofer和Frahm(图3)引入的最常见CC形态测定方案定义的5个子区域。Hofer方案采用4个冠状位分界线,从前到后,位于CC总长度的1/6、1/2、2/3和3/4处,将CC划分为5个部分,分别代表胼胝体膝部(CC1)、中间体的前部(CC2)、中间体的后部(CC3)、峡部(CC4)和压部(CC5)[9-10]。
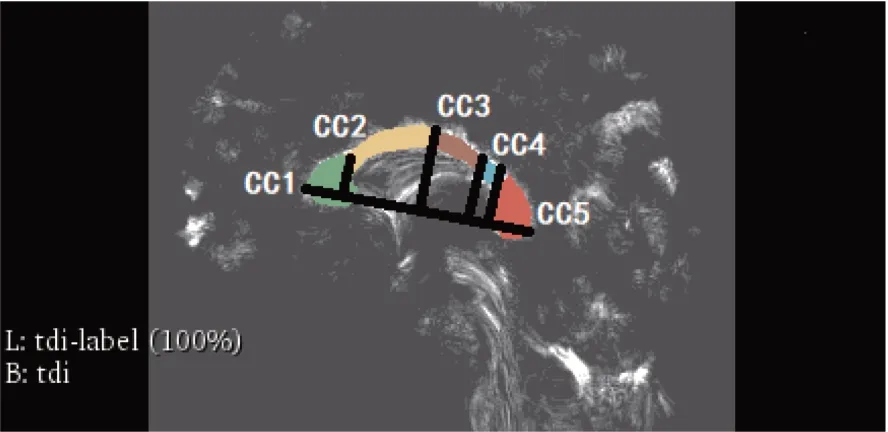
图3 胼胝体亚段的分割方法
4.胼胝体中线矢状量和各向异性分数(FA)测量
通过使用Slicer软件(www.slicer.org)从T1-3D图像和MRI数据重建CC的中线矢状面测量胼胝体中心矢状面的面积和FA值。
5.统计学分析
我们的研究是探索TDI/体积/FA值随老化的表现。所有这些值分别在胼胝体的5个子区域(CC1、CC2、CC3、CC4、CC5)中提取。当使用多重比较检验双因素方差分析来比较每个区域中不同年龄组和性别组之间的差异时,年龄因素和性别因素(P>0.05)没有相互作用。并且数据交叉组中方差检验(Levene's test)的同质性结果均为P>0.05(P<0.05水平为差异有统计学意义)。年龄组和性别群体是这种双因素方差分析的两个因素。Fisher-LSD检验用于校正不同年龄组TDI/体积/FA值的双样本t检验比较的多重比较。
结 果
1.TDI结果和多项式拟合结果随年龄增长
CC1:除外50岁组和60岁组(P=0.045),各组间CC1无明显差异。TDI值显示出60岁后呈下降趋势。CC2、CC3和CC4的TDI值均增加至40岁后减少。TDI值在40岁左右最高。CC2、CC3和CC4的多项式回归形成先上升后下降趋势。然而,在40和50岁组或50和60岁组之间,CC2 TDI无明显差异。在50至60年龄组,60至70年龄组之间CC3 TDI有明显差异(分别为P=0.039和0.003)。因此,CC3 TDI可能在30至40岁之间迅速增加,并且在40岁之后减少,在50岁下降迅速.与CC2、CC3和CC4的趋势不同,CC5的TDI 40岁后下降,随后随年龄增长而增加。即CC5形成先下降后上升趋势,逐渐下降后,在50、60和70年龄组增加趋势。详见表1、2。
表1 不同年龄段胼胝体5个亚段(CC1~CC5)的TDI±s

表1 不同年龄段胼胝体5个亚段(CC1~CC5)的TDI±s
a:20至70年龄组分别对应20~29岁、30~39岁、40~49岁、50~59岁、60~69岁、70~79岁年龄段。
年龄组a 20 30 40 50 60 70 n 24 22 22 21 22 20 TDI CC1 7.327 21±1.948 39 7.862 22±1.938 12 7.690 47±2.675 04 8.033 85±1.994 23 6.730 89±2.242 01 7.471 68±1.605 68 CC2 7.355 56±1.317 41 7.565 87±1.101 08 8.060 36±1.529 2 7.538 41±1.523 97 6.695 6±1.924 59 6.564 94±1.555 39 CC3 7.753 72±1.595 68 8.414 47±2.107 58 9.131 78±1.814 08 8.726 05±1.889 5 7.501 06±2.308 08 5.695 13±1.671 47 CC4 8.634 14±2.377 32 9.151 8±2.789 28 9.224 51±2.120 98 9.031 54±2.932 68 8.115 56±1.922 55 7.196 7±2.681 45 CC5 13.928 36±3.061 49 12.040 01±3.750 86 10.958 61±3.004 85 11.944 35±3.293 32 12.222 71±3.097 31 12.367 35±4.815 23

表2 不同年龄段胼胝体5个亚段(CC1~CC5)TDI在邻近年龄组之间的比较
2.体积测量和多项式拟合结果随年龄增长
在CC1中,相邻年龄组之间的体积没有明显差异(分别为P=0.954、0.269、0.775、0.540和0.361)。CC2仅在60和70岁组之间显示出明显的体积差异(P<0.001)。CC2量呈增长趋势,直至60岁,然后下降;但50岁组的CC2体积也略有下降。CC2的多项式回归显示出类似的结果。CC3仅在50和60岁组之间显示出明显的体积差异(P=0.008)。CC3体积在50和60岁之间明显下降,随后从60至70岁略有增加。CC4体积 在20和30岁组、30和40岁 组、40和50岁组、50和60数组之间显示出明显差异(分别为P=0.006、0.005、0.012和<0.001)。CC4体积随年龄显示出明显差异,并且在30至50岁之间增加,然后在50至60岁之间减少。CC4的多项式回归显示了类似的结果。相邻年龄组的CC5体积没有显着差异。详见表3、4。
表3 不同年龄段胼胝体5个亚段(CC1~CC5)的体积±s

表3 不同年龄段胼胝体5个亚段(CC1~CC5)的体积±s
a:20至70年龄组分别对应20~29岁、30~39岁、40~49岁、50~59岁、60~69岁、70~79岁年龄段。
年龄组a 20 30 40 50 60 70 n 24 22 22 21 22 20体积CC1 0.067 24±0.019 13 0.067 56±0.015 6 0.061 47±0.016 94 0.059 68±0.019 12 0.063 09±0.017 06 0.057 94±0.022 84 CC2 0.065 57±0.021 93 0.072 44±0.016 91 0.080 62±0.019 24 0.073 53±0.0179 7 0.085 76±0.014 47 0.062 94±0.019 25 CC3 0.034 21±0.014 22 0.038 67±0.008 59 0.038 91±0.008 36 0.039 16±0.010 69 0.030 58±0.008 46 0.036 58±0.010 55 CC4 0.024 2±0.007 57 0.019 48±0.005 74 0.024 45±0.004 4 0.028 87±0.007 35 0.019 38±0.003 57 0.019 56±0.003 73 CC5 0.073 28±0.019 28 0.085 6±0.015 18 0.085 39±0.025 25 0.089 31±0.024 35 0.087 07±0.020 96 0.081 87±0.026 04

表4 不同年龄段胼胝体5个亚段(CC1~CC5)体积在邻近年龄组之间的比较
3.FA数据和多项式拟合结果随年龄变化趋势
CC1的FA值随年龄增长缓慢下降;然而,仅在60和70岁组之间观察到显着差异(P<0.001)。从20岁到50岁组,CC2和CC5的FA值变化不显著,随后在60岁时显著下降(分别为P=0.013,P<0.001)。CC3的FA值显示略有增加直至40岁,然后降低;在60和70岁组之间观察到显著差异(P=0.021)。CC4组的FA值变化在20岁到50岁各组无明显变化趋势,在60岁组显著下降(P=0.002)。详见表5、6。CC1/CC2/CC3/CC4/CC5的多项式拟合形成了类似的结果。
表5 不同年龄段胼胝体5个亚段(CC1~CC5)的FA值±s

表5 不同年龄段胼胝体5个亚段(CC1~CC5)的FA值±s
a:20至70年龄组分别对应20~29岁、30~39岁、40~49岁、50~59岁、60~69岁、70~79岁年龄段。
年龄组a 20 30 40 50 60 70 n 24 22 22 21 22 20 FA值CC1 0.504 50±0.114 34 0.531 48±0.108 53 0.491 99±0.118 46 0.466 80±0.123 94 0.464 67±0.076 95 0.349 93±0.121 12 CC2 0.459 81±0.095 33 0.473 92±0.085 85 0.456 54±0.042 68 0.457 02±0.064 84 0.399 82±0.051 77 0.357 67±0.088 60 CC3 0.462 80±0.128 01 0.490 56±0.086 02 0.497 01±0.113 02 0.466 67±0.105 11 0.447 95±0.098 27 0.367 99±0.123 13 CC4 0.465 99±0.121 53 0.528 87±0.123 12 0.497 10±0.088 30 0.532 57±0.082 84 0.428 61±0.114 40 0.431 58±0.101 68 CC5 0.596 63±0.090 20 0.587 84±0.060 26 0.602 23±0.083 21 0.595 14±0.074 13 0.574 03±0.077 65 0.472 62±0.125 88
讨 论
在这项研究中,我们使用TDI技术来检测以每10岁为分组的几个年龄组的受试者组间的5个胼胝体亚段之间的差异。TDI可以比体积或FA值更早,更准确地显示CC变化,CC2/CC3/CC4在30至40岁上升,然后从40至50岁下降。

表6 不同年龄段胼胝体5个亚段(CC1~CC5)FA值在邻近年龄组之间的比较
1.TDI技术
该方法将MRI DTI图像中神经纤维追踪信息结合到亚体素空间分辨率中来实现超分辨率密度神经纤维。TDI测量得到的神经纤维密度与神经纤维的数量成一定的比例,并且通过考虑亚体素内神经纤维特性及其几何映射来实现超高分辨率。因此,TDI使用体素内信息来生成具有比获取的源的体素内MRI DTI数据更高分辨率的新对比图像[6-7]。
近来有一些文献报道了,TDI可以从DTI数据获得超分辨率的神经纤维束密度的方法,并且在检测具有不同纤维方向的白质时,TDI可以测量到亚体素大小的范围内神经纤维密度变化[6-8]。因此,正因为CC是由具有不同方向走向的纤维组成,所以TDI可以用于测量CC的不同部分随年龄的差异。通过TDI超分辨率获得的结构不易产生假象,这已经在7TMRI设备上通过活体小鼠的DWI成像数据证实[9]。使用TDI获得的亚体素图像可以在一定程度上反映脑结构的解剖信息,TDI可以用于创建具有更好解剖和空间信息的高质量神经纤维全脑轨迹密度图[9-11]。在本研究中,TDI用于阐明CC随年龄的复杂性和差异。
2.胼胝体和TDI
本研究中,40岁以下的受试者,TDI随年龄增长而增加。40岁以后,神经纤维减少,脱髓鞘发生,神经纤维变短、密度降低,细胞外空间扩大等成人白质TDI和FA值发生差异。分散各向异性程度将呈下降趋势。这种变化在CC2、CC3和CC4域中尤为重要。胼胝体的TDI和FA值随年龄而降低。由于白质成熟和衰老过程,胼胝体纤维数和各向异性变化。在评估疾病的影响时,应考虑这些与年龄相关的生理差异,特别是在老年人中。总之,胼胝体TDI、体积和FA测量的年龄相关差异始终与大脑中与年龄相关的结构差异一致。可以通过MRI技术定量评估胼胝体结构中的正常老化。本研究旨在测量正常人群中胼胝体的体积,以研究胼胝体中与年龄相关的变化,在胼胝体体积减少之前,其内神经纤维的退变及数量变化。TDI值的变化可能意味着胼胝体神经纤维的退变和坏死过程。因此,超分辨率TDI方法可能在神经科学中发挥重要作用,并且有必要进一步研究TDI及其在其他人种和灰质中年龄相关差异研究中的应用。此外,还需通过纵向分析和长期随访来探索更多细节。本研究是一项初步研究,TDI也可用于比较疾病可能涉及胼胝体和正常对照的患者,以探索早期变化。
