基于ICC自噬探讨疏肝健脾法调节功能性消化不良胃肠动力障碍的研究思路❋
2021-02-12毛兰芳汪龙德杜晓娟王淼蕾牛媛媛
毛兰芳, 汪龙德, 杜晓娟, 张 晶, 张 萍, 王淼蕾, 牛媛媛
(1.甘肃中医药大学附属医院, 兰州 730020;2.甘肃中医药大学, 兰州 730000)
功能性消化不良(functional dyspepsia, FD)是指起源于胃十二指肠区域的1个或1组症状,并且缺乏能解释这些症状的任何器质性、代谢性或系统性疾病,以慢性、持续性、易反复发作为其特点[1,2]。FD的全球发病率约为10%~30%[1],在欧美国家达到20%~25%[3,4],亚洲国家为8%~23%[2-4],在我国约为18%~25%[5]。值得注意的是FD的症状常与其他消化道症状重叠,需要药物治疗且腹部手术的风险高[6],使得用于诊断和治疗FD的医疗资源消耗巨大。目前报道显示,FD患者的医保使用率明显高于无消化不良者[7]。同时,长期反复发作的FD症状与病程的迁延导致患者出现不同程度的精神心理障碍[4]。由此可见,FD的高发病率、症状的持续、重叠及病程迁延,严重影响了患者的心理健康及生活质量,也造成了医疗费用的增加,因此对其研究备受关注。
1.1 FD的发病机制与治疗现状
FD也是一类心理、生理、病理相互作用形成的典型心身疾病,单一的治疗原则不能完全改善患者的症状[7]。目前尚缺乏高效、针对性强的治疗,西药常用促胃肠动力药、质子泵抑制剂(proton pump inhibitor,PPI)、抗焦虑/抑郁药、微生态制剂及安慰剂等药物治疗,但这些药物特异性差,相对于中药不良反应多[9]。如促胃肠动力药会增加心源性猝死、心律失常等心血管不良事件发生的风险[10],长期服用PPI会增加骨折及骨质疏松的风险[11]。因此,西药的临床应用存在一定的局限性,如何解决或弥补西医治疗中获益有限的问题,尝试探索通过新的补充和替代治疗策略成为FD治疗研究的思路之一。1项关于FD与中草药的系统评价指出[12],中草药在缓解FD症状方面优于促胃肠动力剂,此项研究认为当出现促胃肠动力剂和PPI使用禁忌症时,中草药可作为治疗FD的一种替代方法。然而中医药的作用机制尚未完全揭示,明确中医药的作用机制为临床广泛应用提供理论依据。
目前认为FD的病因及发病机制与多种因素[13,14]相关,包括内脏高敏感性、黏膜免疫功能紊乱、胃和十二指肠炎症、微生物失调、幽门螺杆菌感染、胃酸分泌增加、遗传易感性及社会心理等,甚至环境、饮食、药物等因素也会影响FD的发生,罗马IV标准则认为FD是肠-脑互动异常[1],这些因素都会直接或间接相互影响导致FD的发生,引起胃肠动力障碍[15]。因此胃肠动力障碍是FD发病的基础,改善胃肠动力障碍是治疗消化吸收功能、内分泌功能及免疫功能的前提。FD胃肠动力障碍的机制主要取决于胃肠道运动的环节。胃肠道的运动一方面来源于胃肠道的肌电活动,Cajal间质细胞(interstitial cells of cajal,ICC)产生的慢波电位是胃肠道肌电活动的起步电位,决定胃肠道平滑肌收缩的节律,是胃肠动力的基础;另一方面取决于神经递质及胃肠激素诱导平滑肌的收缩舒张,而ICC亦参与胃肠道神经递质的信号传递,故揭示ICC在FD中的作用,是明确FD胃肠动力障碍的关键。
1.2 ICC在FD胃肠动力障碍中的作用
ICC是介于胃肠道神经纤维末端和平滑肌细胞之间的一种特殊间质细胞,ICC具有少量的收缩因子,但含有大量的线粒体、丰富的内质网和不同的细胞膜通道,由一个梭形的胞质体、一个大的椭圆形细胞核和树突组成[16]。研究发现,FD模型大鼠胃组织中出现ICC体积增大、线粒体肿胀、溶酶体数量增多等超微结构改变,ICC的特异性标志物c-kit及其配体干细胞生长因子(stem cell factor, SCF)的mRNA与蛋白水平的表达降低[17],钙离子激活的氯离子通道蛋白Ano1在mRNA和蛋白质水平上都有很强的表达[18],Ano1是更具有特异性和敏感性的ICC标记物。
1.2.1 ICC在胃肠道肌电活动中作用 平滑肌细胞(smooth muscle cell, SMC)是胃肠道功能的物质基础,SMC的收缩-舒张功能异常导致胃肠动力障碍,是胃肠运动的直接靶点。SMC的位相性收缩由ICC产生的慢波驱动,Ano1参与慢波的传导,其基因敲除对成年小鼠小肠Ca2+瞬变和慢波有明显的损伤作用[15],体外细胞培养研究也揭示Ano1在ICC增殖中的作用[19]。另外,ICC与SMC之间形成缝隙连接,缝隙连接在介导SMC的同步收缩中起着至关重要的作用,缝隙连接蛋白43(Cx43)是这一过程关键蛋白,存在于ICC中,与c-Kit具有共定位作用,缺乏Cx43表达可能是导致平滑肌运动功能障碍的部分原因;与正常大鼠比较,FD模型大鼠Cx43水平明显降低[20]。
1.2.2 ICC在胃肠道神经递质信号传导中的作用 肠神经系统(Enteric Nervous System, ENS)中存在的神经递质是维持SMC生理功能的信号物质,但两者之间有80~100 nm的缝隙,导致ENS不能直接作用于SMC。ICC细胞膜上有相应的神经递质受体,ENS中释放的神经递质通过两者之间的突触连接与ICC表面的受体结合[21],ICC再通过缝隙连接介导神经信号传递至SMC,使之去极化或超极化,从而产生兴奋或抑制效果[22]。一般认为,兴奋性肠神经递质乙酰胆碱能受体(acetylcholine, ACh)和P物质(substance P, SP)在FD中低表达,抑制性肠神经递质血管活性肠肽(vasoactive intestinal peptide, VIP)和一氧化碳(nitric oxide, NO)在FD中高表达[23],课题组前期研究和预实验结果也证实了这一观点[24]。
1.3 AMPK-mTOR介导的ICC自噬与ghrelin在FD中的相关性
细胞自噬(Autophagy)是维持细胞生存、缓解细胞内外压力的重要代谢过程,基础水平的自噬为细胞提供能量,促进物质循环和细胞自我更新;过度水平的自噬破坏性地降解了有用的蛋白质和细胞器,引起自噬性凋亡[25],因此自噬调节被认为是多种疾病潜在的治疗措施。目前在FD大鼠模型中发现,自噬相关蛋白Beclin1和LC3的mRNA与蛋白水平的表达增高,研究结论认为ICC结构和数量异常可能与ICC过度自噬有关[16,26]。
自噬的发生需要通过自噬传导通路的参与。细胞自噬多条上游信号通路均在雷帕霉素靶蛋白(mTOR)点汇合,抑制mTORC1可上调自噬,刺激mTORC1可下调自噬,mTOR可通过抑制ULK1与下丘脑腺苷酸激活蛋白激酶(AMPK)之间的相互作用抑制自噬发生[27]。AMPK可通过激活ULK1复合体直接诱导自噬,AMPK也可以负性调节mTOR活性,阻断其对ULK1的抑制作用[28]。因此,在功能上AMPK-mTOR信号通路和自噬是相辅相成的,在对自噬的调控中,AMPK和mTOR既相互独立又呈上下游的关系。
胃促生长素(ghrelin) 是主要由胃黏膜X/A 样细胞在接受饥饿信号刺激后分泌的一种脑肠肽,可以促进胃酸分泌,提高胃肠道动力,加速胃排空[29]。已有研究[30]指出,胃动力紊乱可通过调节ICC的功能或通过ghrelin受体激动剂促进食欲来控制恶心。另外,mTOR可能在促进ghrelin分泌的过程中发挥重要的作用。研究表明,胃窦组织中mTOR的变化也会导致ghrelin表达量的改变,从而影响食物摄取[31];研究还发现ghrelin增强下丘脑AMPK及其靶点的磷酸化,这与mTOR的磷酸化水平降低有关[32],表明ghrelin促进FD胃肠动力的作用可能与AMPK-mTOR信号通路有关。因此,ghrelin与ICC及AMPK-mTOR信号通路之间的联系提示,ghrelin促FD胃肠动力的作用可能与AMPK-mTOR信号通路介导ICC自噬调节有关。目前,尚无从AMPK-mTOR信号通路深入研究FD与ICC自噬的相关性。
1.4 中医学“肝脾相关”理论与胃肠动力及ICC自噬的关系
FD属于中医学“痞满”范畴,《伤寒论·辨太阳病脉证并治》谓:“但满而不痛者,此为痞”。FD病位在胃,涉及肝脾。叶天士提出:“脾宜升则健,胃宜降则和”,脾胃同居中焦,为气机运化之枢纽,清升浊降则气机条畅,脾胃功能障碍、升降失常则导致该病的发生,故“脾虚不运”是其发病基础,这与FD胃肠动力障碍的机理具有一致性[33]。叶天士曰:“肝为起病之源,胃为传病之所”,故见肝之病知肝传脾。中医学认为外邪饮食刺激或素体脾胃虚弱,经反复、持久的情志刺激能够影响脾的运化及肝的疏泄功能,使脾失运化、肝失疏泄、胃不受纳而导致FD症状的出现,故“肝脾失调”是FD发病的重要环节[34,35]。现代医学认为,FD多伴有不同程度的焦虑、抑郁、躯体化等精神障碍[36],在导致情绪异常的同时,会引起食欲不振、早饱、嗳气、腹胀等胃肠道反应,再者FD患者大多平素体质较弱,消化吸收功能较差,且神经-内分泌调节失衡,表现为感受性及情绪兴奋性过强,这与中医证候学中的“肝脾吻合”具有一致性。
Nature杂志提出“代谢失衡和消耗过度”与自噬“自我保护和诱导死亡”的作用相关[37],表明细胞自噬具有双重性。“过犹不及”是中医学强调阴阳平衡的基本观点之一,这与“自噬过度”和“自噬不足”的双重性相一致,因此细胞自噬被认为是阴阳平衡的微观基础。国内李秀惠团队[38]的一项关于自噬与乙肝病毒关系的研究证明了这一观点。从中医理论来认识“肝脾相关”理论正是阴阳平衡论的具体体现,“肝疏泄太过或不及”也符合细胞自噬双重性的特点。此外,细胞器和蛋白质是维持细胞生存的重要物质,其中线粒体将营养物质转化成ATP,维持机体的生命活动,线粒体的这一功能与脾运化水谷精微,化生气血,濡养五脏六腑四肢百骸作用极为相似。宋雅芳[39]等研究发现,脾虚模型大鼠细胞线粒体数量减少,线粒体结构损伤。因此,FD发病中的ICC自噬正符合肝木克脾土,脏腑失衡的中医学“肝脾相关”理论。
1.5 疏肝健脾法治疗FD的优势
肝失疏泄、胃气上逆、脾失运化是导致FD的主要病因病机,肝郁脾虚是FD的主要证型,治疗以疏肝健脾为主要治法,但脾胃功能失调可导致气滞、血瘀、湿热、痰饮、火郁、食积等一系列的病理产物,这些病理产物可引起气机阻滞影响脾胃升降,从而导致胃肠功能障碍,这提示脾胃虚弱是FD的发病基础,肝气郁滞是发病条件,痰、火、瘀、食郁是病理产物,国内单兆伟、张照兰等也肯定了这一理论[40-42]。然而单一的治疗原则并不能完全改善患者的症状,治疗上强调健脾运、疏肝气、降胃气基础上要兼顾代谢病理产物及消食和胃、活血化瘀,除湿化痰,清热化湿等,从而达到综合调理的目的,这与国医大师周信有“复方多法、综合运用、整体调节”的学术思想相吻合。现代药理学研究亦表明,中药理气药、活血化瘀药、健脾消食药或润肠通便药能够不同程度促进、抑制或双向调节胃肠动力[43]。课题组前期基于“肝脾相关”理论,发现以疏肝健脾法为代表的中药复方制剂平胃胶囊,改善胃肠动力障碍的作用与SP、VIP、ghrelin等脑肠肽的异常表达相关[44-46]。
综上,胃肠动力障碍是FD发病的基础,ICC是胃肠道电活动的起搏细胞,可产生和传播慢波,参与胃肠道神经递质的信号传递,ICC异常导致FD胃肠动力障碍可能与其自噬相关,细胞自噬的过程由AMPK-mTOR信号通路调节。课题组前期研究发现,FD模型大鼠胃肠动力障碍与ghrelin有关,而ghrelin在FD中的表达与AMPK-mTOR及ICC具有相关性。因此课题组认为,FD胃肠动力障碍可能与ICC自噬相关,ghrelin促FD胃肠动力的作用可能与AMPK-mTOR信号通路介导的ICC自噬调节有关(见图1)。FD胃肠动力障碍的机理及ICC自噬的观点与“肝脾相关”理论相吻合。课题组研究亦发现疏肝健脾法促胃肠动力的机制与ghrelin有关。因此,课题组认为,疏肝健脾法通过AMPK-mTOR信号通路介导的ICC自噬调节FD胃肠动力障碍。课题组进一步通过动物实验进行验证,研究结果将对于缓解FD胃肠动力障碍、改善患者生活质量具有积极意义。这正是中医学理论特色和优势所在,也是中医学整体观、辨证观具体应用的体现,同时是对国医大师学术思想和经验的继承与发展,也为中医药治疗FD提供了思路与方法。
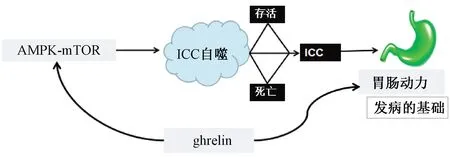
图1 ICC自噬与胃肠动力障碍图
