精氨酸经SLC38A9介导调控衰老骨骼肌蛋白质合成的机制研究进展
2021-02-12赵艳尚画雨丁孝民刘绍生王前进夏志
赵艳 尚画雨 丁孝民 刘绍生 王前进 夏志,
1 温州大学体育与健康学院(浙江温州 325035)
2 成都体育学院运动医学与健康学院(成都 610041)
3 井冈山大学体育学院(江西吉安 343009)
衰老性骨骼肌萎缩是65 岁及以上老年人群的多发病症,主要表现为骨骼肌质量、肌力与体能的进行性衰退,其发生发展可致老年人跌倒、残疾甚至死亡的风险显著增加[1],并与住院费用的增长独立相关[2]。其临床治疗尚无公认标准与指引,现有药物及干预手段亦未能有效应对其进展[3]。因此,厘清该症的病理生理机制,探明潜在作用靶点,将有力促进临床干预方案和新型治疗药物的研发。
骨骼肌质量的维持取决于蛋白质合成(muscle protein synthesis,MPS)与降解(muscle protein break⁃down,MPB)过程之间的动态平衡,两者的代数差(MPS-MPB)指示净蛋白质平衡(net protein balance,NPB)状态[4,5]。NPB呈正值时,骨骼肌蛋白质沉积(pro⁃tein deposition)增加并导致肌纤维体积与肌力增长;反之,则致蛋白质沉积减少和萎缩加剧[6]。就衰老机体而言,骨骼肌质量与功能的衰退主要由MPS减少所致,而这一变化的关键诱因则在于其自身的合成代谢抵抗(anabolic resistance)特性[7],即对膳食氨基酸和蛋白质等主要合成代谢刺激的敏感性降低与应答减退现象[8]。因此,如何有效削弱衰老骨骼肌合成代谢抵抗,改善NPB 并促进沉积,已成为学界关注的重要科学问题。研究表明,抗阻或有氧运动联合膳食蛋白质、氨基酸干预可产生较单独营养支持更为显著的衰老骨骼肌MPS与功能促进[9-11]。因此目前认为,运动可能有效增强衰老骨骼肌对膳食氨基酸和蛋白质营养的敏感性与应答反应,在促进骨骼肌蛋白质合成与沉积方面具有重要潜力[12,13]。
条件性必需氨基酸精氨酸[14]与必需氨基酸亮氨酸[15]同属于促进蛋白质合成的关键氨基酸(proteogenic amino acids),可作为底物和信号转导分子直接参与MPS调节。越来越多的研究表明,精氨酸营养感应(ar⁃ginine-sensing)对骨骼肌MPS具有重要影响,而溶质载体家族38 成员9(Solute carrier family 38 member 9,SLC38A9)作为精氨酸跨域质膜进入胞质内的转运载体则可能在精氨酸营养感应过程中发挥关键作用[16]。但是,其潜在作用机制迄今仍不清楚。基于此,本文对相关研究进展进行综述,以期探寻衰老性骨骼肌萎缩发生的新机制及防治的新策略,并为相关靶点在临床转化医学领域的应用提供可参考的理论线索。
1 SLC家族与SLC38A9概述
溶质载体(solute carriers,SLC)超家族是仅次于G蛋白偶联受体的第二大膜蛋白家族。其家族成员主要定位于质膜及各种亚细胞器膜上,通过继发性主动转运或易化转运方式跨膜运输营养物质、药物及代谢废物等可溶性小分子,维持细胞内稳态的动态平衡,从而在细胞营养素摄取与药物吸收等生理过程中发挥重要作用。SLC 由一个中心孔和门控系统组成,允许底物以构象变化而非开放通道的方式通过。目前,已根据序列同源性鉴定出60 多个家族,超过400 个家族成员[17,18]。
尽管该家族各成员结构存在差异,但却又因其各自的功能而相互联系。一方面,部分成员的转运机制相近,需要与特定的离子一起发挥转运功能,如钠离子偶联的中性氨基酸转运蛋白家族(sodium-coupled neutral amino acid transporter,SNAT/SLC38)即需与钠离子协同转运丙氨酸和丝氨酸等小分子中性氨基酸;另一方面,其转运底物如营养素、药物及代谢产物等往往具有相近的化学特性。其中,超过25%的SLC 家族成员均以氨基酸作为主要底物,而这些氨基酸除作为蛋白质合成底物之外,亦是蛋白质合成主要调控信号通路的重要信号分子,可通过活化哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin com⁃plex 1,mTORC1)信号级联而参与骨骼肌等组织的蛋白质合成与沉积过程。已有研究提示亮氨酸是mTORC1的主要激活剂[19],且我们的相关研究已佐证了这一观点[13,20]。近些年来学界认为对于细胞生长和增殖至关重要的精氨酸亦可经mTORC1途径而参与其中[21,22]。
SLC38A9 是SLC38 家族成员,编码SNAT9 转运蛋白。SLC38 家族包括11 个蛋白质成员(SLC38A1-SLC38A11),大部分已经在细胞系统中进行功能鉴定[21,23]。为使该家族克隆的转运蛋白与在细胞实验中通过通量研究所测定的转运活性相匹配,这些转运蛋白被整合成系统A和系统N两种功能类型。系统A型转运蛋白受到氨基酸补充和剥夺的调节,以钠离子依赖的单向运输模式进行转运,其活性偏好于以丙氨酸为代表的小分子中性氨基酸,并可被氨基酸类似物异丁酸甲胺酯(MeAIB)所抑制;系统N 型转运蛋白的转运活性则偏好于谷氨酰胺、天冬酰胺和组氨酸等侧链含有额外氮原子的氨基酸[24]。此外,也可以通过转运机制而区分两类转运蛋白:系统A型转运蛋白属于钠-氨基酸协同转运[25],而系统N 型转运蛋白的机制则更为复杂,同时涉及钠离子的协同转运以及质子的反向转运[26,27]。目前,SLC38A1、SLC38A2、SLC38A4 和SLC38A8因具有被MeAIB 抑制转运活性的特征而被纳入系统A,SLC38A3、SLC38A5、SLC38A7 由于对MeAIB 的抗性而被纳入系统N[24,28]。就SLC38A9而言,其对MeAIB有抗性,具有N 系统转运蛋白的特征[23],但其转运底物的广泛性又有着A系统的特点[29],因此目前尚未确定其究竟归属于何种功能类型。
SLC38A9 是通过对Ras 相关鸟苷三磷酸酶(Rasrelated guanosine triphosphatases,Rag GTPases)和Ragulator复合物的免疫沉淀和质谱分析而确定的。与SLC38 转运体家族其他蛋白质相比,SLC38A9 不仅拥有11个跨膜螺旋结构域且其在N端有一个119个氨基酸长度的延伸(Ragulator 结合域)。从功能上而言,SLC38A9作为一种与氨基酸转运体同源的溶酶体跨膜蛋白质,除可在溶酶体膜转运精氨酸外,亦可经其N端延伸而与Ragulator 复合物和Rag GTPases 相互作用,并在mTORC1的氨基酸依赖性活化中发挥重要作用[21,23]。鉴于SLC38A9同时具有转运体(transporter)和受体(receptor)两个截然不同而又互补的功能,因此其亦可被视为转运受体(transceptor)。在响应精氨酸刺激时,通过Rag GTPases 与Ragulator 复合物等蛋白质的协作而调控mTORC1活化,进而刺激骨骼肌MPS。
2 参与精氨酸经SLC38A9 介导调控骨骼肌MPS的重要分子
2.1 mTORC1
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是哺乳动物等高等真核生物中广泛存在的一种在进化上高度保守的磷脂酰肌醇-3-激酶相关激酶(phosphatidylinositol 3-kinase related ki⁃nase,PIKK)家族成员。作为真核细胞生长的主要调节因子,其对细胞内和细胞外包括氨基酸、生长因子和能量状态等多种信号作出反应,并协调蛋白质与核苷酸等必要生物分子的合成和循环以促进细胞生长、分化与代谢[30]。
mTOR 作为催化亚基参与构成两种复杂的哺乳动物雷帕霉素靶蛋白复合物mTORC1 与mTORC2。除mTOR之外,这两种复合物还具有共同的mTOR稳定蛋白mLST8(mammalian lethal with Sec13 protein 8)及mTOR负调控蛋白Deptor(DEP-domain-containing mTOR-interacting protein)。其主要不同之处在于:(1)mTORC1 中存在可调控其定位与底物募集的mTOR 调节相关蛋白(regulatory-associated protein of mTOR,Raptor)及其负性调节子40 kDa 富含脯氨酸AKT 底物(proline-rich AKT substrate of 40 kDa,PRAS40),mTORC2则含有哺乳动物应激活化的蛋白激酶互作蛋白1(mSIN1)、Protor及Rictor这种可能与Raptor具有类似功能的特征亚基;(2)mTORC1主要控制细胞的生长(亦可参与细胞增殖调控),而mTORC2 则主要参与控制细胞存活和增殖[31];(3)在多细胞生物中,mTORC1主要响应氨基酸等营养素的调控,而mTORC2 则主要响应生长因子和激素等细胞外输入信号的调控。就响应精氨酸刺激的MPS 而言,mTORC1 通过磷酸化其下游底物S6 激酶1(S6 kinase 1,S6K1)与真核翻译起始因子4E 结合蛋白1(eukaryotic translation initiation fac⁃tor 4E-binding protein 1,4E-BP1)而介导翻译调控。
当mTORC1 位于细胞质中时,以非活化形式存在。其活化过程通常包含两个环节:响应环境刺激,从胞质转位至溶酶体表面;在溶酶体表面招募复合物与激动子共定位,在满足活化条件的前提下被激活。需要指出的是,mTORC1 在溶酶体表面的活化条件较为严苛,目前学界较为一致地认为只有在生长因子和营养素同时存在时才能发生,因此,mTORC1具有检测这两种活化条件的“重合探测器(coincidence detector)”功能。一方面,在SLC38A9的参与下,精氨酸等营养信号通过鸟苷三磷酸酶活化蛋白(GTPase-activating pro⁃tein,GAP)或鸟苷酸交换因子(GMP exchange factor,GEF)的作用促使Rag GTPases 转换为活化态二聚体,诱使mTORC1溶酶体转位;另一方面,生长因子和细胞应激信号调控溶酶体表面脑中富含的Ras 同源蛋白(Ras homolog enriched in brain,Rheb)的核苷酸装载状态,使其在与GTP结合时直接刺激mTOR激酶活性,磷酸化下游靶蛋白S6K1与4E-BP1[31,32]。可见,小分子GTP酶调控下的mTORC1活化应答及其“重合探测器”功能执行,对于响应精氨酸刺激的MPS至关重要。
2.2 Rag GTPases
目前,多种氨基酸及其前体均已被证实可刺激mTORC1 活化,因此其信号转导亦涉及多种小GTP 酶所介导的不同影响[16]。Rag GTPases 的发现对于理解氨基酸刺激mTORC1活化机制具有重要意义。在哺乳动物骨骼肌内,表达Rag A、Rag B、Rag C 和Rag D 四种Rag GTPases,Rag A/Rag B 可分别与Rag C/Rag D通过二聚化形成复合体,在mTOR 响应精氨酸或亮氨酸刺激的活化过程中发挥不同作用[21]。其中,Rag A与Rag B 高度同源,共享高达90%的蛋白质序列同源性,而Rag C和Rag D亦共享约81%的序列同源性[33,34]。
早在2008年,Sancak等[35]和Kim等[36]即分别通过生物化学纯化和RNAi 技术确定了Rag GTPases 可将氨基酸营养信号输入mTORC1 信号途径,诱发下游分子事件。后续研究进一步发现,Rag GTPases的GTP/GDP核苷酸装载状态控制着其酶活性并调节mTORC1溶酶体的定位与活化[37,38]。在精氨酸充足的条件下,SLC38A9 与处于失活态的Rag GTPases 结合,诱使Rag A/B装载GTP而Rag C/D装载GDP,从而增强其与mTORC1特征亚基Raptor的互作,促使mTORC1转位至溶酶体表面用于后续活化;在氨基酸不足的条件下,则RagA/B 装载GDP而RagC/D 装载GTP,使Rag异源二聚体处于失活状态进而抑制mTORC1 活化[35,36]。可见,Rag GTPases 的核苷酸状态受到氨基酸可利用率(ami⁃no acids availability)的严格控制。
2.3 Ragulator复合物
由于Rag GTPases 缺乏脂质定位信号,因此当SLC38A9 与无活性的RagAGDP/RagCGTP二聚体直接结合后需要Ragulator 复合物协助其定位于溶酶体表面,进而募集mTORC1转位。Ragulator是由晚期内含子/溶酶体适配子和促分裂原活化蛋白激酶以及哺乳动物重组雷帕霉素激活物分子LAMTOR1(p18)、LAMTOR2(p14)、LAMTOR3(MP1)、LAMTOR4(C7orf59)和LAM⁃TOR5(HBXIP)所组成的五聚体,其中LAMTOR2/LAM⁃TOR3 与LAMTOR4/LAMTOR5 分别形成异源二聚体,并被LAMTOR1包裹。Rag GTPases的C端结构域可直接与LAMTOR2/LAMTOR3 二聚体相互结合,而LAM⁃TOR1的N端则通过棕榈酰化和肉豆蔻酰化将Rag GT⁃Pases锚定在溶酶体表面[39,40]。
除锚定Rag GTPases 这一作用之外,目前发现Ra⁃gulator蛋白质复合物亦可通过行使GEF功能促进结合GDP 与GTP 之间的交换,从而作用于Rag GTPases 上游以控制其核苷酸装载状态[41]。Bar-Peled等早期的研究认为,Ragulator 是作为Rag A/Rag B 的GEF 而参与mTORC1活化调控[37]。但该实验室Shen 等近年的研究则发现该研究可能因为实验的不完善而导致了结果的误解:首先,此前使用的分析方法不能明确区分每个Rag 亚单位所结合的核苷酸;其次,未能优化反应条件以彻底防止鸟苷酸错误装载到黄嘌呤特异性Rag GT⁃Pases 突变体;第三,在所用的哺乳动物蛋白质表达系统中,有少量的SLC38A9 与Rag-Ragulator 超复合体结合,可能使得结果复杂化。因此,Shen 等认为虽然Ra⁃gulator 确实影响Rag A 对GTP 的亲和力,但其对RagC的影响最为显著,且可促进RagCGTP向RagCGDP的转换[42]。
3 精氨酸经SLC38A9 介导调控衰老骨骼肌MPS的潜在机制
如前所述,精氨酸[14]与亮氨酸[15]同为公认的关键合成代谢刺激,可作为底物和信号转导分子参与MPS 调节。mTORC1 则调控MPS 翻译起始,其活化水平直接影响衰老骨骼肌蛋白质沉积[43,44]。由于mTORC1 必须转位至溶酶体表面才能被激活,因此溶酶体在其活化中具有重要地位[44],而精氨酸则作为关键信号分子发挥“溶酶体信使”功能[45]。在氨基酸充足的条件下,Rag A/Rag B 装载GTP 而Rag C/Rag D 装载GDP,这种Rag GTPases 的活化构象将促进mTORC1 从胞质内转位至溶酶体表面,进而活化mTOR 与下游信号表达[40,46]。然而,尽管mTOR 可响应精氨酸刺激,其本身却并无精氨酸传感功能(arginine sensing),不能感应衰老骨骼肌细胞内精氨酸含量的高低。可见,在运动促进衰老骨骼肌感应和应答膳食精氨酸,从而削弱合成代谢抵抗并促进正性NPB 形成的过程中,必然有其它蛋白质作为限制性环节参与其中。但是,究竟何种蛋白质作为精氨酸传感器参与这一调节?如何参与调节?迄今仍未厘清。
目前,学界已鉴定出mTORC1亚基1胞质精氨酸传感器(CASTOR1)[47]与SLC38A9[21]两种精氨酸传感器,二者均可通过Rag GTPases 介导调控mTOR 营养应答。其中,CASTOR1 感应胞质内精氨酸缺乏,通过对Rag AGTP行使GAP功能促使GTP水解形成无活性的Rag AG⁃DP,从而负向调节mTOR功能表达。SLC38A9则感应溶酶体及胞质内精氨酸的存在并在胞质和溶酶体腔之间进行双向氨基酸转运,行使转运受体功能[48]。SLC38A9与无活性的Rag AGDP/Rag CGTP二聚体直接结合后,由Ragulator 五聚体作为Rag CGTP的GEF 促使其释放GTP并结合GDP,从而解除此二聚体的失活锁定状态,进而由SLC38A9作为Rag AGDP的GEF促使其释放GDP并结合GTP,形成活化态二聚体Rag AGTP/Rag CGDP,刺激mTORC1 溶酶体转位与活化(图1)[21,42,46]。由于衰老骨骼肌分解代谢较为旺盛,SLC38A9 亦有可能刺激其它必需氨基酸从溶酶体分解的蛋白质中外流至细胞质,从而进一步影响mTOR 营养应答[45]。Crocco 等近年的单核苷酸多态性研究亦指出SLC38A9的增龄性变化与衰老性肌萎缩相关[49]。因此,相比之下,SLC38A9 可能具有更为重要的精氨酸营养感应与mTOR营养应答调控作用。此外,尽管Rag A 与Rag C 的GTP 酶结构域均可结合mTORC1,但Rag C 的GTP 酶结构域与其接触较少,由Rag A 占据主导地位,提示装载GTP 的Rag A 可能在SLC38A9 介导的mTOR 调控中发挥关键作用[35]。
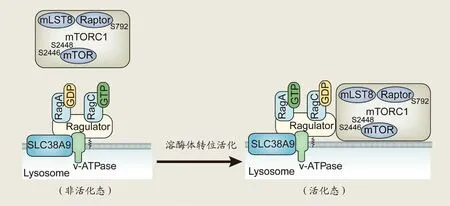
图1 SLC38A9介导mTORC1溶酶体转位活化的潜在机制
目前学界尚无直接探讨运动调控骨骼肌SLC38A9表达的相关研究报道。但如前文所述,SLC38A9 可作为精氨酸传感器直接影响骨骼肌响应精氨酸刺激时的mTORC1 活化,Ragulator、重组激活基因的GTP 酶活化蛋白(GATOR)与卵泡素-卵泡素互作蛋白(FLCNFNIP)复合物亦可作为Rag A/Rag C 的GAP 或GEF 而参与其中。因此,理论上,运动可能对参与Rag A/Rag C核苷酸装载状态调控的这一系列蛋白质复合物造成影响,从而调节mTORC1 的精氨酸营养感应与应答。迄今为止,尚未见运动对Ragulator与GATOR复合物及其亚单位影响的报道。FLCN-FNIP 复合物是Rag C/Rag D 的GAP,可通过促进其所装载的GTP 水解为GDP,而正性调控响应氨基酸刺激时的mTORC1 活化。Collodet 等近年的实验中,野生型斑马鱼以60 厘米/秒的速度进行强迫游泳运动2小时40分钟,运动结束后3小时处死取躯干肌并采用qPCR法检测FLCN与FNIP2基因表达,结果观察到其表达水平较对照组均有显著上调,提示运动可能通过上调FLCN与FNIP2表达而增强其对RagC 的GAP 功能,从而进一步促进mTORC1 的精氨酸营养应答[49]。但由于斑马鱼并非运动生理学研究的经典模型,且Collodet 等[50]仅检测了基因水平的表达变化,因此仍需后续研究进一步明确其蛋白质水平的确切变化及其在啮齿类动物甚至人体骨骼肌内的变化趋势。
4 小结与展望
合成代谢抵抗是骨骼肌呈现衰老性萎缩表征的关键诱因,而氨基酸感应与mTORC1 应答则在蛋白质沉积调控中具有至关重要的作用。因此,增强衰老骨骼肌对精氨酸等重要合成代谢营养刺激的感应与应答,从而改善合成代谢抵抗并增加蛋白质沉积,可能是本领域后续研究的重要方向。SLC38A9作为精氨酸介导MPS 的限速因子,可在Ragulator、GATOR 与FLCNFNIP 等复合物的作用下通过行使GAP 或GEF 功能而调节RagA/RagC 的核苷酸装载状态,进而调控mTORC1应答反应。运动则可能通过上调FLCN-FNIP复合物表达而参与精氨酸营养感应调控,但其对SLC38A9的直接影响尚有待探讨。
细胞氨基酸传感器的表征研究日渐兴起,就精氨酸营养感应而言,仍有较多科学问题亟待厘清:(1)已鉴定出的精氨酸传感器SLC38A9 与CASTOR1 究竟是独立参与MPS 调节还是共同参与、协同整合?(2)不同运动类型、运动强度、运动频率、运动时间及运动周期究竟如何影响精氨酸传感器(尤其是SLC38A9)的功能活性,从而影响mTORC1 应答?(3)鉴于不同种属甚至组织响应运动刺激时所存在的差异性应答反应,之前临床研究中所观察到的适应性变化究竟是否能够转化为对人体被试的有益促进?在后续研究中,借助生物信息学或基因芯片分析手段,鉴定出精氨酸营养感应与应答通路响应运动刺激的关键上游调节信号级联,并通过基因敲除/过表达动物模型或阻断剂/激动剂的使用而予以验证,将为相关靶点与机制在临床转化医学领域的应用提供更为系统的理论与实验线索。
