斑马鱼(Danio rerio)mapk1基因对tp53基因调控研究
2021-02-10包林珠时灿卢玲儿徐行周泽斌任建峰李伟明张庆华
包林珠 时灿 卢玲儿 徐行 周泽斌 任建峰李伟明 张庆华
(1. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;2. 上海海洋大学 中国科学技术部海洋生物科学国际联合研究中心,上海 201306;3. 密歇根州立大学渔业与野生生物系,密歇根,美国 48824)
细胞凋亡(apoptosis)是生物学和医学领域研究的热点问题之一,对多细胞生物的胚胎发育、个体生长、造血、免疫系统成熟、内环境稳定及抵御外界各种因素的干扰等方面都起着重要的作用。细胞凋亡不仅是一种特殊的细胞死亡类型,而且具有重要的生物学意义及复杂的分子生物学机制[1]。在动物体内,如果细胞增殖过度,则造成癌症;如果细胞凋亡过度,则可引起神经退行性疾病,如阿尔茨海默症[2]。肿瘤细胞的无限生长是肿瘤细胞凋亡受抑制的结果,因而细胞凋亡障碍同肿瘤的发生、发展具有密切的关系[3]。MAPK信号通路由细胞外信号调节激酶(ERK1/2),c-Jun N端激酶(JNKs)和p38组成,它们介导细胞内的一系列生物学反应,包括细胞增殖、分化及凋亡[4]。MAPK1是细胞外信号调节激酶(ERK)中的成员,又称细胞外信号调节激酶2(ERK2),能够介导多种因子导致癌细胞凋亡[5]。
TP53在许多信号传导途径中发挥功能,从而调节生物繁殖、发育、基因组稳定(DNA修复)、细胞衰老、凋亡及代谢变化等各种重要的生物学活性[6]。TP53是迄今为止在人类恶性肿瘤分析中最常见的肿瘤抑制基因,在近50%的人类癌症中发现TP53 基因的突变[7]。Berghmans等[8]在 tp53-/-突变体斑马鱼(Danio rerio)中观察到恶性周围神经鞘瘤的发生。TP53在监测、预防、消除肿瘤细胞以及抑制肿瘤抑制因子方面起着重要作用[9]。大量研究表明,TP53通过两条途径抑制细胞生长,即激活细胞周期阻滞和促进细胞凋亡[10]。
目前,斑马鱼作为常用的脊椎动物模型为人类疾病的认知作出了重要贡献[11]。斑马鱼TP53与人和小鼠的TP53蛋白氨基酸序列分别具有48.3%和48.5% 的同一性,而且在5个保守区域的氨基酸序列的一致性都很高,均为75%、92.3%、100%、100%和94.1%[12],与其他模型动物相比,斑马鱼在识别tp53基因调控的新机制方面具有许多优势[13]。因在斑马鱼中易于进行正向和反向遗传操作技术和化学筛选,使其非常适合鉴定和表征脊椎动物tp53途径相关的药物和基因,如抗癌药物喜树碱和mdm2基因[14]。由于蛋白激酶代表了真正的药物靶标,尤其是ERK1/2信号,因此受到众多生物和医学领域科学家的极大关注[15]。有研究报道,在人HEK293T细胞中,MAPK1可通过磷酸化活化TP53基因[16]。在兔晶状体上皮细胞(rabbit lens epithelial cells,RLECs)中,在钙霉素的作用下,MAPK1可以促进TP53的表达[17]。然而在斑马鱼中,mapk1基因对tp53基因的调控作用未有报道。由于目前在斑马鱼模型研究中缺少相应蛋白的抗体,使得蛋白之间的调控作用存在诸多瓶颈。启动子作为基因的“开关”,对于基因的时空表达特性起着至关重要的作用。报告基因是基因功能研究的有效方法之一,本研究旨在启动子-基因层面建立一个基因间相互作用的研究系统,因此我们构建了斑马鱼mapk1基因的表达质粒和tp53报告基因,结果表明mapk1可以促进tp53表达,明确了两者的调控作用关系,以期为斑马鱼的细胞凋亡的分子机制奠定基础。
1 材料与方法
1.1 材料
本实验所用AB品系斑马鱼购自中国科学院生物化学与细胞生物学研究所斑马鱼平台,按照上海海洋大学动物伦理委员会的相关规定(SHOUDW-2016-003)进行饲养。海洋动物组织基因组 DNA提取试剂盒、普通琼脂糖凝胶 DNA 回收试剂盒、无内毒素质粒小提中量试剂盒、DH5α感受态细胞购自天根科技(北京)有限公司。克隆启动子特征序列所用引物由生工生物工程(上海)股份有限公司合成。扩增序列所用聚合酶、pMDTM19-T克隆载体试剂盒购自TaKaRa(北京)。报告基因构建所用限制性内切酶、T4 连接酶购自 NEB(北京)。Dual-Luciferase®报告基因活性检测试剂盒、Fugene®HD 转染试剂购自Promega。配制转染复合物用简单培养基 Opti-MEM 购自 Gibco Life。实验用人胚肾细胞(human embryonal kidney,HEK293T)、pGL3-Enhancer 载体及内参质粒 phRL-TK 均由海军军医大学医学免疫学国家重点实验室惠赠。斑马鱼胚胎成纤维细胞(zebrafish embryo fibroblasts cell,ZF4)由本实验室保存。
1.2 方法
1.2.1 序列分析及引物设计 从NCBI(https://www.ncbi.nlm.nih.gov/)数据库获取启动子和氨基酸序列,使用的斑马鱼tp53启动子序列位于斑马鱼5号染色体,位置范围为:NC_007116.7(24085530-24087491),斑马鱼Mapk1编码区参考序列登录号为NP_878308.2,人(Homo spaiens)MAPK1编码区参考序列登录号为NP_002736.3,小鼠(Mus musculus)MAPK1编码区参考序列登录号为NP_0010337 52.1。用NCBI中的Primer-BLAST设计引物。用Meth primer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)预测斑马鱼tp53启动子区CpG岛。 用 Alibaba2.0(http://gene-regulation.com/pub/programs/alibaba2/index.html)分析tp53启动子序列中潜在的转录因子结合位点,并分析该启动子区特征序列。用Snapgene软件构建质粒图谱,运用DNAMAN 软件对比不同物种的氨基酸序列。
1.2.2 斑马鱼tp53启动子报告基因构建 从NCBI网站获得斑马鱼tp53基因的启动子序列,通过软件预测启动子序列中的转录因子结合位点,选择含有转录因子结合位点的2 000 bp左右进行PCR扩增,扩增程序见表1,引物为tp53-F1和tp53-R1(表2)。在扩增出来的tp53启动子序列的最前端和最后端设计添加酶切位点的引物tp53-F2和tp53-R2,两个限制性内切酶分别为Kpn I-HF和Xho I,引物中酶切位点加下划线,酶切位点之前的3个碱基为保护碱基,用于后续的报告基因构建。用两个限制性内切酶分别对扩增出来的tp53启动子序列和 pGL3-Enhancer质粒(图1-A)进行双酶切。得到的两种酶切产物用 T4 连接酶连接,构成pGL3-tp53-Luc质粒(图1-B)。连接成功后转化至天根的大肠杆菌DH5α感受态细胞。将转化物涂到含有氨苄抗性的普通肉汤琼脂平板上,37℃培养过夜,第二天挑取单个的白色菌落扩摇菌液,通过pGL3-Enhancer通用引物,以扩摇的菌液为模板进行PCR,通过凝胶电泳检测筛选出含有正确大小插入片段的阳性克隆,并随机选择5个片段大小正确的菌液进行测序,将测序结果与目的片段参考序列进行对比,将与参考序列对比完全一致的菌液保存,用于后续提取质粒。

图1 pGL3-Enhancer质粒(A)与 pGL3-tp53-Luc重组质粒(B)示意图Fig. 1 Schematic diagram of pGL3-Enhancer plasmid(A)and pGL3-tp53-Luc recombinant plasmid(B)

表1 PCR试剂及体系Table 1 PCR reagents and systems

表2 实验所用的引物序列Table 2 Primer sequences used in the experiment
1.2.3 斑马鱼tp53启动子报告基因活性检测 人胚胎肾细胞HEK293T所需的培养液为含有10% FBS的DMEM,将HEK293T细胞置于37℃,含有5%浓度CO2的培养箱中培养。转染前24 h,将HEK293T细胞接种于24孔细胞培养板中,接种细胞密度约为5.0×104个/孔。等细胞汇合度达到70%,将配置好的转染体系(表3)在28℃中放置15 min后物添加至细胞培养板的1个孔中,以pRL-TK质粒作为内参。转染后,将HEK293T细胞放在37℃含有5%浓度CO2的培养箱中培养36 h后用Promega的 Dualluciferase®Reporter Assay System进行双重荧光素酶测定,计算 firefly luciferase 与 Renilla luciferase 的比值,每个样品设置3 个复孔,每组实验重复3次。

表3 检测tp53启动子报告基因活性的转染体系Table 3 Transfection system for detecting tp53 promoter reporter gene activity
斑马鱼胚胎成纤维细胞ZF4所需的培养液为含有10% FBS的DMEF12,将ZF4细胞置于28℃,含有5% 浓度CO2的培养箱中培养。转染体系和检测方式与HEK293T细胞一致。
1.2.4 mapk1的CDS序列的扩增 在斑马鱼 mapk1编码区CDS(coding sequence)序列的两端设计引物。用Trizol提取斑马鱼总RNA,并反转录成cDNA。以cDNA为模板,利用CDS上下游引物和高保真酶扩增目的片段。PCR扩增体系同表1,引物为表2中的mapk1-F1和mapk1-R1,扩增条件为:在98℃下预变性3 min;在98℃下变性30 s,在67℃下退火10 s,在72℃下延伸3 min,此处共进行35个循环;最后在72℃下延伸5 min。PCR产物经电泳检测,将与目的序列长度一致的条带用天根的DNA回收试剂盒回收,回收产物连接至pMD19-T载体,并转化到天根的大肠杆菌DH5α感受态细胞中。将转化物涂到含有氨苄抗性的普通肉汤琼脂平板上,37℃培养过夜,第2天进行蓝白斑筛选。挑取白色单个菌落扩摇菌液,通过pMD19-T通用引物,以扩摇的菌液为模板进行PCR,通过凝胶电泳检测筛选出含有正确大小插入片段的阳性克隆,并随机选择5个片段大小正确的菌液进行测序。测序结果与参考序列相一致的菌液提质粒用于后续表达质粒构建。
1.2.5 构建pCMV-Tag2B-mapk1表达质粒 以上一步连接pMD19-T成功的质粒为模板,利用加酶切位点的上下游引物mapk1-F2和mapk1-R2(表2)和高保真酶扩增含有酶切位点的目的片段,扩增条件同上。双酶切位点为EcoR I和Xho I,引物中酶切位点加下划线,酶切位点之前的3个碱基为保护碱基。经电泳检测,将扩增后条带单一的PCR产物纯化,纯化产物与pCMV-Tag2B质粒(图2-A)分别进行双酶切。双酶切产物用T4连接酶连接,构建pCMV-Tag2B-mapk1质粒(图2-B),转化至 100 μL的DH5α感受态细胞中,转化后的感受态经过热击冰置后,加入500 μL 无抗性的LB液体培养基进行复苏。取适量复苏后的挑单克隆摇菌,阳性克隆一部分送测序,一部分保存菌液。将测序成功的菌液提取质粒,并进行双酶切检测。
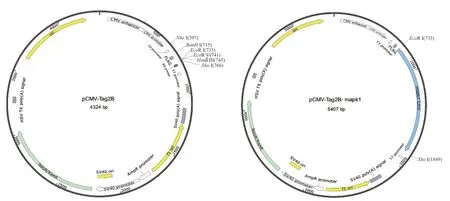
图2 pCMV-Tag2B质粒(A)与pCMV-Tag2B-mapk1重组质粒(B)示意图Fig. 2 Schematic diagram of pCMV-Tag2B plasmid(A)and pCMV-Tag2B-mapk1 recombinant plasmid(B)
1.2.6 检测mapk1对tp53作用 人胚胎肾细胞HEK293T 细胞培养于 10% FBS-DMEM 培养液中,置于5% CO2,37℃的培养箱中,每2 d 传代 1 次。HEK293T 细胞转染前 24 h 接种于24孔细胞培养板中,接种的细胞密度约 5.0×104/孔,汇合率达到 70%。 将 内 参 质 粒 phRL-TK、pGL3-tp53-Luc、pCMV-Tag2B和pCMV-Tag2B-mapk1配制成310 ng每孔的转染复合物(表4)。复合物混匀后于 28℃孵育 15 min,加到上述24孔细胞培养板中。转染后的HEK293T 细胞放在37℃,5% CO2培养箱中培养;培养 36 h 后按照 Promega Dual-Luciferase®Reporter Assay System 使用说明进行双荧光素酶检测,计算firefly luciferase 与 Renilla luciferase 的比值。每个样品设置3个复孔,每组实验均重复3次。

表4 转染复合物配制表Table 4 Formulation table of transfected compound
2 结果
2.1 斑马鱼tp53启动子序列分析结果
从NCBI网站获得斑马鱼tp53基因的启动子序列,具体序列信息如图3,约2 000 bp,以转录起始位点为+1。经 AliBaba 2.0 软件预测该序列包含Oct-1(TATGTAAAGC)、Sp-1(AGATCCCGCC)、c-Jun(CTGACGTCAC)、CREB(CTGACGTCAC)、CREBP1(CTGACGTCAC)、NF-kappa B1(AGGGGAATCC)和RAR-alpha1(TTGAACTTTT)等多个转录因子结合位点,均已在序列中标注出来。通过 Meth Primer软件在该启动子片段中没有预测到CpG 岛(图4)。

图3 斑马鱼tp53启动子特征序列分析Fig. 3 Analysis of the characteristic sequence of the tp53 promoter in zebrafish

图4 Meth primer-Design 软件预测 tp53 基因启动子区CpG岛Fig. 4 Prediction of CpG island in tp53 promoter region by Meth Primer-Design software
2.2 成功构建出斑马鱼tp53启动子报告基因载体
将斑马鱼tp53启动子片段连接到pGL3-Enhancer质粒上,构建出pGL3-tp53-Luc重组质粒。pGL3-tp53-Luc重组质粒通过双酶切鉴定,琼脂糖电泳结果得到两个条带。约5.0 kb 的为pGL3-Enhancer,约2.0 kb 的为tp53启动子片段(图5);随后对阳性质粒送测序,序列比对结果进一步验证pGL3-tp53-Luc构建正确。
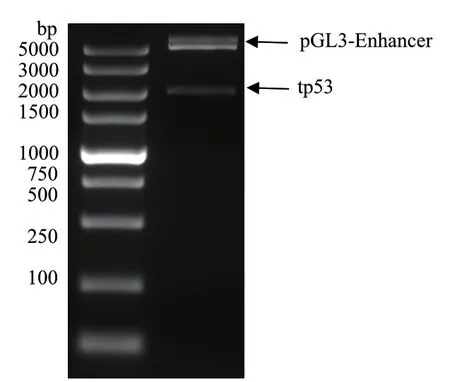
图5 pGL3-tp53-Luc双酶切检验Fig. 5 Double enzyme restriction assay of pGL3-tp53-Luc
2.3 tp53报告基因在HEK293T和ZF4细胞中均有活性
将对照组pGL3-Enhancer和实验组pGL3-tp53-Luc质粒转染至人胚胎肾细胞HEK293T和斑马鱼胚胎成纤维细胞ZF4中。通过双荧光素酶报告基因活性检测,发现在HEK293T中,pGL3-tp53-Luc的luciferase活性是pGL3-Enhancer的17倍左右(图6-A),在 ZF4细胞中,pGL3-tp53-Luc的 luciferase活性是pGL3-Enhancer的9倍左右(图6-B)。表明本研究成功构建斑马鱼tp53启动子,并且该启动子具有良好的表达活性。

图6 pGL3-tp53-Luc活性Fig. 6 Activity of pGL3-tp53-Luc
2.4 成功构建出pCMV-Tag2B-mapk1表达质粒
将斑马鱼mapk1 CDS序列连接到pCMV-Tag2B质粒上,构建出pCMV-Tag2B-mapk1表达质粒。我们运用 DNAMAN 软件将斑马鱼Mapk1与人和小鼠的MAPK1氨基酸序列进行比较,结果显示,斑马鱼和人的Mapk1一致性为91.33%,斑马鱼和小鼠的Mapk1一致性为90.79%(表5)。用斑马鱼cDNA作为模板,以斑马鱼mapk1 CDS序列的两端设计引物,PCR 产物经电泳检测,扩增的条带与目标条带大小相符。mapk1 CDS序列大小为 1 110 bp(图7-A)。把表达质粒pCMV-Tag2B-mapk1双酶切鉴定,琼脂糖电泳结果分别得到两条目的条带,4 324 bp为pCMV-Tag2B载体的条带,1 110 bp为mapk1的CDS序列片段(图7-B)。随后对阳性质粒送测序,序列比对结果进一步验证pCMV-Tag2B-mapk1构建正确。

表5 斑马鱼与人和小鼠mapk1基因氨基酸序列对比Table 5 Comparison of amino acid sequences of mapk1 gene between zebrafish and human and mouse
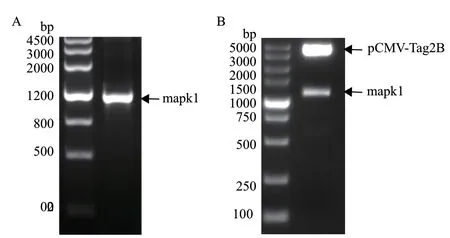
图7 mapk1 CDS片段扩增(A)和 pCMV-Tag2B-mapk1双酶切检验(B)Fig. 7 mapk1 CDS fragment amplification(A)and pCMV-Tag2B-mapk1 double enzyme restriction assay(B)
2.5 斑马鱼mapk1可促进tp53表达
将pCMV-Tag2B-mapk1和下游tp53启动子报告基因pGL3-tp53-Luc共同转染到HEK293T细胞中,在24 h后进行luciferase验证。结果发现共转组的luciferase活性是对照组的3倍左右(图8),表明表达质粒pCMV-Tag2B-mapk1可以促进报告基因质粒pGL3-tp53-Luc的表达。

图8 pCMV-Tag2B-mapk1和pGL3-tp53-Luc共同转染HEK293T 细胞后荧光素酶相对表达量Fig. 8 Relative expression of luciferase in the HEK293T cells co-transfected with pCMV-Tag2B-mapk1 and pGL3-tp53-Luc plasmids
3 讨论
细胞凋亡对维护正常组织和器官的细胞恒定与生长平衡、乃至机体衰老等方面具有重要的调控作用[18]。斑马鱼与人类的基因相似度高达87%,目前,在斑马鱼基因库中鉴定出许多与哺乳动物凋亡相关的基因家族,如tp53,caspase及其他凋亡调控基因等[19],表明大部分凋亡通路在斑马鱼和高等脊椎动物的进化上有很高的保守性。因此,在细胞凋亡与发育研究领域,斑马鱼被认为是一种有效的实验动物模型。
MAPK1在应激条件下调节细胞凋亡的重要性已被广泛研究[4,20-22];在人类细胞中,MAPK1活化TP53是DNA损伤诱导细胞凋亡的重要机制[23];然而斑马鱼mapk1基因对tp53基因的转录调控作用目前未知。本研究采用基因重组技术将斑马鱼 tp53基因启动子连接到具有多克隆位点的 pGL3-Enhancer载体质粒上,构建能够瞬时表达斑马鱼 tp53活性的报告基因载体质粒pGL3-tp53-Luc,通过荧光素酶活性检测,在HEK293T细胞和ZF4细胞中,斑马鱼tp53启动子均表现出很高的活性,与对照组相比,活性分别高达17%和9%,表明pGL3-tp53-Luc质粒构建成功。通过氨基酸序列对比,斑马鱼Mapk1蛋白氨基酸序列与人类的一致性高达91.33%,与小鼠的一致性高达90.79%,表明mapk1基因在斑马鱼、人类与小鼠中的功能是保守的。通过基因重组技术将斑马鱼mapk1基因编码区序列连接到pCMVTag2B载体上,构建能够发挥mapk1基因功能的pCMV-Tag2B-mapk1表达质粒。将pGL3-tp53-Luc与pCMV-Tag2B-mapk1质粒共同转染到HEK293T细胞中,通过双荧光素酶报告基因系统检测,表明斑马鱼mapk1基因可促进tp53基因表达。
转录因子调节细胞中的基因转录[24]。对斑马鱼tp53基因候选启动子的生物信息分析得到8个转录因子结合位点,它们分别是Oct-1、Sp1、c-Jun、CRE-BP1、CREB、NF-kappaB1和 RAR-alpha1;但是未检测到mapk1的结合位点。研究显示,Sp1参与了与细胞增殖、凋亡抗性和血管生成有关的基因的调控[25],NF-kappaB1能够调节翻译水平上的TP53表达[26]。在哺乳动物中,c-Jun通过转化成纤维细胞中的TP53来抑制凋亡[27],CREB信号传导在缺氧诱导的线粒体功能障碍和软骨细胞凋亡中发挥了关键作用[28]。同时,有研究证明 c-Jun[29]与CREB[30]是mapk1的下游调控靶点。所以本研究中,mapk1有可能直接通过调控c-Jun或CREB活性来促进tp53表达,也可能通过其他基因发挥间接作用,具体调控方式有待进一步研究。
4 结论
本实验通过生信网站分析,得知斑马鱼tp53基因的启动子区无CpG岛位点,包含7个转录因子结合位点;斑马鱼与人和小鼠MAPK1氨基酸的一致性分别为91.33%和90.79%。用双酶切法构建了斑马鱼tp53基因的启动子报告基因质粒pGL3-tp53-Luc与mapk1基因的表达载体质粒pCMV-Tag2B-mapk1。通过双荧光素酶报告基因活性检测,得知pGL3-tp53-Luc在HEK293T中的luciferase活性是pGL3-Enhancer的17倍左右,在 ZF4细胞中的luciferase活性是pGL3-Enhancer的9倍左右。在HEK293T细胞中过表达pCMV-Tag2B-mapk1 质粒后pGL3-tp53-Luc的luciferase活性是对照组的3倍左右。
