芽孢杆菌苎麻脱胶动态过程分析
2021-02-10吴亚刘一舒潼王慧慧李攀登杨英余龙江
吴亚 刘一 舒潼 王慧慧 李攀登 杨英 余龙江
(华中科技大学生命科学与技术学院,武汉 430074)
苎麻纤维具有单根纤维长、韧性强、导热性好、吸湿散热快、防霉、抗菌、抗紫外线等优点,被誉为“天然纤维之王”,广泛应用于纺织、家居、汽车等行业。我国苎麻纤维产量占世界的95%,所以,苎麻又被称为“中国草”[1],是我国特有的天然纺织原料。苎麻韧皮部被称为原麻,干燥后的原麻中含有多种化学成分,其主要成分是纤维素,约占70%。剩下的30%的非纤维素成分在纺织工业中被称为胶质。这些胶质主要包括果胶、半纤维素、水溶物、木质素、脂蜡脂、灰分。在苎麻纺织工业中,苎麻脱胶过程称为“脱胶”[2-3]。目前市面上常用的脱胶方法有化学脱胶、生物脱胶、微生物脱胶[4-5]。
化学脱胶是指利用苎麻韧皮中纤维素和胶质对酸、碱和氧化剂的稳定性差异进行脱胶,国内外普遍采用此类方法。由于化学脱胶工艺过程中需要满足的条件比较复杂,纤维素与半纤维素物质对化学反应试剂及高温的稳定性没有严格界线。因而苎麻化学脱胶工艺存在工艺多、耗时长、能耗高、劳动强度大、污染严重等缺点,无法满足绿色环保的要求[6-7]。而且,苎麻原纤维的酸处理对苎麻纤维的损伤很大,导致苎麻精干麻质量下降,不能作为高档纺织品生产的原料,严重影响了苎麻精干麻的价格。
酶脱胶是利用脱胶菌产生的一系列脱胶酶进行脱胶,使原麻上的半纤维素、果胶等物质脱离下来,从而达到脱胶的目的[8]。常用的脱胶酶包括半纤维素酶、果胶酶和木质素酶三大酶系。Zhang等[9]将果胶酶、半纤维素酶等酶混合作用于苎麻纤维脱胶,脱胶后的纤维舒适度、纤维强度、白度和残胶率都有了显著改善,有利于后续的工业纺织。Basu等[10]利用从短小芽孢杆菌中克隆得到的果胶裂解酶处理苎麻,使纤维的胶质减少了25%。果胶在原麻胶质中起到与其他成分胶连的作用,因而对于果胶的去除十分重要。酶法脱胶反应条件较温和,对苎麻纤维损伤较小,但由于酶制剂研发成本较高,目前未能取得大规模应用。
微生物脱胶是利用能产生多种酶的菌株扩大培养后接种到苎麻上,利用降解后的单糖作为营养物质进行生存繁殖。微生物脱胶最关键的是脱胶菌的筛选,一株好的菌株可达到非常好的脱胶效果[11]。Saikia等[12]分别利用枯草芽孢杆菌和霉菌进行苎麻脱胶处理,经细菌和真菌处理4 d后,纤维残余胶量分别下降到10.4%和9.7%。Wang等[13]利用高产果胶酶的蜡样芽胞杆菌PO5联合高产木聚糖酶的假单胞菌X12在开放环境处理苎麻韧皮60 h,最终脱胶率达79.6%。本团队樊培和张非等[14-15]通过分析苎麻韧皮纤维胶质成分及其与脱胶酶的相互作用,建立了脱胶优势菌株的筛选策略,获得系列优势脱胶菌株如HG-25、HG-28、HG-49,并建立了苎麻精干麻生物清洁生产技术,在微生物混合脱胶、发酵工艺优化、废水循环利用等方面都取得了不错的成绩,工业化应用已形成一定规模。微生物脱胶工艺取得了越来越多的突破进展,是目前研究的重点,但是仍存在脱胶时间较长,不同批次菌株脱胶效果不均匀,残胶率较高等问题,本实验室保藏的芽孢杆菌LY11含有丰富的果胶、甘露聚糖酶系,能高效利用苎麻韧皮胶质增殖,其生物量达到5.63 g/L,生物脱胶过程中,LY11产果胶酶活与甘露聚糖酶活较高,且不产纤维素酶,可作为优良的苎麻脱胶菌株。因而需要对其脱胶过程动态变化进行深入研究,阐明脱胶过程机理,挖掘影响微生物脱胶关键因素,优化相应的控制方法,最终实现微生物高效稳定脱胶。
本实验旨在通过分析苎麻生物脱胶过程中脱胶微生物、脱胶酶活、苎麻化学成分变化,揭示生物脱胶过程特征,确定脱胶关键酶系,揭示生物脱胶过程机理,为实现微生物脱胶技术大规模应用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株 菌株为华中科技大学资源生物学与生物技术研究所选育并保藏的芽孢杆菌LY11,苎麻原麻产自湖北省咸宁市,由湖北精华纺织集团有限公司提供。
1.1.2 主要培养基 LB固体培养基:1%蛋白胨,0.5%酵母粉,1%氯化钠,1.2%琼脂粉,pH自然,高压蒸汽灭菌20 min。菌种的短期保藏用斜面培养基,菌种的纯化用平板培养基。
LB液体培养基:1%蛋白胨,0.5%酵母粉,1%氯化钠,高压蒸汽灭菌20 min。LB液体培养基用于菌种的活化。
1.1.3 试剂和仪器 酵母粉,氯化钠,蛋白胨,琼脂粉,浓盐酸,冰醋酸,3,5-二硝基水杨酸,磷酸二氢钾,羧甲基纤维素钠,魔芋精粉,葡萄糖,果胶,无水亚硫酸钠,四水酒石酸钾钠,苯酚,木糖,甘露糖,D-半乳糖醛酸,木聚糖,氢氧化钠,草酸铵,醋酸,次氯酸钠。Nova NanoSEM450场发射扫描电子显微镜,台式高速离心机H1650W,FE20实验室pH计,电热鼓风干燥箱 101A3ET,紫外分光光度计UV1600PC,低速离心机TDL5A。
1.2 方法
1.2.1 菌种制备 将保存在-80℃冰箱中的菌株转入一组新鲜固体培养基中,37℃培养12 h,然后转入另一组新鲜固体培养基中,37℃培养12 h,使菌株充分活化。然后,将菌株接种于液体培养基中,在37℃、180 r/min培养OD600值至0.5左右,约6 h。
1.2.2 苎麻微生物脱胶方法 取原麻5 g左右,将麻样于105℃烘箱烘至恒重后称重。浴比为1∶10,接种量10%(针对脱胶体系),转速180 r/min,温度37℃脱胶16 h,期间每2 h取样测定pH、酶活、生物量。苎麻化学成分定量分析方法:苎麻含胶率、脱胶率、残胶率及各成分含量(脂蜡质、半纤维素、果胶、木质素、灰分)根据中华人民共和国国家标准GB/T 5889-86苎麻化学成分定量分析方法进行测定。
1.2.3 生物脱胶过程脱胶液菌体及还原糖变化的动态分析 菌体个数测定,每2 h取0.1 mL脱胶菌液用无菌生理盐水稀释适当浓度,于血球计数板进行计数,杂菌根据菌落形态并结合镜检进行测定。还原糖变化分析,利用分光光度计测定其吸光度,以葡萄糖标准曲线为标准表征其还原糖含量。
1.2.4 酶活测定 采用二硝基水杨酸(DNS)法测定其果胶酶、甘露聚糖酶、木聚糖酶和纤维素酶活力。果胶酶活力测定原理:在果胶酶作用下,果胶可被降解为还原性糖,DNS在碱性条件下可与半乳糖醛酸发生反应,且产物在沸水浴条件下显色。产物颜色的深浅与生成的还原糖的量成正比,从而通过反应液颜色表征脱胶液中果胶酶的活力。
果胶酶活测定:取0.9 mL果胶溶液于试管中,加入0.1 mL脱胶上清液,37℃反应10 min,然后加入1.5 mL DNS溶液混合均匀于沸水浴条件下5 min,冰水冷却10 min后测定吸光值 OD540。酶活性定义:在特定条件(37℃、pH7.0)下,每分钟内转化生成1 μmol半乳糖醛酸所需酶量为一个酶活性单位U。甘露聚糖酶、木聚糖酶和纤维素酶活力测定时底物分别为甘露聚糖、木聚糖和羧甲基纤维素钠,产物分别为甘露糖、木糖和葡萄糖。
1.2.5 苎麻原麻形态分析 通过对不同处理时期的苎麻进行取样,对苎麻硬条、硬块、夹生、斑疵、碎麻、手感软硬程度的分析进行表观判断。通过扫描电镜观察麻纤维的表面形貌。具体操作步骤如下:将苎麻样品送华中科技大学国家光电实验室。将样品切至0.5 cm左右,贴于铜板上,喷金30 s,在Nova nanosem450场发射扫描电镜下观察。
2 结果
2.1 苎麻生物脱胶过程中菌体个数及还原糖的动态分析
由图1可知,菌株LY11在苎麻生物脱胶过程的延滞期较短,4-6 h内其生物量迅速增加,还原糖含量也迅速增加,这说明在脱胶过程中,LY11分泌的水解酶使胶质大量降解,产生的单糖为其生长提供营养成分从而使其大量繁殖。6-8 h还原糖含量基本不变,8-10 h出现下降,说明此时菌体处于生长期,对糖利用率提高。接种脱胶12 h时,脱胶菌个数最多,达到21.458×109CFU/mL,12 h后菌体处于衰亡期,还原糖含量由于菌体利用率降低而上升。接种后,杂菌的生长速度相对较慢,直至衰老期,说明菌株LY11比其他菌株有一定的生长优势,杂菌在脱胶过程中不会对其造成太大的影响。

图1 苎麻生物脱胶过程脱胶液还原糖含量和菌体量变化Fig. 1 Variations in reducing sugar content and bacterial mass in the degumming solution from the biological degumming process of ramie fiber
2.2 苎麻生物脱胶过程中胶质成分的动态分析
2.2.1 苎麻原麻胶质成分分析 对原麻进行了成分测定,其包含了多种结构复杂的化学成分,如表1所示。纤维素含量占到73.75%。其余物质在麻纺工业中称其为胶质,这些胶质主要包括果胶4.27%、半纤维素(木聚糖、甘露聚糖)13.87%、木质素0.95%、水溶物5.58%、脂蜡质1.58%。由此可知,对于苎麻胶质的去除,主要是对于半纤维素和果胶的去除,因此这几种相对应的水解酶对于苎麻脱胶是十分重要的。

表1 苎麻原麻化学成分Table 1 Chemical composition of raw ramie fiber
2.2.2 苎麻生物脱胶过程中胶质成分动态分析 由图2可知,经过16 h生物脱胶后,苎麻原麻残胶量由初始的26.25%降至11.48%,脱胶率达56.27%。2-8 h是脱胶的高峰期,10 h后,脱胶率呈缓慢上升趋势。

图2 苎麻生物脱胶过程脱胶率和残胶量变化Fig. 2 Variation of degumming rate and residual gum amount during the biological degumming process of ramie fiber
由图3可知,在脱胶初期,水溶性物质的去除率较高,在脱胶前6 h,水溶性物质的去除率约为60%。脱胶16 h后,果胶去除率高达93.9%,果胶的大量去除,保证了后续半纤维素的协同降解。菌株LY11对半纤维素的去除率为39.6%,脱胶后脂蜡质的去除率为45.3%,其主要化学成分为高级脂肪酸和高级醇形成的酯类,木质素含量在整个脱胶过程中几乎没有变化,因而菌株LY11几乎不能降解木质素。
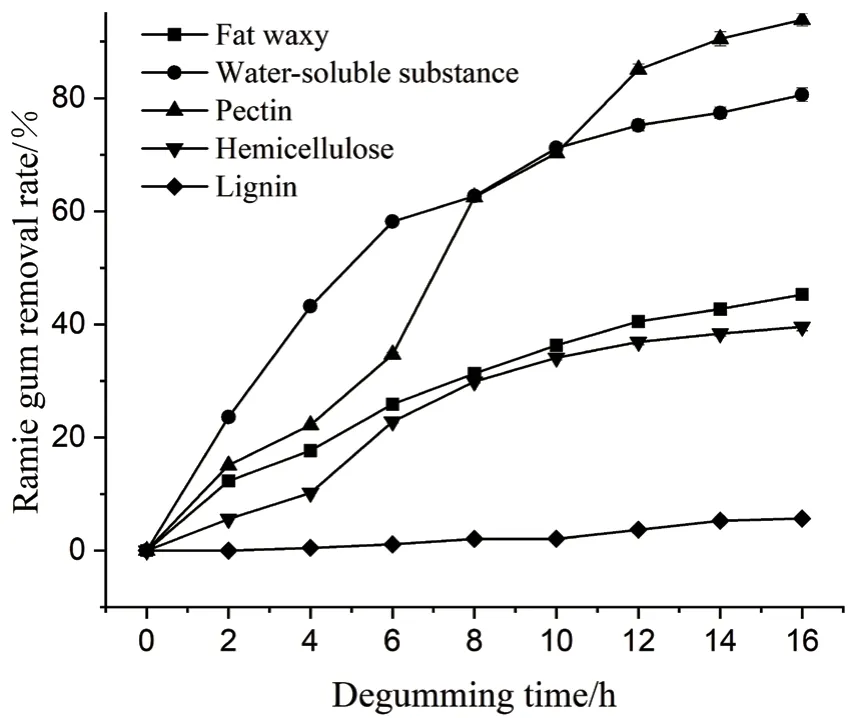
图3 苎麻生物脱胶过程各胶质成分去除率变化Fig. 3 Variations in the removal rate of various colloid components in the biological degumming process of ramie fiber
2.3 苎麻生物脱胶过程中脱胶酶活性的动态分析
由图4可知,在LY11生物脱胶过程中,一直检测不到纤维素酶酶活,这对于苎麻脱胶十分有利,避免了其有利成分(纤维素)的损失。果胶酶与甘露聚糖酶活性在0-8 h内先升高,8-16 h缓慢降低,二者均在脱胶8 h时酶活最高,通过图2从脱胶率和残胶量的变化趋势可以看出,菌株LY11的脱胶效率与果胶酶、甘露聚糖酶的酶活变化趋势基本一致。果胶酶达到116.4 U/mL,反应16 h后酶活为77.73 U/mL,其较高酶活保证了黏连胶质的顺利去除,使其去除率达到了93.9%。甘露聚糖酶酶活也较高,最高酶活达到96.72 U/mL。同时在脱胶过程中检测到木聚糖酶活性,但其酶活力很低。

图4 苎麻生物脱胶过程菌株LY11酶活变化Fig. 4 Variations of enzyme activity of strain LY11 in the biological degumming process of ramie fiber
2.4 苎麻生物脱胶过程中苎麻形态动态分析
为直观感受菌株LY11苎麻脱胶效果,对0-16 h脱胶苎麻的手感柔软程度、外观色泽、硬块、硬条、斑疵、夹生、碎麻等指标进行评定。如图5所示,苎麻原麻呈黄褐色,手柄硬脆,其中硬块条较多,纤维相互缠绕,苎麻皮、壳等杂质较多。菌株LY11的苎麻外观和手感随脱胶时间呈显著差异。如表2所示,在脱胶初期,苎麻纤维的手感仍然是硬而直的,外观与原麻相似。脱胶8 h后,开始出现丝状纤维,整个纤维开始变软。脱胶8-16 h后,析出大量有光泽的白色纤维,手感柔软,无硬块、硬条、斑点疵点和断麻。苎麻精干麻呈纯白色,光泽丝状,非常柔软,触感温和,毛刺少,可作为优良的纺织原料。

表2 苎麻生物脱胶过程不同时段苎麻外观评定Table 2 Appearance evaluation of ramie at different periods during the biological degumming process of ramie fiber

图5 苎麻生物脱胶过程不同时段苎麻外观Fig. 5 Appearance of ramie at different periods during the biological degumming process of ramie fiber
由图6的扫描电镜观察结果可知,菌株LY11生物脱胶4 h后,苎麻纤维表面的胶质有所减少,纤维之间的黏连程度降低。脱胶8 h后,苎麻纤维表面的胶质成分明显减少,纤维有分散的趋势。脱胶12 h后,部分相邻纤维开始分离,纤维表面变得光滑。脱胶结束时,大部分非纤维素成分被去除,苎麻纤维表面光滑,仅有少量胶质残留,苎麻单纤维基本分离。可见,菌株LY11对苎麻原麻脱胶16 h后,大部分果胶、半纤维素等胶质成分被去除,苎麻单纤维分离度好,表面光滑。结果表明,脱胶菌株能有效、均匀地渗透到苎麻纤维内部,完成脱胶。

图6 苎麻生物脱胶过程不同时段苎麻扫描电镜观察Fig. 6 Scanning electron microscope observation of ramie at different periods during the biological degumming process of ramie fiber
3 讨论
通过对脱胶过程中菌体数量、酶活以及还原糖变化分析可知,在脱胶初期0-4 h内,苎麻中大量的水溶性糖溶解,导致脱胶液中还原糖含量迅速增加。此时,菌株仍还不能大量使用还原糖,果胶酶、甘露聚糖酶活性也不断增强,从而使还原糖含量上升。进入对数生长期6-10 h后,细菌大量繁殖,迅速消耗还原糖,还原糖含量呈现下降趋势,果胶酶、甘露聚糖酶酶活达到较高水平,说明菌株LY11分泌的果胶酶、甘露聚糖酶能够有效降解胶质,产生大量还原糖,还原糖作为营养物质供菌体生长繁殖和代谢,从而还原糖含量降低。而在脱胶后期10-12 h,菌体虽然还在生长,但速度缓慢,已经处于稳定期,此时对还原糖的消耗降低,然而酶促反应仍在进行,从而使得还原糖含量升高。12-14 h,细菌处于衰老期,且半纤维素酶酶活降低,可能是由于其酶稳定性较差,使菌体对还原糖利用率下降,还原糖含量逐渐增加。本研究也进一步丰富了孙庆祥研究团队[16]提出的菌产酶、酶脱胶、胶养菌的理论。
对比苎麻原麻生物脱胶过程各胶质成分去除率可知,在脱胶16 h后,果胶去除率高达93.9%,结合果胶种类多样性,说明菌株LY11分泌的果胶酶系足够丰富;然而,半纤维素的脱除率在脱胶结束后仅为39.6%,仍残留60.4%的半纤维素,表明菌体所含半纤维素酶系有待进一步丰富,同时,苎麻原麻所含木聚糖、甘露聚糖侧链会被乙酰基、半乳糖、葡萄糖醛酸所取代[17],因而LY11中木聚糖酶、甘露聚糖酶系可能对其原位降解效果较差。脱胶后脂蜡质的去除率为45.3%,其主要化学成分为高级脂肪酸和高级醇形成的酯类,芽孢杆菌LY11基因组不存在降解脂蜡质的基因,可能是由于该菌株降解了苎麻中的其他胶质成分后,脂蜡质从苎麻中脱落,从而使其脱除。在本次实验中甘露聚糖酶始终保持较高酶活,而木聚糖酶活较低,最高酶活<5 U/mL。本课题组前期对高效脱胶菌株HG-49进行了全基因组测序,发现其缺少半纤维素酶系[18],后构建了木聚糖酶组成型分泌表达载体p213,并转入脱胶菌HG-49,使其木聚糖酶活性得到显著提高,后进行脱胶实验,使苎麻脱胶率提高了3.9%[19],证实木聚糖酶在苎麻半纤维素降解中起到相当重要的作用。当前有研究指出在苎麻半纤维素中甘露聚糖含量高于木聚糖含量[20],因而推测菌株LY11脱胶过程中半纤维素胶质的降解可能主要是由于甘露聚糖酶的作用,使其40%左右的半纤维素被降解。先前研究认为果胶酶和木聚糖酶在降解苎麻胶质时具有关键作用,而忽略了甘露聚糖酶。本课题组王亚伟[21]从数据库中挖掘到甘露聚糖酶ManB,后将异源表达的不同浓度的 ManB蛋白酶与HG-49菌株联合使用对苎麻韧皮进行原位脱胶处理,发现添加400 IU/mL ManB时苎麻韧皮脱胶率从82.2%提高到85.6%。该研究也表明甘露聚糖酶在降解半纤维素过程中同样发挥非常重要的作用,进一步丰富了对苎麻关键脱胶酶体系的认识。
芽孢杆菌LY11虽对果胶具有优异的去除能力,但去除半纤维素的能力有待进一步加强,相关半纤维素酶系有待丰富。有研究表明,部分木聚糖酶对纯底物,例如玉米芯木聚糖进行降解时,虽表现出较高活性,但其在植物组织背景下进行原位降解木聚糖时,效率却大大降低。因此,在选择半纤维素酶系相关种类酶时,需注意选择具有高效原位降解能力的酶。可利用当前已知具有高效原位脱胶能力的半纤维素酶的菌株,与芽孢杆菌LY11进行复合脱胶,也可从此类菌种克隆相关基因,构建重组工程菌。另一方面,研究在植物组织背景下原位处理时半纤维素酶活性降低的机制,将为提高苎麻微生物脱胶效率提供更加丰富的理论指导。同时,本菌株分泌的甘露聚糖酶和果胶酶进行原位脱胶时,能够有效的降解果胶和甘露聚糖等胶质成分,表明本菌株中相关的果胶酶、甘露聚糖酶基因可作为苎麻脱胶关键基因来源,用于构建重组工程菌,为苎麻胶质的降解提供强力支持。
4 结论
本文通过分析菌株LY11生物脱胶过程中菌体数量变化、酶活变化、单糖含量变化、胶质去除率等数据,发现微生物脱胶遵循“菌产酶、酶脱胶、胶养菌”理论,兼具高活性的果胶酶和半纤维素酶是实现微生物彻底脱胶的核心要素,维持其酶促动力学稳定性是提高脱胶效率的关键因素。
