甾体化合物绿色生物制造:从生物转化到微生物从头合成
2021-02-10熊亮斌宋璐赵云秋刘坤刘勇军王风清魏东芝
熊亮斌,宋璐,赵云秋,刘坤,刘勇军,王风清,魏东芝
(1 华东理工大学,鲁华生物技术研究所,生物反应器国家重点实验室,上海 200237;2 上海健康医学院,协同科研中心,上海 201318)
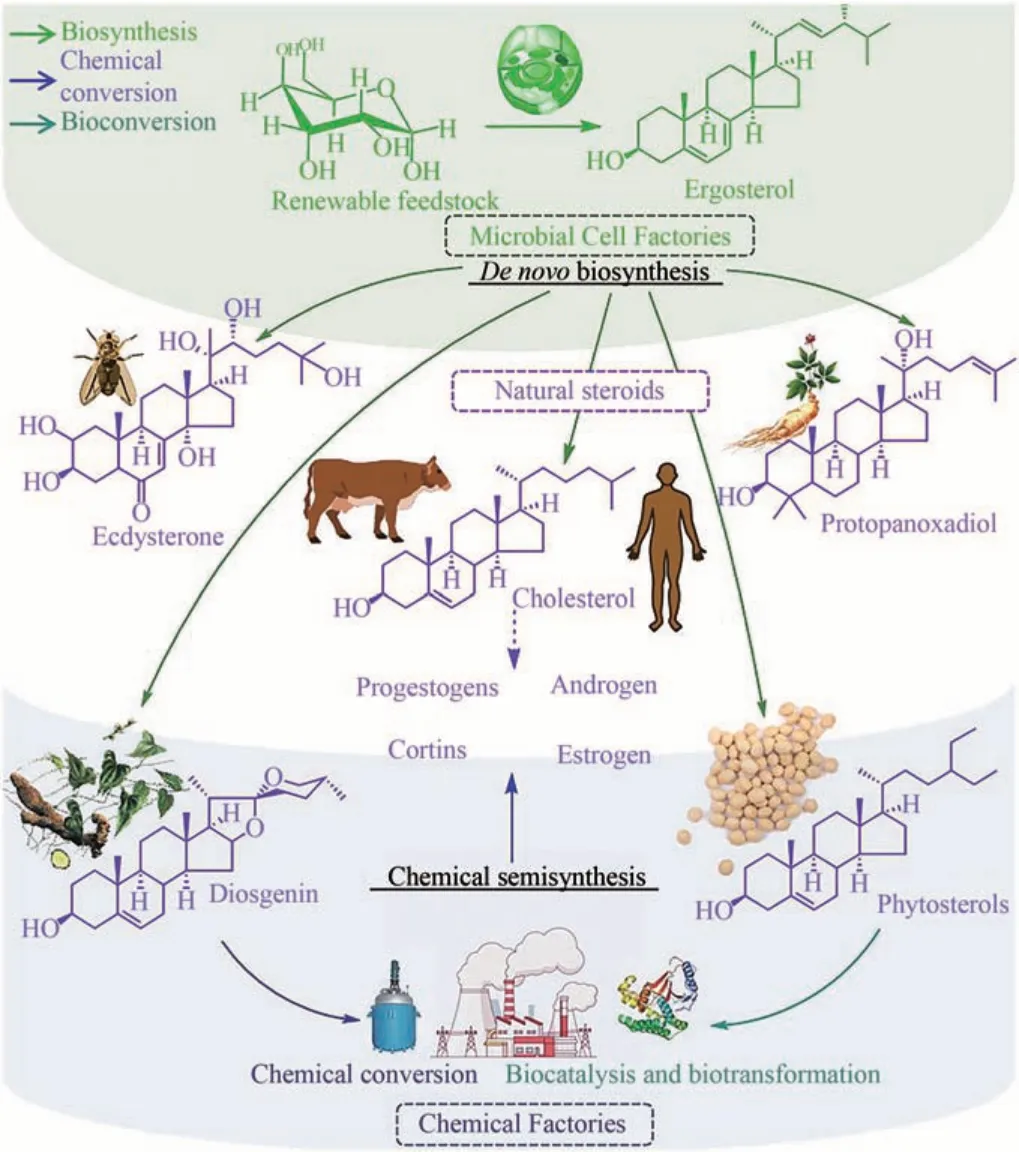
甾体亦称类固醇,是一类以环戊烷多氢菲为母核的有机小分子,广泛存在于动植物、真菌及个别细菌,其在生命体生存繁育的过程中,作用极其多样且无可取代。天然甾体一方面是细胞膜的重要组分,如胆固醇等对于维持细胞膜流动性和稳定性不可或缺[1]。在生物体内,甾体通常扮演着“激素”角色[2-4],例如人体内的性激素、植物体内的生长激素芸苔素内酯、昆虫体内的蜕皮激素等。在哺乳动物体内,肾上腺皮质激素、性激素和蛋白同化激素等,密切参与了生殖、骨骼和大脑发育、生物效应调控及稳态维持等生命过程[5]。因此,人们很早就发现其可作为一种强效药物,用于消炎、避孕、抗过敏、免疫调节、内分泌紊乱和老年性疾病等[6]。此外,甾体还具有非激素的功能,如抗病毒、抗抑郁、保护神经、治疗心脑血管疾病以及促进骨骼发育等[7]。随着甾体化合物愈加普遍地应用于临床,从而逐渐形成了一类依据结构特征命名的药物——甾体药物。
目前,全球获准上市的甾体药物约有400 余种[8-9],其中如地塞米松和倍他米松等,在用于癌症、重症感染和器官移植等危重病症时疗效显著。作为基础卫生体系的必备药物,甾体药物常作为战略性物资进行储备[10-11]。值得一提的是,在抗击SARS,以及目前仍在全球肆虐的新冠肺炎疫情中,甾体药物发挥了关键的治疗作用[12]。2020 年10 月,世界卫生组织通过系统对比指出,地塞米松是对重症患者唯一有效的药物,可将依靠呼吸机维持生命的重症患者死亡率降低约三分之一[13-15]。除此之外,甾体在农业[16]、环境[17]和化工[18]等领域,也有着广阔的应用前景。由此,甾体的工业化制造是一项关乎国计民生的核心产业,对于维护人类健康、促进经济发展等意义重大。
1 甾体制造的发展历程
甾体药物的发现和工业化生产,是20 世纪全球医药工业最成功的两大进展之一。从20 世纪初发现甾体化合物具有强大的药用功效,到如今甾体制药已成为一个庞大的产业,其工业化过程大致经历了以下4个阶段:
(1)初创阶段(近代—20 世纪40 年代) 受动物腺体提取物可用于内分泌、心血管等疾病治疗的启发,人们猜测其内容物可能具有强大的生理和药理活性。由此,先后从动物组织中分离得到了雌酚酮、雌二醇、雌三醇、睾丸素、皮质酮等甾体激素成分[19]。此阶段,3 位德国科学家Wieland、Windaus 和Butenandt 分别完成了胆酸、维生素D 以及雌甾酮、雄甾酮、孕甾酮等性激素活性成分的鉴定,从而分别获得1927 年、1928 年和1939 年的诺贝尔化学奖[20]。然而由于动物腺体的成分复杂、甾体含量极低,加之收集比较困难,导致此阶段的甾体药物不仅供应种类有限,并且价格极其高昂。例如,当时从动物腺体提取的黄体酮,单价曾高达1000 美元/g,远超黄金价格。
(2)起步阶段(20 世纪40—60 年代) 天然甾体来源有限、价格高昂,严重限制了甾体药物的临床应用普及。随着化学制药工业的兴起,人们开始尝试通过化学合成生产此类物质。1940 年,宾夕法尼亚州立大学的Russel Marker 发现薯蓣属植物中存在一种甾体皂苷元(俗称薯蓣皂素),以此为原料经三步降解即可生成孕烯酮醇,再经氧化又可高效合成黄体酮(Marker三步降解)[21]。随后,Marker 又在墨西哥找到了富含薯蓣皂素的小穗花薯蓣,解决了原料来源问题。此后利用薯蓣皂素为原料,经Marker 降解生产不同的甾体药物得到了蓬勃发展,最终形成了沿用至今的“薯蓣皂素-双烯”半合成体系(图1)。本阶段,黄体酮等甾体药物的价格大幅下降,有力推动了甾体激素药物在临床上的广泛应用。
(3)成熟阶段(20 世纪60—80 年代) 尽管薯蓣皂素资源分布广泛,但含量高且适合开发的品种却十分有限。早期,甾体制药工业依赖于墨西哥供应原料,甾体制药技术则被欧美垄断,随后,三个标志性事件的发生,奠定了延续至今的甾体制药工业格局。①1958 年,黄鸣龙教授以我国国产的薯蓣皂素为原料,开创了国际领先的可的松七步法合成,由此推动了肾上腺皮质激素类药物生产技术的进步,地塞米松等先后在我国实现工业化生产[22]。②1960 年,美国 FDA 批准了一种由异炔诺酮和炔雌醇复配而成的口服避孕药,极大刺激了社会对甾体药物的需求[20]。在黄鸣龙教授的领导下,我国也在60年代陆续实现甲地孕酮、炔诺酮和氯地孕酮等口服避孕药的合成,因此,黄鸣龙教授被誉为“中国甾体口服避孕药之父”[22]。③随着甾体制药工业的快速发展,对原料的需求日益增加,而对野生薯蓣皂素资源的野蛮开采导致其日趋枯竭。为解决此问题,我国于1984年首先实现了对野生薯蓣属植物黄姜的“野转家”人工栽培,高峰时期仅我国的种植面积即高达4000 万亩,年产薯蓣皂素约5000 t,可满足全球的生产需求。至此,甾体制药工业彻底摆脱了对野生资源的依赖,产业发展趋于健康平衡,基于Marker 降解的“薯蓣皂素-双烯”工业体系也随之走向成熟(图1)[23]。
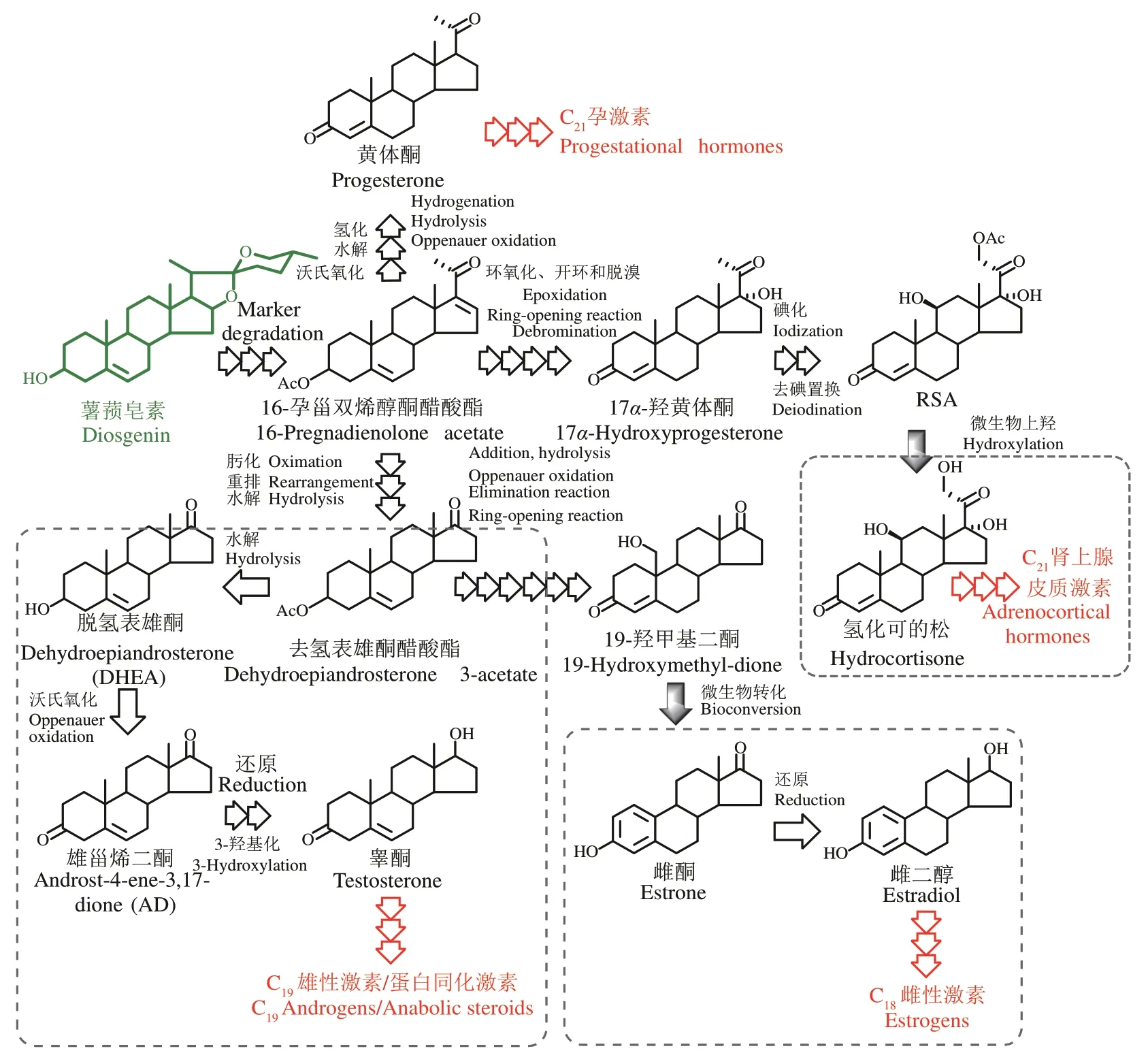
图1 基于Marker降解的甾体半合成工艺体系[24]Fig.1 The semi-synthesis of steroids based on the Marker degradation technology
(4)转型升级阶段(20世纪90年代至今) 随着野生薯蓣皂素资源趋于枯竭,人们还尝试进行了替代性资源的开发工作。最成功的当属以植物甾醇为原料,通过微生物转化生产雄甾-4-烯-3,17-二酮(AD)、雄甾-1,4-二烯-3,17-二酮(ADD)、9α-羟基雄甾-4-烯-3,17-二酮(9α-OHAD)、21-羟基-23,24-二降胆-4-烯-3-酮(HBC)等中间体,再经化学修饰生产目标甾体药物工艺的建立(图2)。相较之前的“薯蓣皂素-双烯”体系,依赖微生物转化的新体系具有原料来源稳定、反应路线短、收率高、生产成本低且更环保等显著优势。实际上早在1944 年,即已发现微生物具有转化甾醇生成有用代谢产物的能力,然而直到80 年代末,该技术才在德国先令制药公司等得到应用,我国则是在2010 年左右取得突破,并迅速完成了对“薯蓣皂素-双烯”体系的取代。在此期间,基于合成生物学开发甾体药物的微生物全合成技术也已开始萌芽 。 在 1998 年 和 2003 年 ,Pompon 及 Dumas 课 题组通过在酵母引入异源基因,改变内源的麦角甾醇合成路线,实现了黄体酮和氢化可的松等甾体激素的微生物全合成[25-26]。虽然从产量来看,这种策略还仅仅是一种创新性的概念,但此工作有力证实了利用人工生物合成甾体药物的可行性,自此甾体制药技术迎来一个全新阶段。
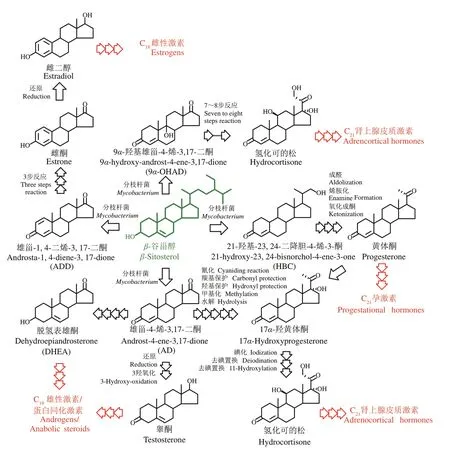
图2 基于甾醇微生物转化的甾体半合成工艺体系[24]Fig.2 The semi-synthesis of steroids based on the microbial transformation of sterols
2 甾体生物催化转化酶的挖掘及改造
甾体大都具有相同的母核结构,取代基的位置和构型,是决定药物功效的关键。例如,氢化可的松与表氢化可的松仅存在11 位羟基构型的不同,但前者可与糖皮质激素受体结合发挥功能,后者则无法正常结合此类受体[27],导致二者的药用价值差异巨大。在甾体药物的生产中,通常需对母核的部分惰性位点进行特定取代基的构建。鉴于化学合成法存在选择性差、反应复杂、产物得率低等问题,常需借助生物催化转化,以实现功能化修饰反应。当前,甾体制药工业具有重要应用价值的生物催化反应主要有三类,分别是立体选择性羟基化、区域选择性脱氢和酮基不对称还原[28-30]。由于均为氧化还原反应,涉及复杂的电子传递系统,异源高效表达难度较大,因此长久以来工业多采用微生物活细胞转化的方式,实现上述的功能化反应。近几年,随着基因组挖矿和编辑技术的成熟,高催化活性和高选择性的新工程菌得以不断开发,具有反应时间短、副产物少、产品易精制等突出优势的酶法催化,也得到越来越多的应用。
2.1 甾体羟化酶的挖掘及改造
通过向母核引入特定构型的羟基化基团,可赋予甾体不同的应用价值,其中尤以11β、11α、9α、7β位的羟基化产物价值最为突出。甾体羟基化多由P450 单氧化酶催化,该酶多以跨膜或细胞膜锚定的形式存在,需要复杂的电子传递系统[31],因此很难在微生物细胞高活性表达[32]。由于丝状真菌具有复杂的次级代谢,并且通常含百余个甚至几百个P450 氧化酶,因此工业上常使用丝状真菌来执行甾体的羟基化反应。
11β位羟基是氢化可的松、地塞米松、倍他米松等糖皮质激素药物的关键基团,可由丝状真菌新月弯孢霉(Curvularia lunata,有性态Cochliobolus lunatus)或蓝色犁头霉(Absidia coerulea)催化实现,然而此步骤的整体效率低,立体选择性也较差。2019 年,Beatriz Galán 等首次在C. lunatus中鉴定了一个11β-羟基化酶CYP103168 及其还原酶CPR64795,并成功在谷氨酸棒杆菌实现了异源表达,使副产物的生成显著降低,产品得率相应得到提升[33]。随后,张学礼课题组从犁头霉A.orchidis获得了另一种11β-羟基化酶CYP5311B2 及其氧化还原酶。由于该酶在催化11β-羟化的过程中,会伴随生成20%的11α-羟化副产物,通过蛋白质工程改造,使突变体的活性提升了约3倍,结合对菌体的优化改造,最终获得一株可高效转化11-脱氧皮质醇,生成氢化可的松的基因工程菌,培养48 h的产量达1060 mg/L,最高产率为667 mg(/L·d)[34]。
11α位羟基是依普利酮、脱氧孕烯等药物的重要基团[30,35],通常由黑根霉(Rhizopus nigricans)、赭曲霉(Aspergillus ochraceus)等丝状真菌发酵转化而来。针对该酶的挖掘,天津科技大学路福平教授课题组做出了突出贡献,近几年陆续完成了对工业用11α羟化菌株关键酶的鉴定。2016年,该课题组在黑根霉TCCC 41047中筛选鉴定出3个可以转化16,17α-环氧孕酮的11α羟化酶[36]。2017年,又从蓝色犁头霉AS3.65 中鉴定出新的11α羟化酶CYP5311B1,然而表征结果显示,该酶仅限于催化 16,17α-环氧孕酮底物[37]。随后在 2020 年,该课题组进一步从赭曲霉TCCC41060 分离得到了两个受甾体化合物强烈诱导表达的P450 酶CYP68L8和CYP68J5,其中CYP68J5能特异性地针对16,17α-环氧孕酮进行11α羟化[38],这一系列的工作为改良现用工业菌种,或开发高效的11α羟化酶基因工程菌奠定了坚实基础(表1)。
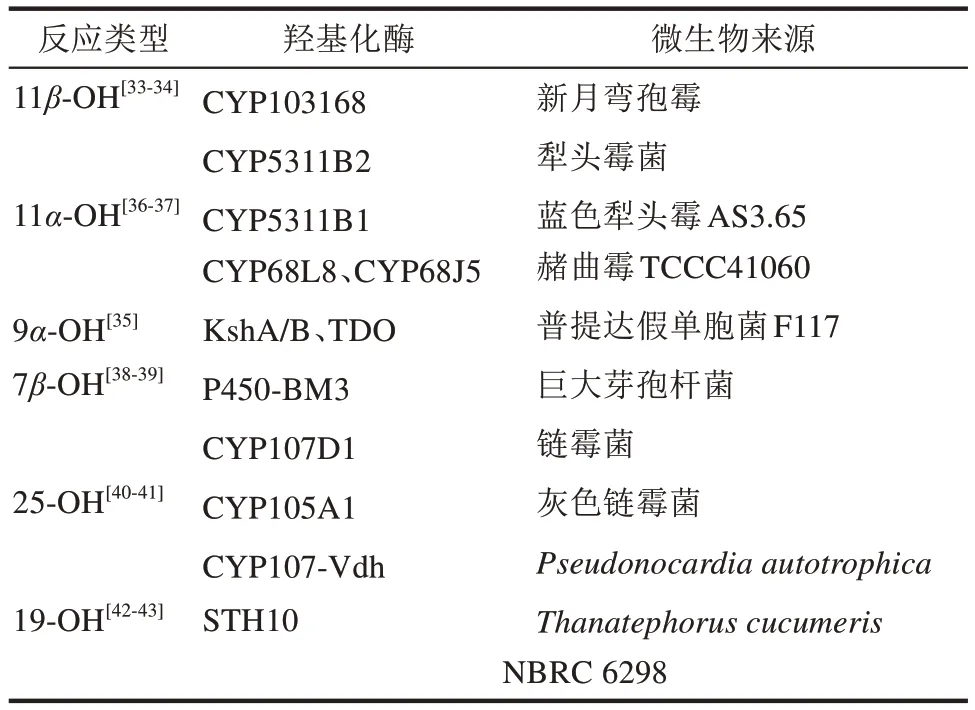
表1 甾体化合物羟基化反应的类型Tab.1 Types of steroidal hydroxylation
借助9α羟基化酶的催化在9α位引入氟等卤素,可用于制造地塞米松、倍他米松等高端甾体。以此为基础,结合化学转化引入9(11)双键,或在 11 位引入酮基、11β或 11α羟基等,通常可获得更理想的上羟收率。9α羟化酶多源于分枝杆菌、红球菌等放线菌,该酶是一种双组分ⅠA 型单加氧酶,包括Rieske 型单加氧酶(KshA)和铁氧还蛋白还原酶(KshB)。由于KshA 发挥功能需与还原伴侣KshB共表达,导致9α羟化酶系的异源活性表达难度较大。为解决此问题,天津科技大学路福平教授课题组在大肠杆菌中构建了一种高活性的人工9α羟化酶系统。通过重构NADH 的再生系统,利用来自普提达假单胞菌F117 的甲苯2,3-氧化还原酶TDO-R 代替KshB,与一个Rieske[2Fe-2S]铁氧还蛋白TDO-F的融合表达后,使电子转移效率提高176.3%,在以雄甾-4-烯-3,17-二酮为底物时,最终可产5.24 g/L的9-OHAD[36]。
7β羟化产物及其衍生物,具有良好的神经保护和抗炎活性,可用于治疗慢性神经元损伤等。然而微生物对7β羟化的选择性较低,同时因副产物较多等,工业酶的开发难度较大。2020 年,通过对巨大芽孢杆菌源的单加氧酶P450-BM3 活性中心15 个氨基酸位点的突变,湖北大学李爱涛课题组筛选获得了一种对C19甾体分子具有高区域和立体选择性的突变体[39]。此外,7β羟基也是胆酸类甾体药物的关键基团,2021年,德国的Bornscheuer教授课题组筛选获得了一种可以廉价的石胆酸为底物进行7β羟基化直接生成熊去氧胆酸的链霉菌源CYP107D1,随后通过半理性设计,成功获得了区域和立体选择性接近完美的突变体,为熊去氧胆酸等胆酸类药物合成路线的革新提供了可能[40]。
除在甾核上的羟化反应之外,在甾体侧链或角甲基等位置的羟化反应,也具有极重要的工业价值。例如,维生素D 是一类甾体型维生素,其侧链25 位羟基基团是发挥功能的关键,而在已鉴定的25-羟化酶中,来自Streptomyces griseolus的CYP105A1和放线菌Pseudonocardia autotrophica的CYP107-Vdh 均具有良好的催化表现[41]。2013 年 ,Tamura 课题组通过蛋白质工程获得了一个Vdh 的突变体VdhT107A,随后通过在Rhodococcus erythropolis的异源表达、NADH 重生和细胞壁合成抑制等优化手段,最终获得一种可在2 h 内实现催化转化573 mg/L 产物的高效催化剂[42]。又如甾体的 19 位羟基化反应,可用于米非司酮、炔诺酮和雌激素等药物的生产。2018 年,朱敦明课题组报道了一种来源于Thanatephorus cucumerisNBRC 6298 的P450 酶STH10,通过在毕赤酵母的异源重构表达,实现了对脱氧可的松C19 位和C11 位的羟基化反应,这也是首次报道能够在C19 位甲基上羟的P450 酶[43]。随后,武汉大学瞿旭东课题组利用此酶进行了系统的优化重建,通过发酵条件优化及底物的结构修饰,实现了利用可托多松高选择性催化合成19-羟化可托多松,由此出发借助化学合成获得了多种19-羟甾体药物[44],为开发合成甾体19位羟基化的高效细胞工厂提供了新的候选途径。
2.2 甾体脱氢酶的挖掘及改造
双键是大部分甾体药物的必需官能团,如4(5)双键、5(6)双键、1(2)双键、7(8)双键和9(11)双键等。在甾体的半合成中,选用薯蓣皂素或甾醇为原料,原因之一在于这类分子具有5(6)位双键,而此双键很容易易位到4(5)位,可省去在 4(5)或 5(6)位引入双键的复杂步骤。工业上常借助生物催化实现向甾核引入双键的反应,其中以C1,2位的转化脱氢最为重要。在自然界,以分枝杆菌和节杆菌为代表的放线菌等,均可催化实现C1,2位脱氢,但此类微生物对甾体的降解能力较强,因此只有个别丧失此能力的菌株才可用于工业生产。此过程中,发挥核心催化功能的是一种FAD依赖型黄素酶,即3-酮基甾体-Δ1-脱氢酶(KstD)。近些年,随着对KstD的不断挖掘和异源高效表达研究,采用酶催化实现脱氢正在逐步替代微生物发酵转化的脱氢技术。2018年,天津科技大学路福平教授课题组对来自简单节杆菌的KstD3进行分子对接和定点饱和突变,有效扩大了酶与底物的结合口袋,减轻了空间干扰,使突变体对AD等底物的催化效率提高近3倍,而采用酶催化和静息细胞转化的方式可分别获得71%和95%的ADD得率,相比对照菌则分别提高了33%和20%[45]。同年,张保国课题组从新金分枝杆菌DSM 1381 中筛选了3种KstD,其中酶活力最高的KstD2工程菌可在15 h 内以高达99%的转化率将8 g/L AD 转化为ADD[46]。2020年,王敏教授课题组从简单节杆菌中鉴定出了通用性更高的KstD5,该酶不仅底物谱宽,还可催化多种重要的甾体药物,同时具有良好的有机溶剂耐受性,因此可通过在反应体系添加有机溶剂助溶甾体底物,大幅提高底物的投料浓度[47]。
此外,7(8)位双键是蜕皮激素等甾体的重要基团,也是维生素D3前体7-脱氢胆固醇的关键结构。然而,对甾体进行7(8)脱氢十分困难,往往需经过曲折复杂的化学转化才能实现。2011 年,Yoshiyama-Yanagawa 等[48]在解析蜕皮激素合成路线的过程中,发现了一种在无脊椎动物高度保守的Rieske 型7(8)位脱氢酶,该酶在昆虫中被称为Neverland,在线虫中被称为DAF-36,在还原伴侣蛋白的作用下,Neverland/DAF-36(简称NVD)可直接催化胆固醇生成7-脱氢胆固醇,这与脊椎动物体内的合成路线完全不同,这意味着如能在微生物中实现该酶的异源表达,将极大地提高维生素D3等相关化合物的生产效率。近几年,路福平教授课题组通过深入的异源表达研究,于2019年在昆虫卵巢细胞Sf9 中成功实现果蝇来源NVD 的异源表达。此后,为实现工业应用目的,该课题组又测试了利用大肠杆菌异源活性表达NVD 的可能性,然而由于该酶发挥功能所需的还原伴侣蛋白尚未得到鉴定,NVD在大肠杆菌的表达主要以包涵体形式存在。随后,通过在N末端尝试添加麦芽糖结合蛋白(MBP)可溶性标签,该课题组最终成功获得了纯度为95.4%的可溶性NVD蛋白[49]。2020年,通过对融合蛋白特性的进一步研究发现,使用MBP标签可增加NVD的热稳定性[50],由此为推动NVD重组工程菌的开发奠定了重要基础。
2.3 甾体酮基还原酶的挖掘
在甾体制药体系中,常常还会涉及在甾核C3、C11、C17 等位置进行酮基与羟基的转换反应。由于甾核羟基具有特定的立体构型,因此酮基与羟基间的转换往往需保持高度的区域和立体选择性。在自然界中分布广泛的酮基还原酶,多为短链脱氢酶/还原酶(SDR)、中链脱氢酶/还原酶(MDR)或醛糖酮还原酶(AKR)蛋白超家族成员,可专一性催化实现甾体的酮基立体还原。 1956 年Marcus 等最早介绍了一种睾丸梭菌来源的3α-羟基甾体脱氢酶/羰基还原,该酶不仅具有氧化还原3α-羟基甾体底物的功能,而且可催化一些非甾体醛或非甾体酮的还原反应[51]。由于酮基还原酶在医药中间体生产领域具有广泛而深入的研究基础,在此不再过多赘述。
3 微生物代谢转化甾醇机制的解析及转化细胞工厂的开发
甾醇等甾体分子在动植物和真菌中普遍存在,而大多数原核生物因缺乏角鲨烯单加氧酶和角鲨烯环化酶等关键酶,无法自主合成甾醇分子。然而有意思的是,自然界却存在许多可彻底降解甾醇,为自体生长和生理代谢提供碳源和能量的原核微生物,如芽孢杆菌属(Bacillus)、短杆菌属(Brevibacterium)、细杆菌属(Microbacterium)、分枝杆菌属(Mycobacterium)、 诺卡氏菌属(Nocardia)、假单胞菌属(Pseudomonas)、红球菌属(Rhodococcus)以及链霉菌属(Streptomyces)等[11,52-60],其中以分枝杆菌属和红球菌属的甾醇代谢能力最强。基于此,通过对微生物甾醇降解途径的代谢工程改造,可获得一系列具有积累甾体医药中间体能力的微生物细胞工厂(图2、图3),如C19型甾体[61-62]、C22型甾体[63]和A环降解物等。从这些分子出发,结合化学或微生物修饰衍生,可完全代替基于Marker 降解的“薯蓣皂素-双烯”工业体系,用于肾上腺皮质激素、孕激素、性激素等几乎所有临床用甾体激素药物的生产。
3.1 甾醇微生物代谢途径解析与途径工程改造
微生物对甾醇的降解途径可分为两类,即好氧代谢和厌氧代谢[64]。由于厌氧代谢效率低,工业常利用好氧代谢转化甾醇生产甾体医药中间体。2007 年,van der Geize 等[65]在红球菌和结核分枝杆菌中首次发现了甾醇降解基因簇。该基因簇由223个基因组成,其间散布着51个与降解高度相关的基因,这为理解微生物对甾醇的氧化代谢机制,以及通过理性的代谢工程改造开发高效转化甾醇的细胞工厂铺平了道路[66-67]。此外,研究表明在分枝杆菌中除上述基因簇之外,还有一些小的基因簇同样也参与了甾醇的降解,这些小簇通常负责编码限速步骤的同工酶,可对这些步骤起强化作用。由于这些同工酶在微生物间差别较大,从而可赋予菌株差异明显的降解能力[61,68]。以胆固醇为例,微生物对甾醇的降解,大致分为母核裂解和 C17 位侧链的β-氧化[66-67],这两部分混杂进行[69-70],为了更清晰地阐述甾醇的代谢机制,我们将按图3这种简化方式进行描述。
3.1.1 甾体母核降解途径及改造
微生物对甾醇的降解,始于胆固醇氧化酶(ChO)催化3 位的β羟基生成胆甾-4-烯-3-酮,此为甾醇分解代谢的限速步骤[71-73]。随后,在KstD和3-甾酮-9α-羟基化酶Ksh 的共同作用下,甾体母核B 环开裂,所产生的开裂物最终被降解为丙酰CoA 和丙酸盐等短链分子[66,74]。在不干扰 C17 位侧链降解的前提下,对母核降解途径的改造,可获得两类重要的甾体医药中间体(图3):C19型甾体,如 AD、ADD、9α-OHAD 等;A 环降解物,如谷内酯(HIL)等。C19型甾体是甾醇微生物转化体系的主要部分,可用于肾上腺皮质激素和性激素的生产。为开发高效的C19型甾体微生物细胞工厂,通常需集中改造母核降解途径中由ChO、KstD 和Ksh催化的三步关键反应[75]。
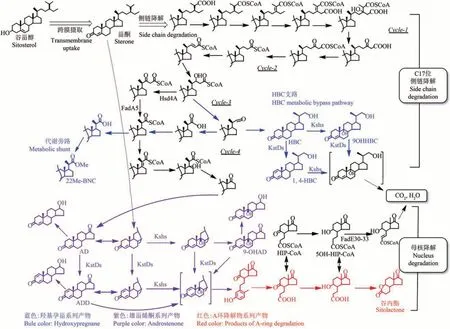
图3 甾醇的微生物分解途径Fig.3 The catabolic pathway of sterols in microorganisms
ChO 是一类界面酶,通常定位于细胞膜,需FAD 辅基的参与才能发挥催化活性,根据二者结合方式的不同,ChO 可分为FAD 非共价结合型(Ⅰ型)[76-78]和 FAD 共价结合型(Ⅱ型)。2013 年,通过挖掘Mycolicibacterium neoaurumATCC 25795的基因组信息,两个分别定位于胞内和胞外的ChO 同工酶ChoM1 和ChoM2 被发现,这种定位模式使位于细胞外膜的甾醇可被高效地氧化为胆甾-4-烯-3-酮,实现从不溶性甾醇颗粒上的快速解离;此外,已进入膜内的甾醇分子,在内膜ChO 的催化下迅速脱离细胞膜的束缚,可更快地进入胞质启动后续的氧化降解。因此,ChO 的活性是决定甾醇转化的第一个限速因素。在构建AD 等生产菌种时,通过代谢强化ChoM1 和ChoM2 的表达,可使工程菌的生产能力提高约50%[68]。值得一提的是,在分枝杆菌等微生物中,除了ChO 之外,3β-羟基甾体脱氢酶(3β-HSD)也能氧化甾醇生成胆甾-4-烯-3-酮,并且在结核分枝杆菌和耻垢分枝杆菌等微生物中,3β-HSD 甚至可取代ChO 发挥主要的催化功能[71-73]。
KstD 和Ksh 则是决定C19型甾体能否生成和产物选择性的关键酶,C19型甾体具有完整的母核结构,为阻止母核发生降解,KstD 和Ksh 不可共存,至少需选择性地阻断其中之一的活性,同时还需根据目标产物有针对地强化KstD 或Ksh 活性,以减少副产物的生成。具体来说,为获得特定的C19型甾体产物,需对KstD和Ksh进行如下改造:①对于AD 生产菌种的开发,需同时失活KstD、Ksh 及其同工酶;②对于9α-OHAD 生产菌种的开发,则需在保留Ksh 的同时,使KstD 及其同工酶彻底失活,此外根据副产物AD 的积累情况,还需强化Ksh的表达,以保证AD能够完全转化为9α-OHAD;③而对于ADD 生产菌种的开发,则需在保留KstD的同时,使Ksh及其同工酶彻底失活,根据副产物AD 的积累情况,视情况强化Ksh 的表达,以保证AD能完全转化为ADD[62]。
在甾醇降解过程中,KstD 是催化3-酮-4-烯类甾体生成 3-酮-1,4-二烯型甾体的关键酶[46,61]。通常微生物源KstD 会有3 个以上的同工酶,这种特征很可能赋予菌株作用于多种底物,以及更强的甾醇降解能力[79-81]。然而此情况也导致在开发AD和9α-OHAD 等工程菌的过程中,需挖掘并采用同源重组等方法敲除所有的KstD 功能酶基因,以降低副产物的生成,确保整体收率[61]。Ksh 是负责催化3-酮基生成9α-羟基化产物的关键酶,可单独用于甾体药物的催化转化[82]。Ksh 酶活性的不足也是目前9α-OHAD 生产菌存在的重要问题之一,会导致AD 等副产物的生成。与KstD 类似,Ksh在微生物中也会存在多达2~5 个同工酶[83],因此在涉及AD 和ADD 等菌株的开发中,需对其进行彻底敲除;而针对9α-OHAD 生产菌种的开发,则需强化多种KshA 酶的活性。谷内酯是在母核降解过程的另外一种重要代谢产物,可用于米菲司酮和雌激素等19-去甲甾体药物的合成。该物质由母核A 环降解后转化生成,失活酰基-CoA 脱氢酶FadE30-33 等,可阻断其下游的降解步骤(图3),实现谷内酯的积累生产[84]。
3.1.2 甾醇侧链的降解途径及改造
在好氧微生物中,甾醇C17侧链的氧化降解始于 P450 酶对胆甾-3-酮-4-烯 C17 侧链末端 C26 或C27 位的羟基化和连续氧化,在生成胆甾-4-烯-3-酮-26-羧酸后,经酰基-CoA连接酶(如FadD19[85])的催化酯化,生成胆甾-4-烯-3-酮-26-羧酸CoA,随后进入一种类似于脂肪酸β-氧化降解的过程[66]。在厌氧微生物中,甾醇侧链的代谢则明显不同,其降解始于C25 位的羟化[86],再转移为 C26 位羟基,随后才以一种类似于好氧代谢的过程进行[69]。
以谷甾醇为例(图3),除侧键末端的氧化反应外,主要由酰基-CoA 脱氢、烯酰-CoA 水合、β-羟酰-CoA 脱氢、β-酮酰-CoA 硫解等β-氧化反应组成,经四轮β-氧化,共产生2 分子丙酰CoA 和2 分子乙酰CoA[87]。此外,由于受母核结构的影响,甾醇侧链β-氧化最后一轮的特异性要显著高于前几轮[88-89]。美国石溪大学的Sampson课题组对催化此过程的关键酶鉴定和表征做出了重要贡献[90-92],由该课题组首先鉴定的操纵子igr,包含了多个影响侧链最后一轮β-氧化的重要基因,为更好地理解最后一轮β-氧化机制奠定了基础[93-94]。甾醇C17位侧链经完全降解生成C17位酮基,该步骤是通过阻断母核降解生产C19型甾体和A 环降解物等有用产物的重要前提,也是活化后续降解的关键步骤。在分枝杆菌和红球菌中此步反应主要由CYP142 和CYP125 催化完成,二者在侧链末端上羟后均能继续氧化生成胆甾-4-烯-3-酮-26-羧酸[95-96],其中以CYP125 更为关键,在该酶发生功能缺失时,菌体可经胆甾-4-烯-3-酮诱导,上调CYP142 的表达,以提高相应的催化能力[96]。鉴于CYP125对侧链降解的重要性,通过强化表达可提高转化甾醇生产有用代谢产物的效率[97]。
在阻断母核降解的同时,针对侧链降解基因的改造,也可获得一系列有用的侧链不完全降解产物,如 4-HBC、1,4-HBC 等 C22型甾体[63],可用于孕激素、肾上腺皮质激素等甾体药物的生产。2016 年,在对C22型甾体转化机制的研究中,一个具有双功能的短链脱氢酶Hsd4A得以鉴定,该酶既具有17β-羟基甾体脱氢酶活性,可转化AD 生成睾酮,又具有β-羟酰-CoA脱氢酶功能,是侧链降解第3轮的关键酶(图3)。随后,通过失活该酶,有效阻断了侧链的β-氧化,使甾醇降解被导向“HBC 代谢支路”。先前,HBC 是源于AD 等生产过程的一种副产物,纯化难度大,生产成本高。通过对Hsd4A、KstD以及Ksh 基因的组合改造,可分别获得积累4-HBC、1,4-HBC和9α-OHHBC等代谢产物的工程菌株,有效用于黄体酮等甾体药物的生产过程。
3.2 甾醇转化微生物细胞工厂的优化改造
在自然界,分枝杆菌等之所以能有效降解甾醇,一方面是因其内含甾醇降解途径,另一方面则是得益于菌株的特殊被膜结构[91-92,98-99]。该结构的核心是一层由分枝酰-阿拉伯半乳聚糖-肽聚糖复合体组成的不对称共价结构,在此之外还分布着一层极性的脂质被膜,包括海藻糖单霉菌酸酯(TMM)、海藻糖双霉菌酸酯(TDM)及多聚糖等[92]。这种结构既赋予了细胞表面的亲脂性,有利于对疏水甾体颗粒的捕捉黏附,但同时也造就了细胞被膜的高度致密性,不利于甾醇分子向胞内的转运,特别是在AD 等产物过量积累的情况下,分枝杆菌等常通过调整细胞壁的厚度增加致密性,导致甾醇向胞内的转运效率降低[6,100]。鉴于在甾醇转化的过程中,通过添加细胞被膜合成相关的抑制剂,可显著提高细胞对甾醇的摄取效率[52,101-103]。受此启发,针对性优化改造细胞被膜结构,可开发高效摄取转化甾醇的微生物细胞工厂。研究表明,膜转运蛋白MmpL3 参与了分枝杆菌细胞被膜结构的组装合成[92,104],通过敲除对应的编码基因mmpL3,可明显提高细胞的通透性,增加菌体对甾醇底物的转化速率[97]。随后的多项研究表明,破坏分枝菌酸合成的关键基因kasB[8],以及阿拉伯半乳聚糖合成的关键基因embC[105],均可在一定程度上抑制细胞被膜的合成,有效增强分枝杆菌对甾醇类底物的转化效率,9α-OHAD的产率可增加11.2%~34.5%。
甾醇代谢机制十分复杂,涉及中心代谢、细胞被膜合成和能量代谢等多方面的适应性变化,通过多组学的系统比对,更清晰地了解细胞的生理代谢变化,可为优化甾醇转化细胞工厂的性能提供更多备选靶点[83,106-107]。基于转录组分析发现,SigD 因子的转录与分枝杆菌代谢甾醇的过程具有一定的相关性,删除该基因可显著提升9α-OHAD 等中间体的生产效率[108]。随后,通过失活SigD 级联调控通路上游的调控因子Rip1,获得了更明显的产量提升效果[109]。经进一步的分析显示,此类转录因子的失活,影响了菌体被膜合成及代谢相关基因的转录,鉴于其对甾醇转化的促进可能是一种综合性的表现,相关的代谢机制仍有待深入研究。此外,由于甾醇降解是一个产能过程,以谷甾醇为底物转化生产9α-OHAD 为例,1 mol 的谷甾醇可产生约 10 mol 的 FADH2和 16~18 mol 的NADH[74]。天津科技大学王敏教授课题组经研究证实,NAD+/NADH 的比率是影响分枝杆菌转化甾醇的重要因素,通过表达强化NADH 氧化酶等辅因子的手段提高NAD+/NADH比率,维持细胞的氧化还原平衡,可大幅提高菌体对甾醇的转化[32]。此外,由于甾醇代谢所涉及的辅因子氧化再生等过程,会产生大量的氧自由基ROS,造成严重的细胞毒性,降低菌体细胞的生存能力,进而严重制约甾醇向甾体药物中间体的转化。为此,通过组合强化过氧化氢酶、分支硫醇和麦角硫因这三种抗氧化剂的表达,有效猝灭甾醇降解过程所产生的ROS、维持胞内ROS 水平的稳定,最终使分枝杆菌细胞的存活率提高54.2%,甾醇转化生成4-HBC的能力提高达47.5%[110]。
综上,在甾醇途径改造工程的基础上,通过对代谢过程中细胞生理的综合改造,可使微生物细胞工厂具备更好的应用性能。虽然从多角度出发的优化方案,已取得了一定的效果,但这些改造方案的集成和协同机制复杂,有待进行更深入的探索研究,以期能进一步提高工业菌种的生产性能。
4 微生物从头合成甾体人工路线的创建
当前,普遍使用的甾体药物,多以天然甾体分子为骨架,经人工半合成而来。因此,如能以微生物为底盘,全合成相关甾体型天然产物,或实现进一步的转化衍生,则很可能颠覆当前复杂的生产体系,真正实现甾体药物的绿色生物制造。相对于半合成体系,甾体的生物合成有以下优势:①无需从动植物提取甾体分子,可彻底解决原料来源不足等问题;②减少重金属催化剂和易燃易爆有机溶剂的使用,降低反应过程的危险性和污染物排放;③简化甾体的半合成路线,减少生产步骤,缩短生产周期。以氢化可的松的生产为例,如采用半合成模式,从原料到产品一般需8~10步的转化步骤,而经人工体系理论上只需1步即可实现氢化可的松的合成[26]。
4.1 甾体的生物合成途径
在自然界,天然甾体的合成路线大致相同。以三萜合成途径为基础,利用环氧角鲨烯为关键前体合成甾醇类化合物(图4),再经氧化、糖化等后修饰,最终生成各种甾型天然产物。在动物体内,甾体由环氧角鲨烯出发经羊毛甾醇、酵母甾醇等中间体转化合成,并在不同的器官根据机体需要,合成各种内分泌甾体激素(图5)。在植物体内,往往也能经此途径合成甾醇,并进一步生成皂苷等甾体次生代谢产物,但除此之外,在植物体内还有一条更为重要的植物甾醇合成途径,即从环氧角鲨烯出发,经环阿屯醇生成菜油甾醇、谷甾醇和豆甾醇等多种植物甾醇,再生成芸苔素内酯等植物激素。在真核微生物中,从环氧角鲨烯出发,可通过类似于胆固醇的代谢途径生成麦角甾醇,再经转化修饰生成一系列的甾型次级代谢产物[111-112]。具体而言,甾体的生物合成途径可分为三个模块:角鲨烯合成模块、甾醇合成模块和甾体转化修饰模块。
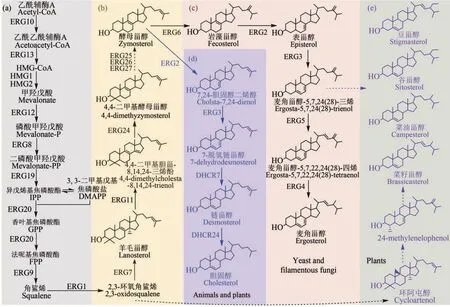
图4 不同生物体内的甾醇合成路线Fig.4 The biosynthetic pathway of sterols in organisms
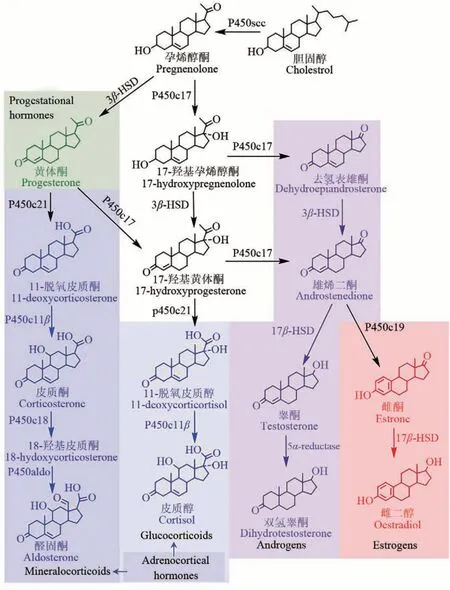
图5 甾体激素生物合成途径Fig.5 The biosynthesis pathway of steroidal hormones
(1)角鲨烯合成模块[图4(a)][113-114]角鲨烯是一个典型的三萜化合物,其合成过程可细分为两部分:①异戊烯焦磷酸(IPP,C5)的合成。IPP 是萜类化合物的基本单元,可从乙酰辅酶A 出发由甲羟戊酸途径(MVA 途径)合成,或从丙酮酸和甘油醛-3-磷酸出发,通过5-磷酸-D-脱氢木酮糖/2-甲基-D-赤藓糖醇-4-磷酸酯途径(DOXP/MEP途径)合成。②从IPP 至角鲨烯(C30)的合成。IPP在异戊烯基焦磷酸异构酶(IDI)的催化下,可转化为同分异构体甲基丙烯基焦磷酸(DMAPP),二者经法尼基焦磷酸合成酶(FPPS)的催化缩合,可依次形成牻牛儿基焦磷酸(GPP,C10)和法尼基焦磷酸(FPP,C15),随后2 分子FPP 在鲨烯合成酶的催化下,形成1分子的鲨烯。近期,利用酿酒酵母为底盘,本课题组采用过氧化物酶体区室化策略,结合多酶组装表达技术,成功构建了一株可高产角鲨烯的酵母平台,在5 L 生物反应器分批补料的培养条件下,角鲨烯的最高产量可达11.0 g/L[115]。进一步地,通过结合线粒体区室化策略,目前的产量已突破25 g/L,干细胞的角鲨烯含量最高达50%(结果尚未发表)。
(2)甾醇合成代谢模块[图(4b)~(e)][116-118]从角鲨烯出发,经角鲨烯环氧化酶催化生成2,3-环氧角鲨烯,再经环氧角鲨烯环化酶催化,生成三萜甾醇化合物(C30)(一般来说,在动物和真菌中为羊毛甾醇,经修饰转化为胆固醇或麦角甾醇;在植物中为环阿屯醇,再经衍生为植物甾醇)。由于麦角甾醇、胆固醇和植物甾醇等,在结构和合成路线上的高度相似性,因此可利用含有麦角甾醇合成路线的酵母等真核底盘,对甾醇合成模块进行改造重建,从而获得可生产一系列甾醇分子的基因工程菌。2011年,Riezman等在酿酒酵母中通过功能性失活C24位甲基化和C22位脱氢的关键酶ERG5 和ERG6,彻底阻断麦角甾醇的合成,随后通过引入C7位还原酶基因DHCR7,获得了可稳定生产菜油甾醇的基因工程菌株。进一步通过继续引入DHCR24 基因,该课题组成功创建了可稳定合成胆固醇的工程化酿酒酵母[119]。
(3)甾体转化修饰模块 从特定的甾醇分子出发,经不同生物差异化的修饰衍生,从而产生了天然甾体的多样性[120]。例如,在哺乳动物体内,胆固醇可由CYP11A1经三步连续的羟化氧化,使C20—C22 键发生断裂形成孕烯醇酮[121],此时如再经3β-HSD 的催化,即可生成黄体酮,而孕烯醇酮和黄体酮被运输至不同腺体后,经C11β、C17α羟基化、C17β酮基还原、C21 侧链裂解等,又可形成不同类型的甾体激素(图5)。显而易见的是,这些修饰酶的工业应用价值巨大,如能高效地实现异源活性表达,则可有效用于甾体药物的转化。另外,如利用此类酶组装级联反应,对接甾醇合成模块,即可构建直接合成甾体药物的细胞工厂。值得一提的是,在动物体内,从胆固醇出发除能转化合成甾体激素外,还有两类重要的非激素甾体功能分子,即维生素D3和胆酸。维生素D3是由胆固醇经7位脱氢生成7-脱氢胆固醇再经紫外线照射转化生成,需经25-羟化酶(CYP2R1或CYO27A1) 以及 1α-羟化酶 (CYP27B1) 的催化,生成其活性形式,即25-羟维生素D3和1,25-二羟维生素 D3[122-123]。 此 外, 维 生素 D3经CYP11A1 的催化,可启动另一条非典型的活化途径[123-124],即在 7-脱氢胆固醇和维生素 D3的 C20 或C22 位发生羟基化,再经CYP27A1、CYP24A1、CYP2R1 或CYP3A4 的选择性羟基化,从而形成结构多样的活性维生素D3衍生物[125-126]。胆酸的合成也是由P450 酶所主导,在CYP7B1、CYP8B1和CYP27A1 等的联合作用下,最终生成胆酸及其衍生物等[127-128]。
基于上述三个模块的特点,利用微生物底盘创建甾体药物合成细胞工厂的思路即已非常清晰。①选择合适的底盘。尽管“角鲨烯合成模块”普遍存在,但“甾醇合成代谢模块”通常只存在于酵母和丝状真菌等微生物中,加之合成的甾体分子为真核来源,因此酵母或丝状真菌等均可作为候选底盘。②途径的整体设计与改造。需根据目标甾体分子,选择具体的甾醇前体,通过对底盘菌麦角甾醇途径的改造,创建可合成特定甾醇分子的工程菌。③构建“甾体转化修饰模块”。该模块所涉及的P450 氧化酶等,通常难以在微生物细胞高效表达,这也是限制甾体微生物全合成细胞工厂开发的关键瓶颈之一。针对此问题,除需加强对已知动植物源P450 酶的工程化表达和优化改造,提出更行之有效的改造策略和方法之外,还可通过加强对微生物源P450 酶元件的挖掘,以取代这些难以表达的真核来源P450酶。
4.2 甾体微生物全合成的进展
随着合成生物学技术的快速发展,甾体的微生物全合成研究已经取得了多项重要进展。由于酿酒酵母自体拥有麦角甾醇的合成能力,因此可作为从头全合成甾体的良好底盘。早在1998 年,Pompon 课题组即利用该菌,通过破坏甾醇C22 位脱氢酶ERG5,阻断麦角甾醇的合成,同时利用引入的拟南芥源C7-脱氢酶、牛源胆固醇侧链降解酶系统(P450scc、ADR和ADX)等,成功实现了孕烯醇酮的微生物全合成。随后,借助人源3β-HSD酶的催化,又进一步创建了从简单碳源到孕酮的人工从头合成途径,开创了利用微生物直接合成甾体药物活性成分的研究[25]。2003 年,在Sanofi-Aventis 公司的资助下,Dumas 等[26]通过向酵母引入多达十余个基因,改变内源的麦角甾醇合成路线,实现了氢化可的松的人工微生物全合成。这两项工作有力证实了利用微生物从头全合成甾体药物的可行性,开启了甾体绿色生物制造研究的新局面。此后十余年,利用人工生物系统陆续在萜类[129-130]、 糖 苷 类[131-132]、黄酮类[133-134]及有机酸[135-136]等天然产物的合成方面取得了一系列的重要成果,但在利用微生物一步发酵合成甾体药物(中间体)等领域,突破性进展却十分有限,一直未见成功的产业化案例,关键原因可能在于甾体的合成路线过于复杂,且涉及多步难以有效异源表达重建的P450 酶氧化反应。值得一提的是,2018年,Corinne等基于Dumas的工作,对P450scc、ADX、P450c11 和3β-HSD 等功能基因进行了多拷贝基因整合表达,成功将氢化可的松的产量提升到了120 mg/L[137],这也是目前欧洲生产氢化可的松的主要路线。
在国内,天津大学的元英进院士课题组,在利用甾醇途径向下游延伸合成的领域深耕数年,也取得了多项重要进展。2015 年,通过阻断内源性麦角固醇合成途径,引入异源24-脱氢胆固醇还原酶DHCR24,该课题组首次在酿酒酵母实现了从葡萄糖到7-DHC(合成维生素D3的重要前体)的从头合成[138]。随后,在先行失活C22 位脱氢酶ERG5 的前提下,通过挖掘鉴定非洲爪蟾等不同来源高活性DHCR7,该课题组利用解脂耶氏酵母底盘建立了菜油甾醇的合成途径,在以葵花籽油作为碳源时,目标产物菜油甾醇的最高产量可达(453±24.7)mg/L[139]。紧接着,通过进一步强化上游途径的过氧物酶体酰基CoA 氧化酶2,同时以具有更高活性的斑马鱼来源DHCR7 替换先前使用的爪蟾DHCR7,使得菜油甾醇的产量被提升至942 mg/L[140]。2019 年,利用上述平台菌株为基础,通过引入由CYP11A1、皮质铁氧还蛋白Adx以及相应的皮质铁氧还蛋白还原酶AdR 组成一个细胞色素P450 侧链裂解酶系统,同时结合元器件的适配优化等策略,元英进院士课题组成功创建了一株孕烯醇酮产量为78.0 mg/L 的解脂耶氏酵母工程菌[141]。除此之外,通过失活酿酒酵母的ERG5,使底盘菌积累麦角素-5,7-二烯醇-3β-醇,由此产物出发,借助引入的C24位还原酶DHCR24的催化,郑裕国院士课题组也于2018 年实现了7-DHC 的微生物全合成[142]。由此可见,近些年国内在甾体活性成分的人工微生物全合成领域,也取得了一系列具有投产潜力的重要进展。然而相比之下,欧美发达国家早在20 多年前即已成功构建了孕酮、氢化可的松等代表性甾体药物的微生物全合成平台。因此,作为甾体药物工业化生产技术的发展趋势,亟待加强针对甾体药物人工微生物菌株创建的基础研发投入,以确保未来我国在此领域激烈的国际竞争中不落下风。
除甾体激素药物之外,利用微生物合成高附加值的稀有甾体型植物天然产物也备受关注,并取得了十分理想的效果。例如,传统中药人参和三七的主要活性成分皂苷Rg1、Rh2及衍生物CK等,具有活血化瘀、预防心血管疾病和抗肿瘤等药用活性。从人参或三七提取此类皂苷,不仅周期长,产物收率低,提取过程还伴随产生大量的化学试剂污染等。鉴于此,利用微生物全合成生产甾体皂苷成为一个研究热点,国内多个课题组在此领域做出了突出贡献。例如,天津工业生物技术研究所的张学礼团队在酿酒酵母成功合成了原人参二醇、原人参三醇等高端人参皂苷化合物[143]。天津大学卢文玉团队利用解脂耶氏酵母为底盘,从木糖出发合成了原人参二醇等[144]。中国科学院分子植物研究中心的周志华课题组,则在甾体皂苷糖苷化修饰基因的挖掘和细胞工厂的优化改造等方面,开展了更为系统而深入的研究,最近该课题组以前期构建的原人参二醇工程酵母为底盘,结合酶工程和代谢工程优化了人参来源的细胞色素P450 酶CYP716A53v2 的活性和表达水平,获得一株产量可达5 g/L 以上原人参三醇的酵母细胞工厂[145]。随后,该课题组通过引入从人参和三七中鉴定表征的多功能UGT-糖苷转移酶,以及拟南芥的UDP-木糖生物合成途径,将PPT 高效转化为皂苷Rg1、Ng1和Ng2,产量分别达1.95 g/L、1.62 g/L和1.25 g/L[146]。此外,基于对UDP-糖基转移酶UGTPg1 的鉴定结果,该课题组于2014 年实现了从葡萄糖到CK 的人工途径的构建[147]。为有效提高CK 的产量,通过优化UGTPg1 的表达水平,提高UDP-葡萄糖的生物合成,减少UDP-葡萄糖的消耗等,最终使CK 的产量达到了5.74 g/L。这些富有成效的工作,使这些稀有甾体皂苷的产量达到了世界领先水平,为通过微生物全合成法生产稀有的甾体皂苷奠定了基础[148]。
5 总结与展望
甾体药物的工业化生产,事关民众健康等众多国计民生的保障需求。然而因其独特的结构和精巧的构型,导致甾体的生产高度依赖于步骤烦琐、污染严重的半合成技术,此为甾体制造成本高居不下的重要原因之一。自1952 年发现微生物转化可用于甾体的区域和立体选择性羟基化起,经过近70 年的发展,生物催化转化已在甾体制造业建立了无法取代的地位。然而现行的“甾醇微生物转化”半合成工艺,仍严重依赖于化学合成,鉴于甾体工业的目标产物大多为自然界已有的天然产物,因此从理论上说,有望升级建立一种以生物转化为主、化学反应为辅的绿色制造新体系。最近十年,“甾醇微生物转化”工艺已迅猛颠覆了老旧的“薯蓣皂素-双烯”体系,下一个十年,或许“甾体微生物全合成”技术又将再次革新甾体制药行业。值得警惕的是,赛诺菲等制药公司早在20 世纪90 年代即已开始围绕“甾体的微生物全合成”布局相关知识产权,目前已拥有数十项专利,如US5635369、US6117649、US10400261B2等。我国在此领域才刚刚起步,大多仍处于跟跑阶段,因此需更加积极地应对,以防少数公司在掌握关键技术后,对全球甾体制造业进行新一轮的控制,使我国再现“卡脖子”难题。
目前,国外对甾体人工生物合成的研究,多以酵母为底盘,通过改变麦角甾醇途径生成胆固醇或植物甾醇,再引入动植物源的元器件“仿建天然甾体的合成途径”。由于元器件数量有限,且缺乏行之有效的异源重构技术等原因,进展异常缓慢。例如,赛诺菲公司针对氢化可的松的从头生物合成,虽已历经20 多年的持续研究,最高产量也仅达到110 mg/L(US10400261B2)。作为甾体制造业的主体,清晰的转化路线和酶催化机制,可为开发“甾体全合成”的微生物细胞工厂提供清晰的蓝图和功能元件。然而有关研究至今尚未取得重大突破,其中的关键瓶颈在于“甾体转化修饰模块”的创建难度较大,包括用于甾体激素转化的酶元件,如P450氧化酶等,多来源于动物,数量有限,缺乏其他来源的有效替代品,难以在人工细胞内表达、组装和优化。针对这些问题,如需推动“甾体微生物全合成”技术的快速发展,可考虑从以下三点开展系统研究:
①甾体转化修饰途径的解析和元器件挖掘。通过从植物、微生物和无脊椎动物等来源,分析鉴定更多样化的甾体转化元器件及代谢新途径,改造关键元器件的结构与功能,揭示并利用甾体转化的新机制,为甾体微生物从头合成的设计与创建提供更多选择。
②甾体生物合成模块的设计与改造。依据“一条主途径多产品衍生”的设计原则,在合适的底盘依次构建“角鲨烯合成”“甾醇合成”“甾体修饰转化”三大模块,开发不同甾体骨架的微生物细胞工厂。随后,根据应用需求,构建即插即用型“甾体转化衍生”模块,实现多样化的甾体生产。同时,还应设计构建与甾体合成相匹配的“能量供给”“代谢流分配”“代谢调控”等辅助模块。此外,鉴于甾体合成过程的混杂性强、缺乏快速检测评估的手段等,在途径创建过程中,应重视多酶组装、传感器实时监控、代谢状态精准分析、转录开关精细调控等使能技术,以保障各功能模块的高效适配组装。
③甾体从头合成细胞工厂的创建与优化。酵母和米曲霉等具有较强的麦角甾醇合成能力,操作工具较成熟,可优先作为底盘菌株使用。然而麦角甾醇具有重要的生理功能,其在胞内的合成代谢往往处于一种稳态平衡,难以过量积累。针对此,需通过深入研究相关的调控机制,探索突破稳态调控的有效方法。另外,在“甾醇微生物转化”体系使用的分枝杆菌内含萜类合成途径,且具有强大的甾体耐受性和转化修饰能力,一旦基于该菌构建“甾醇合成模块”的研究取得突破,即可贯通甾体的生物合成通路。
总体来说,甾体药物的合成路线较长,调控关系复杂,表达重构难度较大,需更多有效的异源表达新方式及策略支撑。通过创建甾体的微生物合成模式,采用一步发酵,实现从葡萄糖等廉价原料直接合成活性的甾体分子,这必将简化生产过程、大幅降低三废排放,真正实现甾体的高端绿色制造。当下,国际竞争加剧,如何通过体系革新,大幅降低生产成本,实现甾体的绿色制造,是行业面临的共同挑战,也是决定企业和国家竞争优势的关键所在。我国甾体制药从业人员应居安思危,致力于开发具有特色的“甾体微生物全合成”技术,以充分保障我国甾体制药行业健康发展。
